茅台镇酱香型白酒酿造环境中真菌菌群多样性分析
黎瑶依,胡小霞,黄永光*
(贵州大学酿酒与食品工程学院,贵州省发酵工程与生物制药重点实验室,贵州 贵阳 550025)
酱香型白酒酿造是一个固态、开放式多菌群、菌种共同发酵的过程,其酿造环境中微生物对酱香型白酒品质的形成密切相关。在酿造过程中,一方面,高温大曲制作及其贮存、酒醅摊晾堆积过程和入窖发酵等生产活动对酿造环境微生物进行长期驯化,从而形成特定的酿造环境微生物生态结构特征[1];另一方面,环境中的部分微生物在酿造过程中会自然迁徙,接种至堆积酒醅、贮存大曲中,再参与到白酒的酿造过程,并在其中增殖、代谢,生成各种风味物质,对酱香型白酒品质的形成起到决定性作用[2-3]。因此,对酿造环境微生物的群落结构多样性进行分析,有助于进一步研究和认识茅台镇酱香型白酒酿造环境与酿造过程中微生物之间的相关性,对酱香型白酒的酿造机制认识具有重要意义。
真菌作为酱香型白酒糖化发酵过程中重要的功能微生物,在酿造过程中主要提供酶动力、发酵动力,对基酒的质量具有重要调控作用。其中,霉菌能分泌多种水解酶类,分解酿造原料中的淀粉、蛋白质等大分子物质,同时也为其他微生物的生长、代谢提供营养和基础物质,对白酒酒体风味形成有重要贡献[4-5]。而酵母菌是酱香型白酒酿造过程重要的产香微生物类群,直接关系到出酒率及微量香气成分的形成,在代谢过程中产生的各种风味物质对酱香型白酒香气的形成起至关重要的作用[6]。霉菌和酵母菌是影响传统固态发酵白酒酿造过程的重要酿造微生物菌群,保证了发酵过程的正常进行,而菌群结构内部彼此之间可能相互促进,也可能相互抑制,其不同的菌群组成结构会影响酱香型白酒的风格和酒质的优劣。黄永光等[7]通过研究茅台酒发酵过程中微生物的作用机理,发现微生物经过遗传、变异、消长和衍化等微生物群落的演替,促成了耐高温、耐高乙醇含量、耐高酸度的极端酿造微生物生态环境。张文平[8]研究发现酱香型白酒在酿造过程中很大一部分微生物来自空气。罗方雯等[9]通过对酿造环境及大曲中酵母的多样性进行分析,发现环境是酱香型白酒酿造过程中重要的微生物来源。Wang Xueshan等[10]采用高通量测序结合多相代谢产物目标分析方法,研究中国白酒发酵过程中老厂及新厂两个环境中微生物的演替和代谢变化,并应用SourceTracker软件评价环境微生物对发酵的贡献,结果表明环境微生物群是发酵菌群的重要来源,在白酒酿造过程中可以驱动微生物的演替和代谢。上述文献均表明参与酿造过程的微生物与酿造环境及其内在微生物都存在密切的关联,因此解析酿造环境中的微生物菌群结构对认识其生物学科学机制、提升酿造质量具有举足轻重的作用。目前,虽然对酱香型白酒酿造过程大曲、酒醅中微生物研究较多,但对酿造环境中的微生物,尤其是对酱香型白酒不同轮次酿造环境中真菌的系统性研究较少。因此,为进一步探究环境微生物结构对酱香型白酒酿造品质的影响,本实验以茅台镇酿造环境中真菌菌群结构为研究对象,采用高通量测序结合数理统计软件,全面解析茅台镇酱香型白酒酿造环境中的真菌群落结构组成及其量化结果,旨在对科学认识酿造环境微生物及其发酵机制、资源价值评价等提供科学依据和参考。
1 材料与方法
1.1 材料与试剂
样品取自贵州省仁怀市茅台镇观音寺区、上坪村、椿树村、岩滩村、向阳村、卢荣坝村及合马镇街道社区等酱香型白酒主酿区域的17 个代表性酿酒企业,采样时间2018年1—9月,共计7 个轮次,每轮次对酿造环境进行一次采样。环境样品采集包括:企业生产车间的晾堂、墙角地面土尘、灰尘,窗户玻璃、窗台、墙体表面的灰尘、粉尘,车间外地面、沟渠表面土质粉尘等,对各采样点均进行标记固定、定期(1 个月的富集时间)、定量采集样品。从17 个酿造企业酿造环境中共采集119 个环境样品,按照区域划分将每个酒企的样品等量混合后代表一个区域的最终混合样品,7 个轮次共计49 个环境区域混合样品,再将49 个环境区域混合样品按照轮次等量均值混匀得到每轮次最终混合样品,各企业每轮次采集混合样500 g。样品采集后立即装袋密封,24 h内运回实验室分析,采集样品均在-80 ℃密封保存、备用。
DNA Marker 宝生物工程(大连)有限公司;磷酸盐缓冲溶液(phosphate buffer saline,PBS)、引物合成生工生物工程(上海)股份有限公司;E.Z.N.A®.Soil DNA Kit 美国Omega BioTek公司;异丙醇(分析纯)、TAE(Tris acetate-EDTA)缓冲液 北京索莱宝科技有限公司;琼脂糖 南京生兴生物技术有限公司;Goldview染料 上海赛百盛有限公司;rTaqDNA聚合酶试剂盒 北京全式金生物技术有限公司。
1.2 仪器与设备
G154DW高压蒸汽灭菌锅 致徽(厦门)仪器有限公司;台式高速冷冻离心机 德国Sigma公司;GeneAmp®9700型聚合酶链式反应(polymerase chain reaction,PCR)仪 美国ABI公司;DYY-8C型电泳仪北京六一仪器厂;JS-680C凝胶成像仪 上海培清科技有限公司;MiSeq测序仪 美国Illumina公司;QuantiFluorTM-ST蓝色荧光定量系统 美国Promega公司;AxyPrep DNA凝胶回收试剂盒 美国Axygen公司。
1.3 方法
1.3.1 样品预处理及DNA提取[11-12]
分别取充分混匀的综合样各16 g于100 mL离心管中,用30 mL灭菌后的0.1 mol/L PBS悬浮,加入3~5 颗玻璃珠,旋涡振荡7 min,400 r/min离心5 min,取上清液。沉淀用PBS洗涤,旋涡振荡4 min,400 r/min离心5 min,收集上清液。将沉淀用PBS洗涤,旋涡振荡2 min,400 r/min离心5 min,收集上清液。全部上清液于12 000 r/min离心5 min,弃上清液,收集细胞沉淀。预处理结束后立即对各样品中的微生物总DNA进行提取,并置于-20 ℃备用。提取步骤参见E.Z.N.A.®Soil DNA Kit的操作说明。
1.3.2 PCR扩增及Illumina MiSeq测序
应用引物ITS1F(5’-CTTGGTCATTTAGAGGAAGTAA-3’)和2043R(5’-GCTGCGTTCTTCATC GATGC-3’)扩增高变区。PCR体系及反应条件见黄蕴利等[13]的方法;每个样本做3 次重复。使用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA凝胶回收试剂盒进行纯化,Tris-HCl洗脱,2%琼脂糖电泳检测。利用QuantiFluor™-ST蓝色荧光定量系统进行检测定量。根据Illumina MiSeq平台标准操作规程将纯化后的扩增片段构建PE 2×300的文库。
构建文库步骤:1)连接“Y”字形接头;2)使用磁珠筛选去除接头自连片段;3)利用PCR扩增进行文库模板的富集;4)氢氧化钠变性,产生单链DNA片段。
利用Illumina公司的MiSeq PE300平台进行测序(上海美吉生物医药科技有限公司)。
1.4 数据及图像处理
原始测序序列使用Trimmomatic软件质控,使用FLASH软件进行拼接:
1)设置50 bp的窗口,如果窗口内的平均质量值低于20,从窗口开始截去后端碱基,去除质控后长度低于50 bp的序列。
2)barcode需精确匹配,引物允许2 个碱基的错配,去除模糊碱基。
3)根据重叠碱基overlap将两端序列进行拼接,overlap需大于10 bp。去除无法拼接的序列。使用UPARSE软件(version 7.1 http://drive5.com/uparse/),根据97%的相似度对序列进行可操作分类单元(operational taxonomic unit,OTU)聚类;使用UCHIME软件剔除嵌合体。利用RDP classifier(http://rdp.cme.msu.edu/)对每条序列进行物种分类注释,真菌与数据库unite7.0/its_fungi进行对比,设置比对阈值为70%。
4)采用Microsoft Office Excel 2016进行数据计算和分析,AI作图工具、R语言绘制气泡图和Upset plot图,Cytoscape软件绘制物种相关性网络图。
2 结果与分析
2.1 真菌菌群多样性分析
常用Shannon指数、ACE指数、Chao指数和覆盖率描述微生物群落物种α多样性,可对群落物种组成的丰富度及均匀度进行综合性评价。其中,Shannon指数表示群落多样性;Chao指数和ACE指数表示群落物种丰富度。表1结果表明,各轮次样品的覆盖率均在99.90%以上,各样品文库的覆盖率足够大,说明测序结果能体现环境样品真菌菌群多样性的真实情况。不同轮次环境样品在97%水平下共得到294 个OTU,3轮次的OTU数最高(231),1轮次和7轮次的OTU数较中间轮次低。
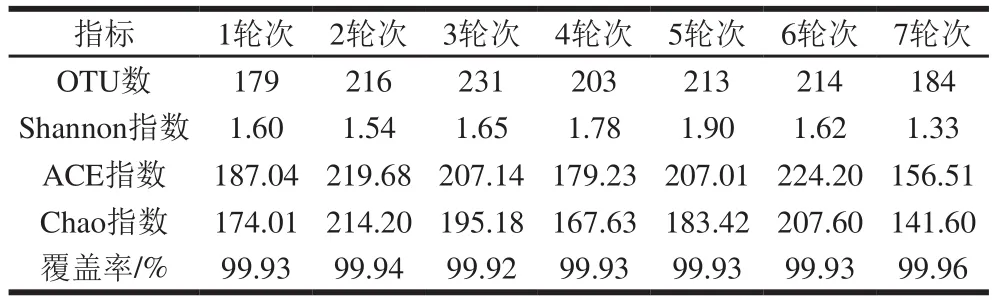
表1 不同轮次环境样品真菌的α多样性指数Table 1 α-Diversity of fungi in environment samples from different rounds
3、4、5 轮次样品的Shannon指数高于1、2、6、7轮次,表明3、4、5轮次酿造期间酿造环境中真菌多样性均高于其他轮次。生产实践表明,3、4、5轮次也是酱香型白酒生产过程中的“大回酒”轮次,其为产量最高、质量最优的3 个轮次,说明酿造产量、质量与微生物的多样性存在关联。而1~7轮次的真菌ACE指数和Chao指数之间存在部分无规律现象,说明不同酿造轮次环境条件的差异导致真菌物种丰富度出现变化。进一步表明当温度、天气等环境因素发生变化时,真菌区系结构可能会相应发生一些变化。环境微生物结构的稳定性会直接影响堆积发酵和大曲制作过程从环境中富集的微生物结构及其质量,进而影响堆积发酵和大曲的微生物结构优化,这为酿造生产提出更严格的生产调控要求。
2.2 酿造环境中真菌菌群结构特征
为了更加深入揭示茅台镇酱香型白酒各轮次酿造环境样品在各分类学水平上的组成情况,对不同酿造轮次环境样品中真菌菌群结构的门水平、属水平特征进行分析。从1~7轮次环境真菌样品中共检测到4 个真菌门,根据各菌门的相对丰度,子囊菌门(Ascomycota)和担子菌门(Basidiomycota)是茅台镇酱香型白酒各轮次酿造环境的优势真菌门。1~7轮次酿造过程中,Ascomycota的相对丰度呈逐渐减小趋势变化,Basidiomycota的相对丰度则逐渐增大。根据相关研究报道,Ascomycota不仅是酱香型白酒中优势真菌种群[14],同样也是浓香[15]、清香型白酒[16]及食醋[17]等多种发酵食品生产中的主要真菌菌群。
同时,从茅台镇1~7 个酿造轮次的环境样品中共检出212 个真菌属。根据平均相对丰度将样本中菌属分为优势菌属(平均相对丰度≥1%)和次要菌属(平均相对丰度<1%),且将次要菌属归类于其他(others)。根据测序结果,平均相对丰度≥1%的菌属有14 个,分别为节担菌属(Wallemia)22.87%、复膜孢酵母属(Saccharomycopsis)20.55%、威克汉姆酵母属(Wickerhamomyces)11.71%、曲霉属(Aspergillus)10.9%、德巴利氏酵母属(Debaryomyces)6.22%、热子囊菌属(Thermoascus)4.84%、隐球酵母属(Cryptococcus)4.47%、unclassified_f__Saccharomycetaceae 2.72%、红酵母属(Rhodotorula)1.93%、枝孢属(Cladosporium)1.81%、Rasamsonia1.58%、丝衣霉属(Byssochlamys)1.46%、unclassified_o__Eurotiales 1.24%和毛孢子菌属(Trichosporon)1.10%。由图1可知,茅台镇酱香型白酒各轮次酿造环境真菌以Wallemia和Saccharomycopsis为绝对优势菌属。Liu Maoke等[18]利用变性梯度凝胶电泳和Illumina MiSeq测序方法对浓香型白酒发酵窖泥中真菌群落进行分析,同样得出Wallemia是浓香型白酒发酵过程中的优势菌属。Saccharomycopsis是酒药香气的主要产生菌,该菌属在黄酒酿造和以大米为原料的酿造酒生产过程对发酵具有重要作用[19],同时也在浓香型白酒发酵酒醅中检出[20]。Wickerhamomyces是白酒发酵过程高产乙醇生产者,从感官评价看,其参与生产的白酒风味较和谐、花香值较高[21-22]。罗方雯等[23]运用高通量测序技术解析茅台镇酿造环境及大曲中的酵母菌群多样性结构,发现Saccharomycopsis和Wickerhamomyces是酿造环境的优势酵母属,环境是酱香型白酒酿造过程生产大曲中的酵母属的主要来源。朱治宇等[24]通过对不同轮次酿造环境和大曲中可培养霉菌多样性结构分析,得出Aspergillus等霉菌属是酱香型白酒酿造环境中的绝对优势霉菌。由此可见,酿造环境中的微生物通过大曲富集及堆积发酵进而迁徙进入到酿造过程,为酒醅发酵提供了微生物来源。Aspergillus是酱香型白酒发酵过程中的优势真菌属,在白酒酿造过程主要作用于发酵前期,是酿造霉菌中种类最多的真菌属[25]。由于酱香型白酒酿造环境酸度较高,曲霉分泌的酸性水解酶能分解原料中的纤维素与淀粉质大分子物质,催化促成芳香脂类物质的产生,在酱香型白酒中具有提升、改善酒体风味的作用[26-27]。王雪山[28]对清香型白酒发酵环境中微生物种群结构进行研究发现清香型白酒酿造环境中真菌种群主要有Pichia、Saccharomycopsis、Saccharomyces、Wickerhamomyces、Aspergillus。结合上述等其他研究者的结论和本研究结论可知,绝对优势菌属中Saccharomycopsis不仅是酱香型白酒酿造环境中的优势微生物,也是其他香型白酒酿造环境中的优势微生物,但酱香型白酒在微生物结构组成上又有别于其他香型,这是因为酱香型白酒酿造过程中优势微生物的种类和丰度远高于其他香型环境微生物。
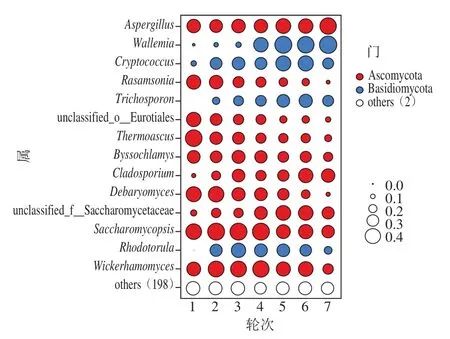
图1 酿造环境中真菌群落结构分布图(前14 个)Fig.1 Distribution of fungal community structure in brewing environment (top 14 most abundant genera)
为进一步解析各轮次酿造环境中的微生物菌群结构特征,对属水平上主要真菌的分布差异进行分析,将上述优势菌属在各轮次中相对丰度最高的菌属作为该轮次的标志性真菌属。1轮次的标志性菌属是Thermoascus(29.64%),但在2轮次急剧下降至1.78%,后又缓慢下降至7轮次时为0.05%。Thermoascus在前3 个轮次的环境样品中的相对丰度较高,随着生产轮次推进其相对丰度呈逐渐降低趋势,其原因可能是前3 个轮次酿造环境适宜Thermoascus的生长,而从4轮次开始,酿造环境温度等理化性质发生了一定的改变,使得该菌的生长受限从而导致丰度呈持续下降趋势。Thermoascus能产木聚糖酶、超氧化物歧化酶、角质酶等热稳定的水解酶类,这些酶类在堆积糖化发酵以及对酱香风味的形成起重要的作用[29-30]。Saccharomycopsis是3、4轮次的标志性菌属,该菌属在1轮次的相对丰度为16.75%,2轮次时上升至40.27%,3、4轮次期间Saccharomycopsis相对丰度变化不大(40.27%~41.53%),5轮次时又急剧下降至4.95%,到7轮次时下降至1.25%。5~7轮次为茅台镇一年中环境温度最高的3 个轮次,因此,Saccharomycopsis的生长可能对酿造环境温度有一定的要求,并且有资料表明该菌属对白酒香气物质的形成具有促进作用[31]。5、6、7轮次酿造环境的标志性菌属是Wallemia,该菌属在1、2、3轮次酿造环境中相对丰度极低(小于0.02%),4轮次时大幅上升至14.05%,5轮次时又大幅上升至43.07%,后呈现小幅波动至7轮次时的54.33%。
上述结果表明,不同轮次环境样本中优势菌属的组成结构相似度较高,但其各轮次的标志性真菌属存在差异,说明酿造环境微生物中的标志性真菌属随酿造时空径向的变化而变化,这与具体微生物、环境条件之间的相互作用有关,具体机制正在进一步研究。茅台镇传统酱香型白酒生产过程的发酵温度较高,同时茅台镇酿造环境的季节性温度也高,自然环境中微生物受到的影响也较大。因此,不同轮次之间酿造环境微生物存在的差异仍然会导致环境中微生物种群结构及演替的变化,还可能导致大曲贮存过程、酒醅堆积发酵过程从酿造环境富集微生物的差异。
2.3 酿造环境中真菌菌群结构差异性
为进一步分析不同轮次环境样品中真菌菌群的共性和差异性特征,利用Upset plot解析各酿造轮次环境样本中真菌菌群结构在属水平上所共有和独有的属水平数目,可直观表征环境样本中真菌属水平共有的重叠情况,结果如图2所示。

图2 酿造环境中真菌Upset plot分析(属水平)Fig.2 Upset plot analysis of fungi in brewing environment at genus level
由图2左侧条形图可知,各轮次真菌种类差异性不大,其中6轮次真菌种类最多,7轮次真菌种类最少。右侧Upset plot表明,7 个轮次共有相同真菌属56 个,共有属的相对丰度和在1~7轮次的占比分别为99.02%、99.34%、96.75%、99.80%、99.64%、98.96%和99.84%。从共有属相对丰度和占比结果表明,7 个轮次酿造环境中的主要微生物具有较好的相对稳定性特征,这有利于酿造环境微生物资源的保护与利用。各轮次特征性真菌属(只有该轮次才出现的真菌属)种类相对比较丰富,其中6轮次检出的特征性真菌属最多,为20 个,占该轮次总真菌属数量的13.60%;5轮次检测出的特征性真菌属最少,为3 个,占该轮次总真菌属数量的2.59%;说明不同微生物在各轮次的占比直接调控不同轮次的发酵特征和酒体风格质量。在整个生产年度中,1轮次起始时发现116 个真菌属到7轮次时剩余66 个真菌属(相对丰度和占99.02%),消亡率为0.98%。有32 种真菌在1轮次未发现或相对丰度低于检出限,但在7轮次时检出,其相对丰度和占比0.16%,有27 种真菌仅出现在2~6轮次,其相对丰度和占比分别为0.03%、0.03%、0.03%、0.01%和0.04%,只有49 种真菌单独出现在1~7轮次中,剩余的163 种真菌属具有轮次间的传承性。
综上所述,茅台镇酱香型白酒酿造环境中各轮次真菌之间存在一定的共性特征,且共有真菌种类的稳定性较好,数量和种类上都具有传承性。同时,特征性真菌属种类较丰富,说明各个轮次酿造环境真菌存在的差异性也可为酱香型白酒生产提供更加丰富的菌种资源。
2.4 核心真菌相关性网络分析
茅台镇酱香型白酒酿造过程环境中真菌种类繁多,相互关系复杂。相关研究表明[32-34],平均相对丰度大于1%且至少出现在一个样品以上的菌属被定义为核心菌属。核心微生物群是白酒生产过程中最重要的微生物属,占主导地位[35]。本研究发现,茅台镇7 个酿造轮次酿造环境样品中的核心菌属有12 个,分别为Saccharomycopsis、Thermoascus、Wallemia、Wickerhamomyces、Aspergillus、Debaryomyces、Cryptococcus、unclassified_f__Saccharomycetaceae、Rhodotorula、Cladosporium、Rasamsonia和unclassified_o__Eurotiales。为深入挖掘特定环境中复杂微生物群落物种之间相关性,系统认识核心真菌菌群之间的相互关系及其调控机制,通过相关性网络分析探讨相关性较强真菌属间的相互作用,将12 种核心真菌属进行物种相关性网络分析,结果如图3所示。

图3 环境样品中的核心真菌群落相关性网络图(属水平)Fig.3 Correlation network diagrams of core fungal community in brewing environment at genus level
如图3所示,得到22 个节点和42 条边,总体上真菌属之间的相互关系错综复杂,连接线纵横密集分布,真菌的正相关连接边比负相关多。与Ascomycota最强节点为Debaryomyces,与Basidiomycota最强节点为Rhodotorula。高相关性节点是指与一定数量的其他微生物均有相关性的一类微生物,也称为Hub节点[36]。从Hubs种类及数量在一定程度上可反映特定环境中微生物菌群结构的稳定性。从图3a发现8 个Hubs(指至少与其他4 个属的微生物存在正相关节点),Cladosporium是Ascomycota下的枝孢菌属,与Aspergillus、Debaryomyces、Saccharomycopsis、Rhodotorula、unclassified_f__Saccharomycetaceae和Wallemia显著正相关(P<0.05)。unclassified_o__Eurotiales与Aspergillus、Saccharomycopsis、Debaryomyces、Thermoascus和Rasamsonia显著正相关(P<0.05)。Basidiomycota下的Rhodotorula与Aspergillus、Debaryomyces、Saccharomycopsis、Cladosporium和unclassified_f__Saccharomycetaceae显著正相关(P<0.05)。Saccharomycopsis与unclassified_o__Eurotiales、Rasamsonia、Thermoascus和Debaryomyces显著正相关(P<0.05)。Debaryomyces与Aspergillus、Thermoascus和Rasamsonia显著正相关(P<0.05)。Thermoascus与Aspergillus和Rhodotorula显著正相关(P<0.05)。Cryptococcus、Wickerhamomyces与Debaryomyces显著正相关(P<0.05)。Wallemia、unclassified_f__Saccharomycetaceae与Aspergillus和Cladosporium显著正相关(P<0.05)。
从图3b可发现,unclassified_f__Saccharomycetaceae、Thermoascus和Rasamsonia3 个负相关Hubs(指至少与其他4 个属的微生物存在负相关节点)。unclassified_f__Saccharomycetaceae与Debaryomyces、unclassified_o__Eurotiales、Thermoascus、Rasamsonia和Saccharomycopsis显著负相关(P<0.05)。Thermoascus与Wallemia、Cladosporium和Rhodotorula显著负相关(P<0.05)。Rasamsonia与Rhodotorula、Cladosporium、unclassified_f__Saccharomycetaceae和Aspergillus显著负相关(P<0.05)。Cladosporium与unclassified_o__Eurotiales显著负相关(P<0.05)。unclassified_o__Eurotiales与Rhodotorula显著负相关(P<0.05)。Aspergillus与Saccharomycopsis显著负相关(P<0.05)。Debaryomyces与Wallemia显著负相关(P<0.05)。
综上所述,通过正、负相关关系,真菌菌群之间形成相互影响的网络结构。根据相关性网络分析结果可知,在核心真菌菌属之间直接或间接影响彼此生长和代谢,进而对酿造微生物体系平衡的维持或者破坏产生一定的影响。这些相互生物学关系构成了酿造过程的基本生物学调控机制,也是酿造过程发酵动力、风味动力形成和调控机制的基本组成,复杂的共生关系和拮抗关系形成了稳定的酿造环境微生物群落结构,这也是酿造过程微生物菌群稳定性和演替的内在调控动力和机制。从核心菌属之间的相关性结果表明,环境中稳定的微生物菌群结构为酿造过程提供了丰富的微生物来源以及稳定的酿造产质量。正是因为核心菌群之间形成的共生、拮抗等生物学关系,才能维持整个酿造体系的正常、稳态发展,推进酿造进程沿袭乙醇发酵和风味富集方向发展。
3 结 论
通过高通量测序方法,对茅台镇2017—2018酿造年度1~7轮次环境样品进行了真菌菌群结构多样性及特征性分析和研究。结果表明,从酿造环境样品中共检出4 个真菌门,212 个真菌属。根据各菌门、属的相对丰度,Ascomycota和Basidiomycota是茅台镇酱香型白酒各轮次酿造环境样品的优势菌门,优势菌属主要有Wickerhamomyces、Aspergillus等14 个,其中Wallemia和Saccharomycopsis为绝对优势菌属。通过对真菌属水平分布差异分析,发现不同轮次酿造环境样品中真菌组成相似度较高,但其各轮次标志性真菌属存在差异。结合Upset plot对各轮次间酿造环境样品中共有真菌及特征性真菌结构差异性进行分析,7 个轮次共有相同真菌属56 个,且均在各轮次占主导地位,特征性真菌属在各轮次中相对丰度和占比较小但种类丰富。对12 个核心菌属进行相关性网络分析发现8 个正相关Hubs以及3 个负相关Hubs,Ascomycota最强节点为Debaryomyces,Basidiomycota最强节点为Rhodotorula,正相关性比负相关性强,复杂的共生关系和拮抗关系是酿造过程微生物菌群稳定性和演替的内在调控动力和机制,环境中稳定的微生物菌群结构为酿造过程提供了丰富的微生物来源,保障了各轮次的正常生产酿造。通过研究茅台镇酱香型白酒酿造环境中真菌多样性及特征规律,进一步揭示了茅台镇酱香型白酒酿造环境微生物与酿造过程微生物之间的相关性机制。

