连花清瘟胶囊微生物限度检查方法的建立
张秀花,刘艳平,任仲丽,曲国晶
(菏泽市食品药品检验检测研究院,山东 菏泽 274000)
连花清瘟胶囊收载于《中国药典》 一部[1],由连翘、金银花、板蓝根等13 味中药加工而成,方中连翘、金银花等具有抗菌作用[2⁃3],治疗细菌性肺炎和急性上呼吸道感染取得了良好效果[4⁃6],2020 年4 月它被批准用于治疗新冠肺炎。目前,全球疫情蔓延,严重威胁人类健康,故连花清瘟胶囊的质量倍受关注。
为了保证临床用药安全,各国药典对口服制剂的微生物污染状况都有明确质控指标[7⁃11]。在原辅料、生产工艺、设施环境等可控的条件下,微生物污染菌的检出主要体现在实验室检测环节上,开展方法学适用性试验是做好微生物限度检查的重点和关键环节。本实验通过各试验菌回收比及控制菌检查方法试验,建立了连花清瘟胶囊微生物限度检查方法,以期为该制剂质量控制提供依据。
1 材料
1.1 药物 连花清瘟胶囊购自石家庄以岭药业股份有限公司,批号A1908063、A2001273、A2001105。
1.2 培养基、稀释液 胰酪大豆胨琼脂培养基TSA(批号190518)、沙氏葡萄糖琼脂培养基SDA(批号190625)、胰酪大豆胨液体培养基TSB(批号190712)、pH7.0 无菌氯化钠⁃蛋白胨缓冲液(批号190206)均由北京陆桥技术股份有限公司提供。
1.3 菌种 金黄色葡萄球菌[CMCC(B)26003]、枯草芽孢杆菌[CMCC(B)63501]、铜绿假单胞菌 [CMCC(B)10104]、白色念珠菌[CMCC(F)98001]、黑曲霉[CMCC(F)98003]、大肠埃希菌[CMCC(B)44102]均由广东环凯微生物科技有限公司提供,经专家鉴定合格,而且均为第3 代。
1.4 仪器 电子天平(HZT⁃A600,福州华志科学仪器有限公司);高压蒸汽灭菌器(mlS⁃3781L⁃PC,三洋工业株式会社);生物安全柜(ClassⅡBSC,新加坡ESCD 公司)、细菌浊度分析仪(WGZ⁃2XJ,上海盺瑞仪器仪表有限公司);电热恒温培养箱(DHP⁃420,北京市永光明医疗仪器厂)。
2 方法
2.1 菌液制备 按文献[12] 报道,将“1.3”项下菌种制成浓度不大于10 000 cfu/mL 的菌悬液,即得。
2.2 供试液制备 按文献[12⁃13] 报道,将“1.1”项下样品依次按1 ∶10、1 ∶20、1 ∶50 比例稀释,即得。
2.3 计数方法适用性试验
2.3.1 常规法 取“2.1”项下菌液0.1 mL,加到“2.2”项下1 ∶10 供试液9.9 mL 中,混匀,作为试验组;取稀释液0.1 mL,加到“2.2”项下1 ∶10 供试液9.9 mL 中,混匀,作为供试品组;取“2.1”项下菌液0.1 mL,加到稀释液9.9 mL中,混匀,作为菌液对照组。取上述试液各2 mL注皿(1 mL/皿),加入15~20 mL 温度不超过45 ℃熔化的TSA 或SDA 培养基,混匀,凝固,倒置培养,计算平均菌落数。
2.3.2 增加稀释液法 取“2.1”项下菌液0.1 mL,分别加到“2.2”项下1 ∶20、1 ∶50 供试液9.9 mL 中,混匀,作为试验组,其他同“2.3.1”项,取2 mL 注皿(1 mL/皿),加入15~20 mL 温度不超过45 ℃熔化的TSA 或SDA 培养基,混匀,凝固,倒置培养,计算平均菌落数。
2.3.3 增加培养基体积法 取“2.1”项下菌液0.1 mL,加到“2.2”项下1 ∶10 供试液9.9 mL 中,混匀,作为试验组,其他同“2.3.1”项,取1 mL 注皿(0.5、0.2 mL/皿),加入15~20 mL 温度不超过45 ℃熔化的TSA 或SDA 培养基,混匀,凝固,倒置培养,计算平均菌落数。
2.3.4 增加稀释液⁃增加培养基体积联合法 取“2.1”项下菌液0.1 mL,加到“2.2”项下1 ∶20、1 ∶50 供试液9.9 mL 中,混匀,作为试验组,其他同“2.3.1”项,分别取1、2 mL 注皿(0.2、0.4、0.5 mL/皿),加入15~20 mL温度不超过45 ℃熔化的TSA 或SDA 培养基,混匀,凝固,倒置培养,计算平均菌落数。
2.4 回收比计算 公式为试验组回收比=(试验组平均菌落数-供试品对照组平均菌落数)/菌液对照组平均菌落数、稀释剂对照组回收比=稀释剂对照组平均菌落数/菌液对照组平均菌落数。
3 结果
3.1 预试验 在文献[14⁃21] 基础上,首先采用常规法进行预实验,测定5 种菌株回收比,按“2.3.1”项下方法操作,结果见表1。由此可知,常规法3 批样品中枯草芽孢杆菌、金黄色葡萄球菌回收比均小于0.5,表明对这2 种菌株均有较强抑制作用,可作为需氧菌总数计数方法测定的敏感菌株;霉菌酵母菌计数时,各试验菌回收比均在0.5~2.0 范围内,符合《中国药典》 要求,可采用常规法进行检查。

表1 常规法预试验结果(n=3)
3.2 需氧菌计数方法确定 根据“2.3.1”项下结果,选用枯草芽孢杆菌、金黄色葡萄球菌作为敏感菌株,按“2.3.2”至“2.3.4”项下方法操作,结果见表2~3。由此可知,稀释倍数不同,敏感菌株回收比有显著差异;增加稀释液法1 ∶20(1 mL/皿)、增加培养基体积法1 ∶10(0.5 mL/皿)供试液中样品浓度相同,稀释倍数为20 倍,枯草芽孢杆菌、金黄色葡萄球菌回收比均小于0.5,表明该浓度下供试液仍具有一定抑菌性;增加稀释液法1 ∶50(1 mL/皿)、增加培养基体积法1 ∶10(0.2 mL/皿)、增加稀释液⁃增加培养基体积联合法1 ∶20(0.4 mL/皿)供试液中样品浓度相同,稀释倍数为50 倍,枯草芽孢杆菌、金黄色葡萄球菌回收比均在0.5~2.0 范围内,表明该浓度下供试液抑菌作用已消除;增加稀释液⁃增加培养基体积联合法1 ∶20(0.2 mL/皿)、1 ∶50(0.5 mL/皿)供试液中样品浓度相同,稀释倍数为100 倍,枯草芽孢杆菌、金黄色葡萄球菌回收比均在0.5~2.0 范围内,表明该浓度下供试液抑菌作用已消除,与稀释倍数为50 倍时各试验菌回收比基本一致。最终,选择稀释倍数50 倍时增加稀释液法1 ∶50(1 mL/皿)、增加培养基体积法1 ∶10(0.2 mL/皿)、增加稀释液⁃增加培养基体积联合法1 ∶20(0.4 mL/皿)进行需氧菌计数方法试验。

表2 枯草芽孢杆菌回收比试验结果(n=3)

表3 金黄色葡萄球菌回收比试验结果(n=3)
3.3 正式试验 根据“3.1”和“3.2”项下结果,需氧菌计数按“2.3.2”至“2.3.4”项下方法操作,霉菌酵母菌计数按“2.3.1”项下方法操作,结果见表4~5,可知3批样品5 种菌株回收比均在0.5~2.0 范围内,符合《中国药典》 要求[12]。最终确定,需氧菌总数测定可采用增加稀释液法,1 ∶50 供试液注皿(1 mL/皿),也可采用增加培养基体积法,1 ∶10 供试液注皿(0.2 mL/皿);霉菌酵母菌总数测定可采用常规法,1 ∶10供试液注皿(1 mL/皿),此时各试验菌回收比均符合 《中国药典》 要求,方法可行。
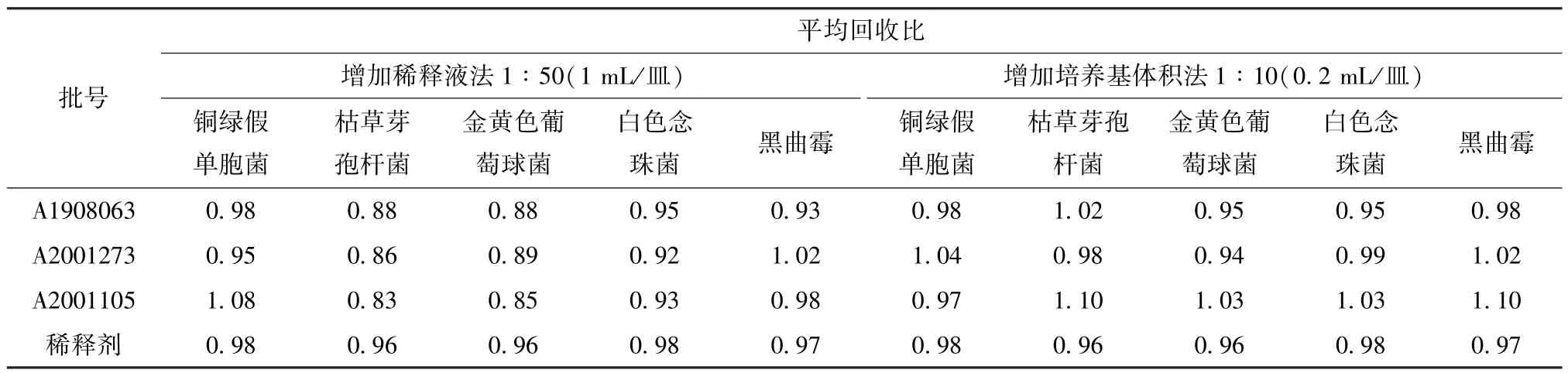
表4 连花清瘟胶囊方法适用性试验结果Ⅰ(n=3)
3.4 控制菌检查
3.4.1 常规法 取“2.2”项下1 ∶10 供试液10 mL,加到100 mL TSB 中,混匀,作为供试品组;取“2.2”项下1 ∶10 供试液10 mL、“2.1”项下大肠埃希菌0.1 mL,加到100 mL TSB 中,混匀,作为试验组;取稀释液10 mL,加到100 mL TSB 中,作为阴性组,按照文献[12] 报道的方法检查。结果见表6。

表5 连花清瘟胶囊方法适用性试验结果Ⅱ(n=3)
3.4.2 稀释法 取“2.2”项下1 ∶20 供试液10 mL,加到100 mL TSB 中,混匀,作为供试品组;取“2.2”项下1 ∶20 供试液10 mL、“2.1”项下大肠埃希菌0.1 mL,加到100 mL TSB 中,混匀,作为试验组;取稀释液10 mL,加到100 mL TSB 中,混匀,作为阴性组,按照文献[12]报道的方法检查。取“2.2”项下1 ∶50 供试液依法操作,结果见表6。
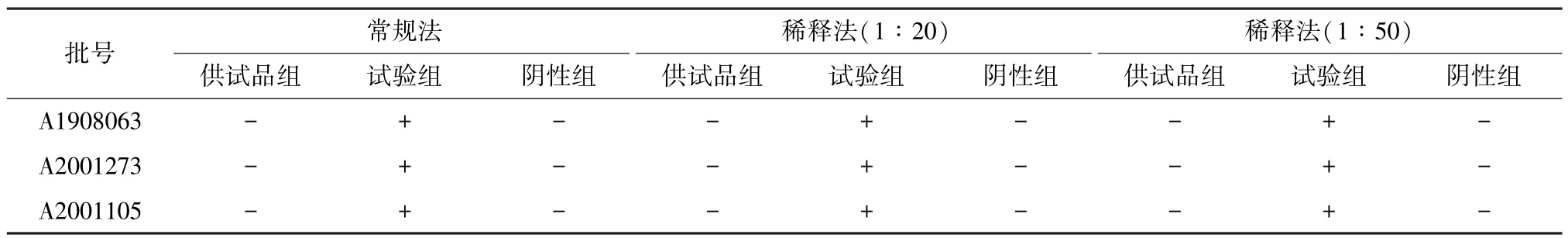
表6 控制菌方法适用性试验结果
3.4.3 结果分析 常规法、稀释法均检出阳性菌,而阴性组均无菌落生长,表明可用常规法进行控制菌的检查。
4 讨论
微生物限度检查是评价药品安全性的重要手段,是对药品中已有微生物污染菌的再现,也是客观衡量药品质量的重要指标,其操作过程受人、机、料、法、环等诸多因素影响,工作量大、重复劳动多[19⁃20,22⁃23]。因此,对同一品种建立合理有效的适用性试验尤其重要。
研究表明,连花清瘟胶囊具有抑菌活性,故进行微生物限度检查时必须首先消除样品本身上述作用,这样才能保证被检微生物正常生长繁殖[2]。表1 显示,连花清瘟胶囊对枯草芽孢杆菌、金黄色葡萄球菌有较强的抑制作用,故分别采用增加稀释液法、增加培养基体积法及二者联合法进行方法适用性试验。由表2~5 可以看出,稀释倍数不同,敏感菌株回收比有显著差异;当供试液中样品浓度相同时,3 种方法下样品抑菌活性大致相同;当稀释倍数为20 倍时,枯草芽孢杆菌、金黄色葡萄球菌的回收比均小于0.5,仍具有一定的抑菌性;当样品的稀释倍数为50 倍时,两者回收比均在0.5~2.0 范围内,表明抑菌性已去除。在控制菌检查中,用2 种方法、3 个浓度进行适用性试验,结果均检出阳性菌,表明样品对控制菌无抑制作用,可用常规法进行检查。
研究表明,3 种方法均适用于连花清瘟胶囊微生物限度检查,但对抗菌活性的去除效果略有不同。表2~5 显示,当供试液稀释倍数相同时,去除效果依次为增加培养基体积法>二者联合法>增加稀释液法,可能是由于增加培养基体积法注皿时每皿中样品量最低,从而抗菌活性去除效果最好,各试验菌回收比最高,而且该方法操作简单,重复性好,结果准确可靠[24⁃27],与生产企业前期研究结果[2,28]一致,适用于连花清瘟胶囊微生物限度检查。

