原花青素对宫颈癌HeLa 细胞上皮间质转化的抑制作用
张 蕾,黄华明,周 杰,聂 超*
(1.江苏卫生健康职业学院,江苏 南京211800; 2.无锡市锡山人民医院,江苏 无锡 214015)
宫颈癌是一种严重危害女性健康的常见恶性肿瘤,每年世界新增患者达几十万人。尽管宫颈癌疫苗的使用和筛查手段不断更新,患病率已经降低[1],但化疗对术前缩小病灶增加手术机会、术后防止复发转移及晚期转移性宫颈癌仍起着不可替代的作用[2]。由于化疗药物缺乏理想疗效、不良反应较强等问题[3],中药替代或与现有药物联合使用正成为当前新的趋势。
原花青素(proanthocyanidins,PC)是一种黄酮类化合物,广泛存在于各种植物的核、皮、种籽等部位,在葡萄籽中含量最高,也是多种中药的主要成分之一[4],有着抗炎、降血压、抗白血病、抗动脉粥样硬化、抗氧化等功效[5⁃6],同时其来源广泛,不良反应低,受到了人们广泛关注。本实验将原花青素作用于宫颈癌HeLa 细胞,观察药物对细胞侵袭和迁移的影响,并讨论药物抑制上皮间质转化(epithelial mesenchymal transition,EMT)产生作用的机制,以期为该成分开发利用提供参考。
1 材料
1.1 细胞株 人宫颈癌HeLa 细胞购于江苏凯基生物技术股份有限公司(KG042),置于完全培养基(90%DMEM +10% CS)中,在37 ℃、5% CO2饱和湿度的培养箱中培养。
1.2 试剂与药物 原花青素(南京泽朗生物科技有限公 司,ZL20170515012,纯度> 98%)。SB431542(美国Sigma 公司,616464);TRIzol(美国Invitrogen 公司,15596026);氯仿(865⁃49⁃6)、异丙醇(67⁃63⁃0)(上海贤鼎生物科技有限公司);MTT(北京索莱宝科技有限公司,IM0280);Transwell 小室(美国Chemicon 公司,ECM550);PBS(含EDTA)(KGY0012)、全蛋白抽提试剂盒(KGP250)、5×SDS⁃PAGE 蛋白上样缓冲液(KGP101)、SDS⁃PAGE 凝胶配制试剂盒(KGP113)、Western⁃blot一抗TGFβ1(KGYT4632⁃6)、E⁃cadherin(KGYT1453⁃6)、Smad2(KG21323⁃2)、Smad3(KG21325⁃2)、pSmad2(KG11322)、pSmad3(KG11325⁃2)、内参一抗GAPDH(KGAA002-1)、二抗(KGP1201)、ECL检测试剂盒(KGP1121)(江苏凯基生物技术股份有限公司);Smad7(武汉三鹰生物技术有限公司,25840-1⁃AP)。
2 方法
2.1 MTT 法检测细胞增殖 将细胞配制成浓度为5×104/mL 的细胞悬液,96 孔细胞培养板中加入100 μL 细胞悬液,于37 ℃、5% CO2培养箱中培养24 h,完全培养基稀释药物至所需质量浓度(100、50、25、12.5、6.25、3.125 mg/L),每孔加入100 μL 相应含药培养基,同时设立阴性对照组、阳性对照组,将96 孔细胞培养板置于37 ℃、5% CO2培养箱中培养24 h,进行MTT 染色,在490 nm 波长下测定光密度(OD)值,计算抑制率。
2.2 划痕法检测细胞迁移 将对数生长期的细胞配制成浓度为5×104/mL 的细胞悬液,接种到6 孔板中,加入相应的含药无血清培养基,同时设立阴性对照组。次日,待细胞集合度达60% 左右后用无菌枪头在6 孔板中均匀划线,PBS 洗去漂浮细胞,换新鲜培养液,置于细胞培养箱中继续培养,于12、24 h 取出细胞,拍照(放大倍数100×),测量细胞迁移距离。
2.3 Transwell 检测细胞侵袭 将对数生长期的细胞配制成浓度为5×104/mL 的细胞悬液,接种到6孔板中。次日,待细胞贴壁后根据组别设置(100、50、25 mg/L)加入相应含药培养基,同时设立阴性对照组,将Matrigel 基质胶在4 ℃下过夜融化,不完全培养基稀释1 倍,Transwell 上室加入30 μL 稀释的Matrigel,37 ℃下孵育120 min,使Matrigel 聚合成胶,不完全培养基调整细胞浓度至5×105/mL,取100 μL 细胞悬液加入Transwell 小室,下室加入500 μL 含20% FBS 的培养基,将24孔细胞培养板置于37 ℃、5% CO2培养箱中培养24 h,棉签擦去基质胶和上室内细胞,移去Transwells,倒置,风干,在24 孔板中加入500 μL 0.1%结晶紫,将小室置于其中,使膜浸没在染料中,37 ℃下反应30 min 后取出,PBS 清洗,直径上取3 个视野,照相(×200),计数。
2.4 免疫荧光观察蛋白变化 取对数生长期的细胞,调整细胞浓度至5×104/mL,根据组别设置(100、50、25 mg/L)加入相应含药物的培养基,培养24 h 后将2 种细胞自然晾干,4%多聚甲醛固定液浸泡30 min,PBS 浸洗3 次,依次滴加3%H2O2⁃甲醇溶液2 滴、即用型山羊血清75 μL,室温下孵育20 min。在37 ℃下滴加一抗(1 ∶100 稀释)75 μL,孵育2 h,PBS 浸洗3 次;FITC(1 ∶200 稀释)二抗75 μL,避光孵育1 h,PBS 浸洗3次,滴加DAPI 染液后用防萃灭封片胶封片,荧光显微镜下观察细胞3 个高表达区域并拍照保存。使用Image⁃Pro Plus 6.0 软件计算视野面积下光密度(IOD),求得平均光密度,公式为平均光密度=IOD/视野面积。
2.5 Western blot 检测蛋白表达 将对数生长期的细胞消化接种到6 孔板中,次日待细胞贴壁后,根据组别设置(100、50、25 mg/L)加入相应含药培养基,同时设立阴性对照组,各组加入200 μL冰预冷裂解缓冲液,混匀后冰浴30 min,常规涡旋后,14 000 r/min、4 ℃离心15 min,取上清,BCA法测定蛋白浓度,10% SDS⁃PAGE 凝胶电泳分离,转移到聚氟乙烯(PVDF)膜上,5% 脱脂牛奶过夜封闭,加入一抗(1 ∶200),过夜孵育于4 ℃封闭袋中,二抗(1 ∶4 000)孵育(辣根过氧化物酶标记的羊抗鼠抗体)1 h,其间每一步都用TBST洗膜3 次,每次10 min。凝胶成像系统成像,Gel⁃Pro32 软件进行灰度分析。
2.6 荧光定量PCR 检测基因表达 将对数生长期宫颈癌HeLa 细胞提取总RNA,测定纯度后反转录为cDNA。用荧光染色法和荧光定量PCR 仪进行实时定量PCR,引物由江苏凯基生物科技有限公司合成,序列分别为GAPDH primer(90 bp)[5′⁃AGATCATCAGCAATGCCTCCT⁃3′、5′⁃TGAGTCCTTC CACGATACCAA⁃3′]、E⁃cadherin primer(108 bp)[5′⁃CCAAGCAGCAGTACATTCTACA⁃3′、5′⁃CATT CACATCCAGCACATCCA⁃3′],扩增条件为95 ℃预变性5 min,95 ℃变性15 s,60 ℃退火/延伸20 s,72 ℃变性40 s,共40 个循环,产物特异性用溶解曲线监 测。采 用 Rotor⁃Gene Real⁃Time Analysis Software 6.1 分析软件及ΔΔCT法定量分析扩增曲线及溶解曲线,以GAPDH 为内参衡量靶细胞目的基因表达量。
2.7 统计学分析 通过SPSS 16.0 软件进行处理,数据以()表示,组间比较采用单因素方差分析(analysis of variance,ANOVA)。P<0.05 表示差异具有统计学意义。
3 结果
3.1 原花青素对HeLa 细胞增殖的影响 原花青素质量浓度在0~50 mg/L 之间时,对宫颈癌HeLa细胞的抑制率无明显变化并较低,仅大约为10%,而且差异无统计学意义(P>0.05);从100 mg/L开始抑制率显著提升,最高可达44.73%。为了避免原花青素由于抑制宫颈癌细胞而产生抑制侵袭迁移作用,划痕、Transwell 实验选取50 mg/L 作为其质量浓度。见图1。

图1 原花青素对HeLa 细胞增殖的影响(, n=6)Fig.1 Effect of proanthocyanidins on HeLa cell proliferation(, n=6)
3.2 原花青素对HeLa 细胞迁移的影响 对照组细胞保持了原有的迁移能力;原花青素干预后12、24 h 细胞迁移距离缩短,与对照组比较,差异有统计学意义(P<0.01)。见图2。
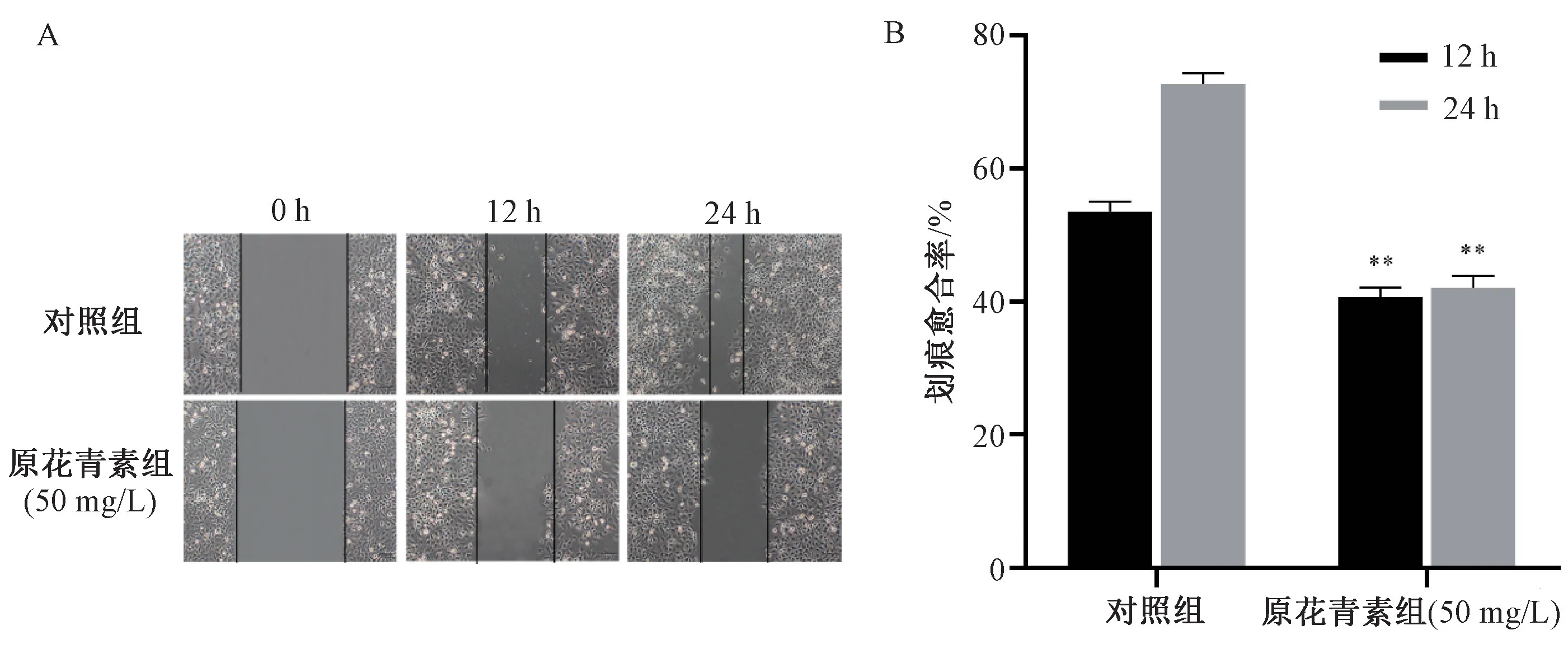
图2 原花青素对HeLa 细胞迁移的影响(, n=3,×100)Fig.2 Effect of proanthocyanidins on the migration of HeLa cells(, n=3,×100)
3.3 原花青素对HeLa 细胞侵袭的影响 对照组在不同时间点穿模细胞数呈上升趋势;50 mg/L 原花青素干预12、24 h 后,穿膜细胞数与对照组比较得到了抑制(P<0.05,P<0.01),并呈时间依赖性。见图3。
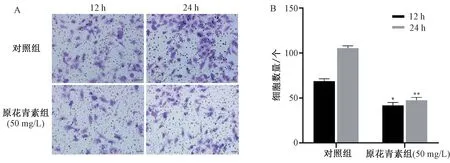
图3 原花青素对HeLa 细胞侵袭的影响(, n=3,×200)Fig.3 Effect of proanthocyanidins on the invasion of HeLa cells(, n=3,×200)
3.4 原花青素对HeLa 细胞中EMT 相关蛋白的影响 TGF⁃β1 蛋白光密度在对照组中最高,而不同剂量原花青素干预后降低(P<0.05,P<0.01);E⁃cadherin 蛋白光密度在对照组中最低,而不同剂量原花青素干预后升高(P<0.05,P<0.01),并均呈浓度依赖性。见图4。

图4 原花青素对HeLa 细胞中EMT 相关蛋白的影响(, n=3)Fig.4 Effect of proanthocyanidins on EMT⁃related proteins in HeLa cells(, n=3)
3.5 原花青素对HeLa 细胞中TGF⁃β1、E⁃cadherin蛋白表达的影响 TGF⁃β1 蛋白表达在对照组中最高,而原花青素干预后降低(P<0.05,P<0.01);E⁃cadherin 蛋白表达在对照组中最低,而原花青素干预后升高(P<0.05,P<0.01)。见图5。
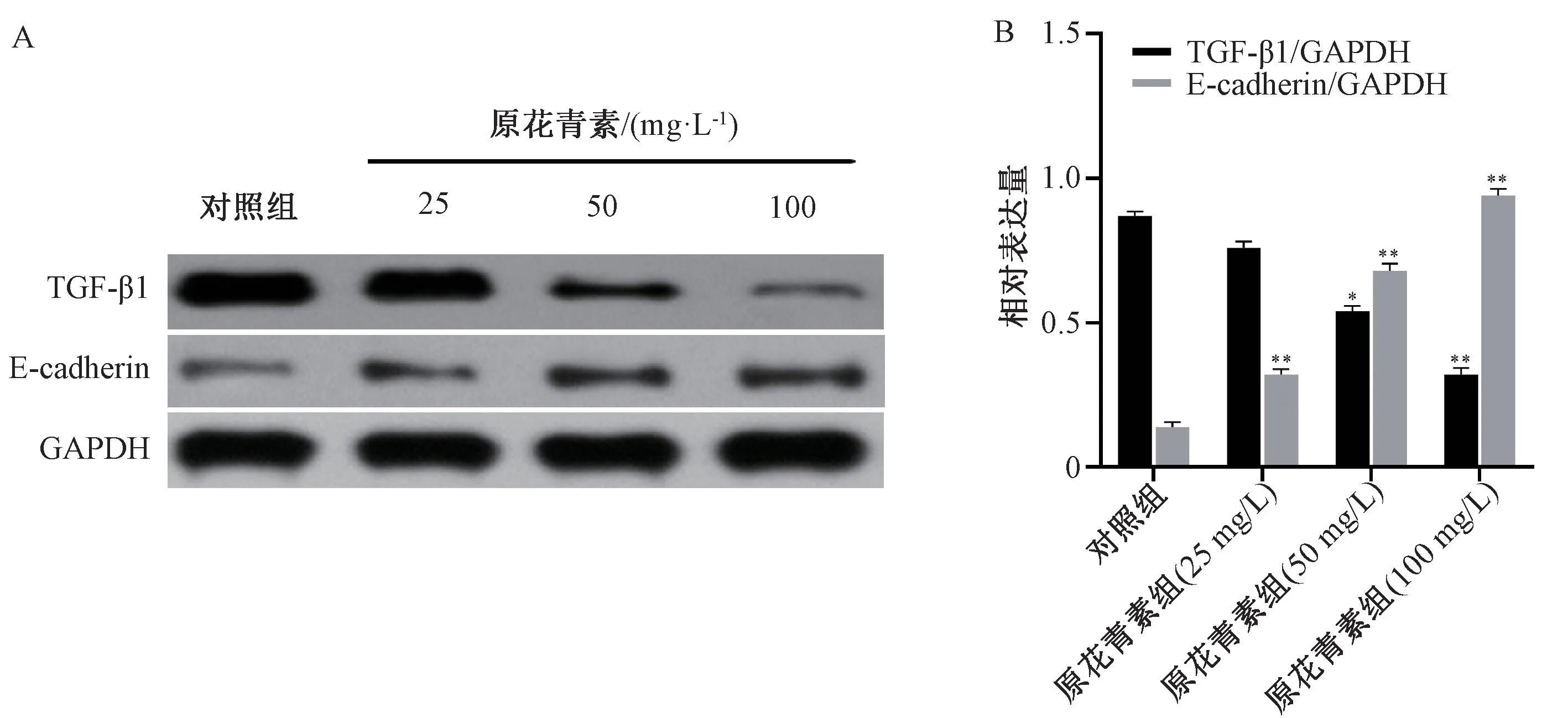
图5 原花青素对HeLa 细胞中TGF⁃β1、E⁃cadherin 蛋白表达的影响(, n=3)Fig.5 Effects of proanthocyanidins on the protein expressions of TGF⁃β1 and E⁃cadherin in HeLa cells(, n=3)
3.6 原花青素对Smad 蛋白表达的影响 原花青素对Smad2、Smad3 蛋白表达无明显影响(P>0.05),但对pSmad2、pSmad3 蛋白表达有抑制作用(P<0.01),同时还可上调Smad7 蛋白表达(P<0.01),并呈剂量依赖性。见图6。

图6 原花青素对Smad 蛋白表达的影响(, n=3)Fig.6 Effects of proanthocyanidins on the protein expressions of Smads(, n=3)
3.7 原花青素对E⁃cadherinmRNA 表达的影响加入10 μmol/L 抑制剂SB431542 后,E⁃cadherinmRNA 表达与对照组比较,差异无统计学意义(P>0.05);100 mg/L 原花青素干预后,E⁃cadherinmRNA 表达降低(P<0.01)。见图7。

图7 原花青素对E⁃cadherin mRNA 表达的影响(, n=3)Fig.7 Effect of proanthocyanidins on the mRNA expression of E⁃cadherin(, n=3)
4 讨论
本实验为了避免宫颈癌细胞增殖带来的实验误差,采用了无血清培养基,并将实验控制在24 h。同时为了避免原花青素是由于产生抑制宫颈癌细胞而产生抑制侵袭迁移作用,采用了MTT 实验明确原花青素对宫颈癌细胞的用药剂量,结果显示原花青素质量浓度在50 mg/L 以下时细胞抑制率较低,因此划痕和Transwell 实验最终质量浓度确定为50 mg/L(图1)。用药后12、24 h,在原花青素的作用下HeLa 细胞侵袭和迁移能力出现了不同程度的减弱,并呈时间依赖性(图2~3)。
EMT 是指上皮细胞在形态学上发生向间质细胞表型的转变并获得迁移能力的过程[7]。细胞失去极性,细胞的迁移和运动能力增强,同时细胞表型发生改变,出现间质细胞的特性,导致细胞间连接松散,使肿瘤细胞侵袭和迁移的能力增强[8]。EMT 是肿瘤细胞获得迁移能力的方式之一,它是肿瘤细胞浸润、转移的重要途径[9]。
EMT 形成的机制备受人们的关注,其中TGF⁃β 是被广泛认可的调控EMT 过程的重要蛋白[10]。其主要通过Smad 依赖型和非Smad 依赖型两条信号通路调控下游转录因子,参与EMT 的调控过程[11]。研究表明,TGF⁃β 是最早被发现能够诱导肿瘤细胞EMT 过程发生的主要因素之一,其主要包括TGF⁃β1、TGF⁃β2、TGF⁃β3亚型,其中以TGF⁃β1 含量最高,与EMT 形成关系最为密切[12]。TGF⁃β1 在肿瘤细胞生长晚期可以促进肿瘤细胞的转移,其促癌的作用通常与诱导肿瘤细胞EMT 同步发生[13]。多项实验表明,肿瘤细胞里TGF⁃β1 的含量与促进肿瘤细胞迁移和侵袭正相关[14⁃15]。
E⁃cadherin 是维持上皮细胞极性和细胞间粘附的主要分子,其主要的功能是其可以形成蛋白复合体连接到肌动蛋白细胞骨架,阻止肿瘤细胞的转移和侵袭[16],而EMT 可以使上皮细胞粘附分子及细胞骨架成分减少或消失从而获得间质细胞表型。因此,E⁃cadherin 表达减少或消失是肿瘤细胞产生EMT 的重要标志[17]。
为了证明原花青素抑制宫颈癌侵袭和迁移的能力与EMT 有关,本研究采用了免疫荧光技术,半定量分析用药前后宫颈癌细胞内TGF⁃β1 和E⁃cadherin 的含量,实验发现,在药物作用下,宫颈癌HeLa 细胞中的TGF⁃β1 均出现了不同程度的降低,呈浓度依赖(图4)。为了进一步观察药物作用与EMT 有关,同时也为了验证免疫荧光的结果,采用Western blot 检测了TGF⁃β1 和E⁃cadherin 蛋白表达的水平,采用软件进行了定量分析。结果显示原花青素可以降低TGF⁃β1 蛋白的含量,提高E⁃cadherin 蛋白含量,从而抑制宫颈癌EMT 的形成(图5)。
此外,TGF⁃β/Smads 信号的激活与肿瘤密切相关,TGF⁃β/Smads 信号通路在肿瘤发生晚期可促进肿瘤细胞的生长、浸润与转移。Smad 蛋白是TGF⁃β1 受体的结合蛋白,介导细胞内TGF⁃β 信号的传导[18]。可以分为以下3 类:受体结合的Smad(R⁃Smad)、Co⁃Smad(Smad4)和抑制 性Smad(I⁃Smads)。Smad2、Smad3 属于受体结合的Smad[19]。TGF⁃β 与TGF⁃β 受体Ⅱ(TGF⁃βRⅡ)结合,可以磷酸化细胞内下游转录因子Smad2 和Smad3,磷酸化的Smad2、Smad3 与Smad4 结合形成异源复合物,转移到细胞核内并在核内积累,形成转录复合物与其他转录因子协同作用[20]。Smad7 属于TGF⁃β 受体拮抗蛋白,一旦激活后可以阻止Smad2/3 产生磷酸化,抑制Smad2/3 的活性,Smad7 可以负反馈调节TGF⁃β 对胞核靶基因转录的影响,进而抑制由TGF⁃β 信号引起的细胞产生的EMT 作用[21]。
为了找出原花青素抑制宫颈癌细胞EMT 的作用靶点,本研究通过Western blot 检测了Smad 通路相关蛋白后发现,原花青素对HeLa 细胞没有磷酸化的 Smad2、Smad3 没有影 响,对磷酸 化Smad2、Smad3 蛋白产生了抑制作用,同时还可以上调Smad7 蛋白含量(图6)。在联合Smad 通路抑制剂SB431542 的作用下,原花青素对EMT 下游指标E⁃cadherin的作用出现降低,提示原花青素可以通过Smad 通路抑制宫颈癌细胞EMT 的产生(图7)。
综上所述,原花青素在体外作用人宫颈癌HeLa 细胞可以通过下调TGF⁃β1 和上调E⁃cadherin蛋白含量抑制宫颈癌细胞产生EMT,进而抑制宫颈癌细胞的侵袭迁移能力。其作用机制与抑制TGF⁃β1 介导的Smad 依赖性通路中的Smad2/3 产生磷酸化,增强Smad7 蛋白含量有关。原花青素有望成为作为临床宫颈癌化疗的辅助用药。

