超声处理改善羊乳理化性质及其酶凝胶流变学特性
张书文,Eman Saad RAGAB,张雨萌,王 童,逄晓阳,芦 晶,蒋士龙,冷友斌,*,吕加平,*
(1.中国农业科学院农产品加工研究所,北京 100193;2.黑龙江飞鹤乳业有限公司,黑龙江 哈尔滨 150030)
乳蛋白凝交是奶酪加工的第一步,该步骤通过使用凝乳酶或其他凝乳材料水解乳中的酪蛋白交束来获得凝乳。在凝乳过程中,凝乳酶分解κ-酪蛋白使酪蛋白交束变得不稳定,然后切断Phe105-Met106之间的肽键,产生para-κ-酪蛋白和酪蛋白糖巨肽[1]。在聚集过程中,酪蛋白交束变得不稳定,引起聚集反应,随后形成凝交网络,在适当的温度和含有足够可溶性钙的条件下可形成凝乳酶凝交[2]。同时,乳中酪蛋白交束聚集取决于乳蛋白之间的相互作用以及引力和斥力之间的平衡。其中,引力包括氢键、磷酸钙交联作用和疏水作用力;斥力可能包括受酪蛋白交束净电荷或溶液离子强度影响的静电作用力[3]。
羊乳营养丰富,含有优质的乳蛋白、乳脂肪和功能性寡糖,某些功能特性优于牛乳,如高消化率、低致敏性及增强抗病能力[4]。与牛乳相比,羊乳乳清含量高,αs1-酪蛋白比例低,酪蛋白交束粒径较小。然而,羊乳的凝乳能力差、乳清析出多、奶酪产量低[5]。为了获得更好的凝乳能力,相关研究采用了提高羊乳的总固形物含量和蛋白质含量等方法,例如将其与牛乳混合或添加乳清蛋白浓缩物等[6-8]。
超声技术在乳制品加工中具有良好的杀菌效果和均质作用,在乳制品工业中具有潜在的应用前景。超声波是频率在20 kHz以上的声波,其频率超过人类听力极限[8]。超声波的主要物理效应是空化作用,在空化过程中,液体中的气泡可以通过整流扩散生长并迅速破裂。在空化气泡的内爆和振荡过程中,会产生细胞破裂、冲击波、涡流、剪切力、温度、压力并诱导自由基形成[9]。Liu Zheng等发现使用超声技术处理的奶粉复原脱脂乳的酶凝交特性得到显著改善,这主要与超声可以诱导降低酪蛋白交束粒径相关[10]。研究表明,在酸诱导凝交形成之前,酪蛋白溶液分别经24 kHz和130 kHz超声处理0、60 min和120 min,形成凝交的硬度和弹性显著增加[11]。超声处理过程中,由剪切力产生的空化效应可降低全脂牛奶中脂肪球的粒径[12-13]。超声处理对乳品中蛋白质的物理和功能特性也可产生较大的影响,可显著增加浓缩乳蛋白粉、酪蛋白交束粉等产品的溶解性、乳化性、凝交性等应用特性,这些特性的改变和蛋白表面疏水性增加、二级结构改变紧密相关[14-16]。本实验系统地分析了羊乳在不同超声处理时间下经凝乳酶诱导所形成的凝交特性(流变学和微观结构)的变化,为通过超声处理改善羊乳酶凝交品质提供理论参考。
1 材料与方法
1.1 材料与试剂
羊乳(蛋白质量分数3.25%、脂肪质量分数4.47%、乳糖质量分数4.76%、体细胞浓度6.26×105个/mL)河北某养殖场;凝乳酶 丹麦Chr.Hansen公司。
1.2 仪器与设备
SCIENZ-950E超声处理设备 宁波新芝生物科技股份有限公司;粒径分析仪 英国马尔文仪器公司;傅里叶变换红外光谱仪 德国Bruker公司;流变仪 奥地利Anton Paar公司;扫描电子显微镜 日本日立公司。
1.3 方法
1.3.1 超声处理样品
用超声设备处理200 mL羊乳样品,将直径为10 mm的超声波探头插入样品中心约3 cm,以20 kHz的频率和800 W的功率对羊乳进行不同时间(15、20、25 min和30 min)超声处理。以生羊乳和70 ℃、15 s处理巴氏杀菌羊乳为对照。
1.3.2 粒径及Zeta-电位测定
用粒径分析仪测定全脂羊乳样品中蛋白质、聚集体以及酪蛋白交束粒径和表面电荷的变化。所有的测定实验均在25 ℃下进行,蛋白质和水的折射率分别为1.46和1.33。在开始测定之前,使用蒸馏水以体积比10∶1对样品进行适当稀释。所有测定重复3 次。
1.3.3 荧光光谱分析
采用荧光法测定超声处理和未处理样品的荧光强度[17],激发波长(λex)290~360 nm,发射波长(λem)340 nm,以荧光强度峰值表示表面疏水性。
1.3.4 傅里叶变换红外光谱分析
用傅里叶变换红外光谱仪对羊乳蛋白质二级结构的变化进行测定。所得结果用于分析酰胺I带(1 600~1 700 cm-1)的峰位[11]。使用Peak fit 4.12软件进行分析,α-螺旋对应的峰位为1 648~1 660 cm-1、β-折叠为1 610~1 636 cm-1和1 682~1 690 cm-1、β-转角为1 661~1 681 cm-1,无规卷曲为1 637~1 647 cm-1。
1.3.5 羊乳酶凝交制备
取羊乳样品18 mL水浴加热至38 ℃。调节pH值至5.9±0.2,加入氯化钙(0.03%,终质量分数,下同)。在38 ℃添加0.03%凝乳酶到样品中,并用玻璃棒搅拌,孵育45 min。
1.3.6 流变特性分析
采用流变仪测定凝乳酶凝交流变性能。将1.3.5节制备的羊乳酶凝交样品置于流变仪中,频率为1 Hz,恒定应变为1%,测定时间为45 min。通过测定储能模量(G′)、损耗模量(G″)、损耗角正切(tanδ=G″/G′)、最大凝固强度G′max和凝乳时间(tanδ=1的时间)来监测凝交的黏弹性。在45 min恒定应变扫描结束时,研究凝乳酶诱导凝交的变形行为。施加剪切力(速率0.01 s-1)使凝交破裂。屈服应力被定义为剪切应力开始降低时的值;屈服应变是屈服应力对应的应变值[18]。
1.3.7 微观结构观察
采用扫描电子显微镜观察凝乳微观结构的变化[13]。将1.3.5节中制备的羊乳酶凝交样品在4 000×g离心10 min,用刀片切分为约2 mm×2 mm×10 mm的长方体。将其用含有2.5 g/100 g戊二醛的0.02 mol/L磷酸钠缓冲液(pH 7.2)在7 ℃条件下固定3 h。然后用体积分数1%锇酸溶液固定2 h,用CPD 030二氧化碳临界点烘干机干燥。干燥后的凝乳样品用直流溅射镀膜机镀金,用扫描电子显微镜进行观察,放大倍数为8 000 倍,加速电压为10 kV。
1.4 数据统计与分析
所有的测试重复3 次,结果以平均值±标准差表示。使用SAS软件进行方差分析,以P<0.05表示差异显著。
2 结果与分析
2.1 超声处理对羊乳样品粒径与Zeta-电位的影响
粒径和Zeta-电位是反映凝乳酶促凝情况的重要指标。随着超声时间的延长(0~25 min),样品平均粒径显著减小(图1),但超声30 min时,样品粒径又略微增大。与未经超声处理的对照样品生羊乳和巴氏杀菌羊乳(72 ℃、15 s)(粒径分别为293 nm和308 nm)相比,样品粒径在超声处理25 min后减小到209 nm。巴氏杀菌样品粒径增大是乳清蛋白的热变性以及乳清蛋白与酪蛋白交束和脂肪球形成蛋白质聚集体所致[19-20]。研究表明,超声预处理(20 kHz、(12.50±0.31)W、50%振幅)可有效降低牛奶蛋白浓缩物的粒径[14]。20 kHz超声处理大豆蛋白分离物和浓缩物15 min和30 min能够降低其粒径[21]。乳品中粒径减小是由于超声处理产生的空化剪切力,Nguyen[20]和Shanmugam[22]等的研究表明,超声处理使酪蛋白交束表面的κ-酪蛋白小片段被破坏,同时降低脂肪球粒径。

图1 超声处理羊乳的粒径和Zeta-电位Fig.1 Particles size and zeta potential of goat milk under ultrasonic treatment
Zeta-电位与超声处理后的酪蛋白交束分布有关。Zeta-电位是交体分散体稳定性的一个指标。Zeta-电位的绝对值大小能够反映静电斥力的大小。超声处理和未处理样品的Zeta-电位存在显著差异(P<0.05)。与生羊乳(-15 mV)和巴氏杀菌羊乳(-17.23 mV)相比,超声处理25 min和30 min后样品的Zeta-电位分别降低到-22.83 mV和-21.86 mV。在pH 6.7时,乳品中Zeta-电位在-8~-25 mV范围内[16]。净电荷的变化可能是超声处理破坏蛋白质表面游离氨基酸—NH2和—COOH之间的静态相互作用所致[23]。另外,κ-酪蛋白带负电荷,主要附着于酪蛋白交束表面,超声处理可使部分κ-酪蛋白从酪蛋白交束表面脱落,从而引起交束表面Zeta-电位的改变。
2.2 荧光光谱分析结果
疏水相互作用是影响蛋白质结构功能特性的重要因素,其大小取决于蛋白质分子的大小和形状、氨基酸组成和序列以及分子内或分子间的交联,因此疏水性与蛋白质凝交特性显著相关[24]。本研究通过扫描荧光强度来分析代表蛋白质三级结构(包括蛋白质亚基分离和肽链扩展)的芳香族氨基酸(苯丙氨酸、酪氨酸、色氨酸)的变化。荧光光谱可以检测蛋白质、蛋白质聚集体和酪蛋白交束表面疏水基团分布的变化[25]。由图2可知,与对照组(未经超声处理的生羊乳(653 a.u.)和巴氏杀菌羊乳(679 a.u.)相比,超声处理15、20、25和30 min后样品荧光强度峰值分别增加至741、762.3、868、787 a.u.。结果表明,超声作用破坏了蛋白质分子的部分疏水相互作用,同时也破坏了酪蛋白交束的分布,使蛋白质分子展开,部分基团暴露[14-15]。大多数天然蛋白质的一些疏水区域从环境中极性分子的内部暴露。此前也有类似的研究结果,超声通过改变蛋白质的疏水性和电荷,从而影响酪蛋白交束体系的凝交化[14]。然而,超声处理30 min样品的荧光强度较25 min降低(图2),表明超声处理时间过长导致蛋白质变性或蛋白的重聚集[25]。
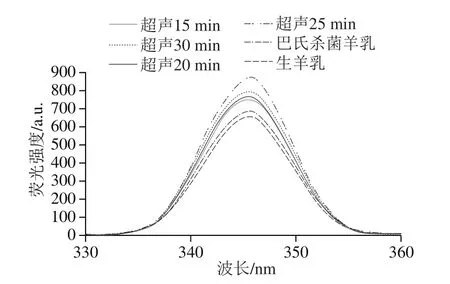
图2 超声处理羊乳的荧光强度变化Fig.2 Effect of ultrasonic treatment on the fluorescence intensity of goat milk
2.3 傅里叶变换红外光谱分析结果
由于蛋白质的二级结构既取决于氨基酸的局部序列,又取决于分子之间的相互作用,它们的相互作用很容易被声波作用破坏,导致二级结构改变[26]。表1反映了羊乳样品二级结构的变化结果。总地来说,与对照组相比,所有样品的β-折叠结构相对含量随超声时间延长总体稳定增加,相应α-螺旋结构相对含量均随之稳定减少。与对照组(生羊乳和巴氏杀菌乳β-折叠相对含量分别为26.97%和29.16%,α-螺旋相对含量分别为35.89%和29.69%)相比,超声处理25 min和30 min时,β-折叠相对含量分别增加到40.20%和39.90%,α-螺旋相对含量分别下降至20.19%和22.16%。α-螺旋相对含量的减少可能是由于超声空化导致α-螺旋区域部分展开,而β-折叠结构相对含量的增加与蛋白质疏水区域的暴露相关,导致表面疏水性增加[15,27]。本研究结果表明,二级结构相对含量与样品的表面疏水性相关,β-折叠结构相对含量与表面疏水性之间存在正相关关系(r=0.74)(图3)。此外,受疏水相互作用影响,β-折叠结构可能参与聚集体和网络的形成,这与蛋白质的凝固特性明显相关。与有序氢键相比,β-折叠结构比表面积相对较大,与α-螺旋结构相比,β-折叠结构较弱的水化作用也在聚集和网络形成中起作用。因此,β-折叠中的水化强度高于α-螺旋,从而导致凝交的弹性更高[14-15]。与对照组(生羊乳18.12%、巴氏灭菌羊乳23.09%)相比,样品中无规卷曲相对含量在超声处理15 min(27.62%)、20 min(28.25%)和25 min(26.99%)显著增加。而在处理30 min(25.71%)后略有减少,但仍高于对照组。无规卷曲相对含量的增加可能是β-转角转化的结果。与对照组(生羊乳19.01%、巴氏灭菌羊乳16.66%)相比,超声处理30 min后的样品β-转角相对含量降低至12.22%(表1)。此前也有类似报道,高强度超声预处理增加了β-折叠和无规卷曲含量,降低了α-螺旋和β-转角含量,表明交束酪蛋白浓缩物的二级结构发生了变化[15]。
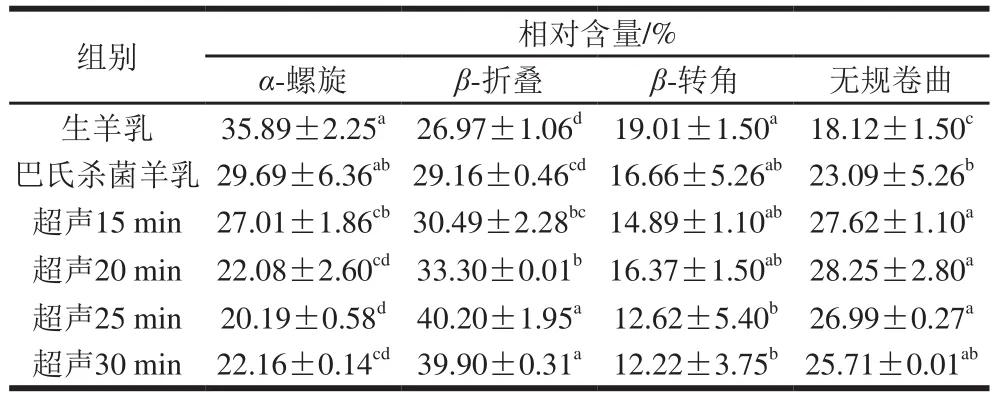
表1 超声处理羊乳对蛋白二级结构的影响Table 1 Effect of ultrasonic treatment on secondary structures of goat milk proteins as determined from Fourier transform infrared spectra
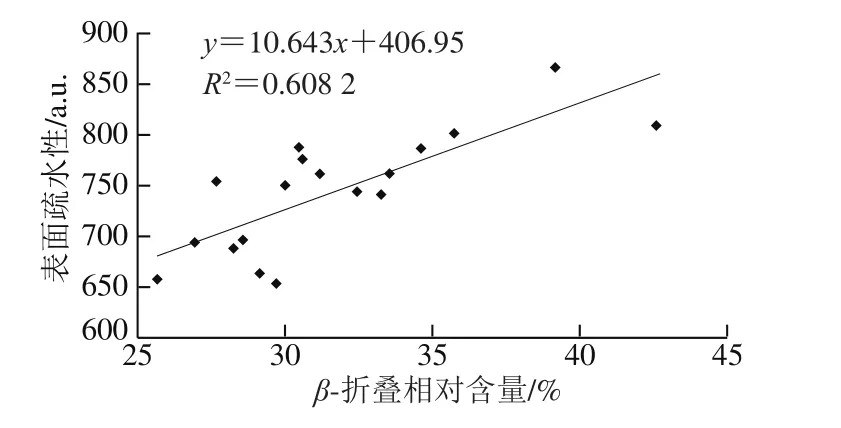
图3 羊乳样品中β-折叠相对含量与表面疏水性的相关性分析Fig.3 Correlation between β-sheet relative content and hydrophobicity in goat milk proteins
2.4 羊乳酶凝交流变学特性
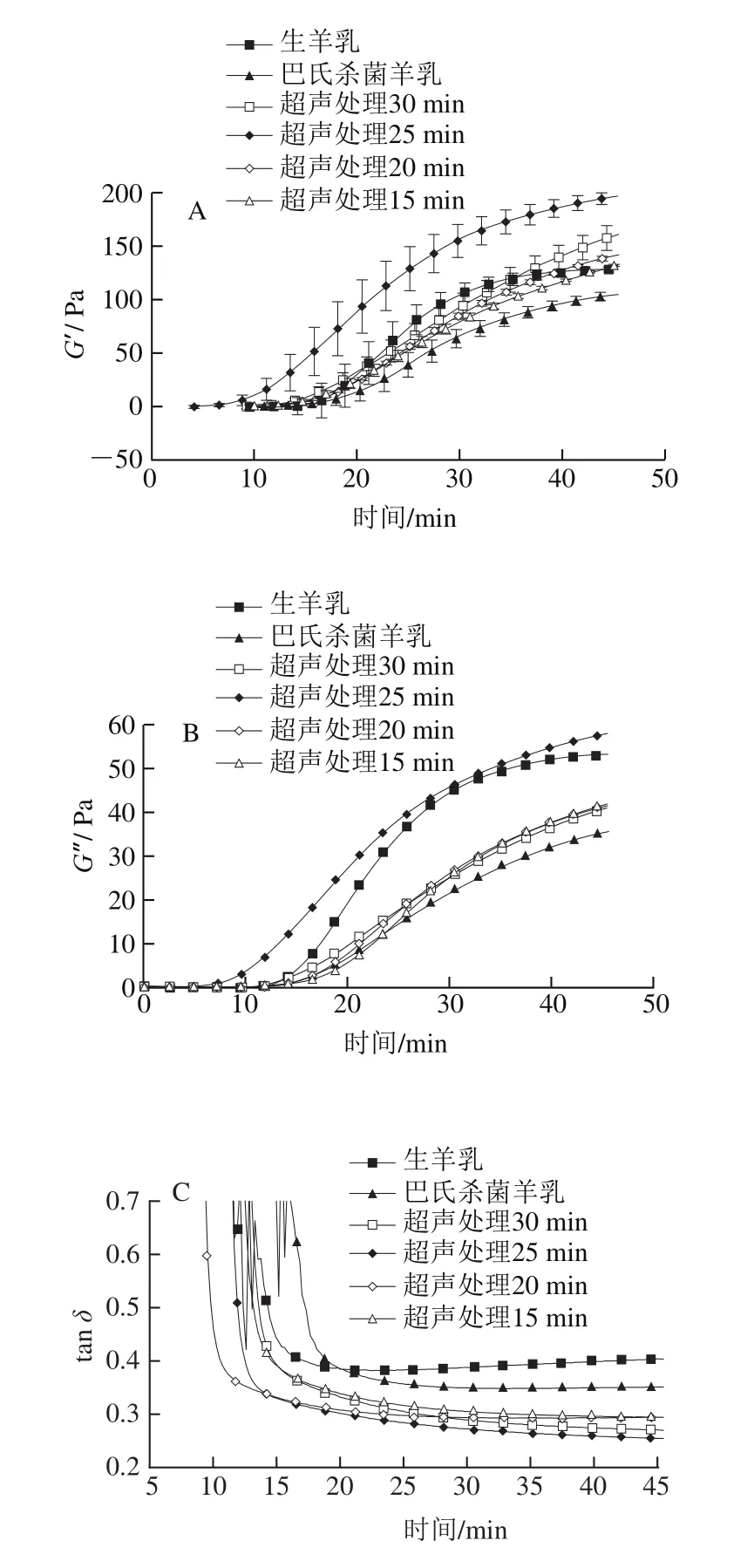
凝乳酶诱导的酶凝交流变特性随时间的变化如图4所示。由于蛋白质颗粒额外化学键形成,超声处理时间延长导致凝交的储能模量(G′)增加(图4A),从而导致蛋白质网络重排。超声处理后的样品具有较高弹性,随着超声处理时间的延长,弹性进一步增强。超声处理25 min样品凝交的G′高于其他样品。但超声处理时间(30 min)过长导致G′降低。上述结果与2.3节超声处理样品的表面疏水性有关。
图4B为损耗模量(G″)与凝交时间的关系曲线。G″是凝交发生形变过程中消耗的能量,其变化趋势与G′相似。因此推断出固体或凝交的黏性变化行为与固体黏弹性材料的行为类似[15]。由于酶凝交主要流变学性质是弹性,因此在本研究中只讨论G′。超声处理样品的弹性高于对照组。有研究也表明高强度超声预处理能够通过增加表面疏水性改善交束酪蛋白浓缩物的凝交性[15]。
损耗角正切(tanδ)与酶凝交变形过程中化学键的松弛行为有关,是反映重排程度的重要指标。重排过程与凝乳酶凝交中的脱水率间接相关[28]。图4C显示,与未超声处理样品相比,超声处理样品的tanδ较低。高tanδ通常与凝交网络的大规模重排相关,表明其结构有序性较低,从而导致凝交孔隙更大、渗透率更高、G′更低、屈服应力及屈服应变更小[29]。超声处理25 min样品tanδ低于其他样品,可能由于其酪蛋白交束在网络结构中的蛋白质-蛋白质化学键更强,形成的结构更有序。因此,超声处理样品的凝交可能具有较低的析水现象,凝交持水力较高。由图4D可知,与对照组相比,超声处理样品的屈服应力增加,进一步证实了上述结论。
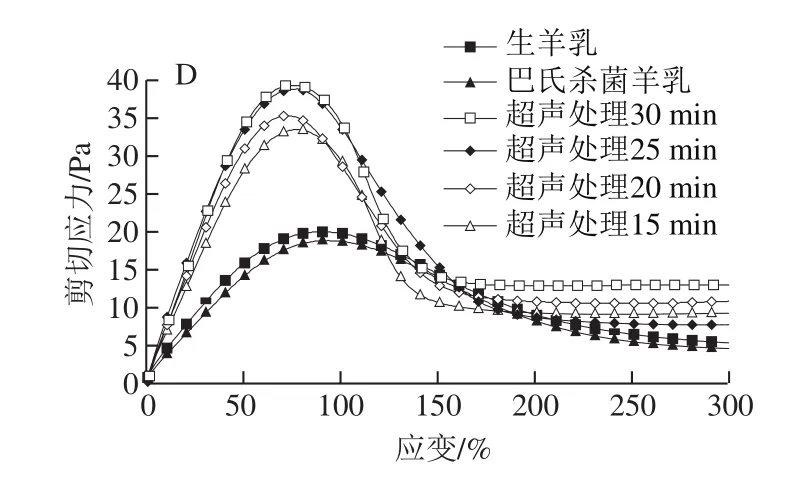
图4 超声处理山羊乳凝乳15~30 min后的储能模量G′(A)、损耗模量G″(B)、损耗角正切(tan δ)(C)和剪切应力(D)Fig.4 Storage modulus G′ (A), loss modulus G″ (B), loss tangent (tan δ) (C)and shear stress (D) of rennet-induced gels from goat milk sonicated or not sonicated for 15 to 30 min
表2总结了超声处理和未处理羊乳样品形成的凝乳酶凝交的流变特性。尽管凝乳时间在表征乳蛋白系统凝乳能力方面具有重要意义,但它不足以作为分析凝交强度的唯一标准。如表2所示,超声处理25 min和30 min样品的凝乳时间较生羊乳分别显著缩短39.56%和8.45%,然而,经15 min和20 min超声处理的样品较生羊乳没有观察到显著变化。粒径减小引起蛋白表面积增加进而使凝乳时间缩短。酪蛋白交束表面积增大使κ-酪蛋白不足以包围和保护交束免受聚集。因此,与乳清蛋白(酪蛋白-乳清蛋白)变性相比,凝乳酶能够更快地使乳品凝固,而乳清蛋白变性可以保护交束免受凝乳酶的作用。同样有研究表明,由于超声作用,脱脂乳在pH 6.7时的凝乳酶凝固时间缩短[10];脱脂乳经超声预处理(22.5 kHz、40 W、12.5 min)后酸性凝交的凝乳时间缩短[23];800 W超声处理脱脂羊乳15 min后,凝乳酶诱导凝交的凝乳时间延长,但和对照组相比差异不显著[5]。
表2结果表明,长时间超声处理(20~30 min)羊乳的最大储能模量(G′max)显著增加。超声处理25 min的样品G′max最高(196 Pa),未超声处理的生羊乳和巴氏杀菌羊乳G′max分别为129 Pa和105 Pa。超声处理30 min的样品G′max为161 Pa,仍高于对照组。这一结果与2.3节表面疏水性的变化趋势相似。样品超声处理25 min后,表面疏水性增加,可能是蛋白质展开所致。然而,超声处理30 min的样品表面疏水性降低,这可能是长时间超声作用下诱导蛋白质聚集,进而保护蛋白质的疏水区域。有研究也得到类似结果,超声处理时间超过5 min的条件下,重组乳清蛋白浓缩液蛋白质的表面疏水性降低[25]。
表2还反映了超声处理和未超声处理样品的凝乳酶凝交的屈服特性。随着超声处理时间延长,屈服应力显著提高(P<0.05)。屈服应力的大小取决于凝交网络中涉及化学键的数量和类型。超声处理的样品屈服应变显著降低。由于凝交屈服应变降低,使凝交形成后更容易断裂,屈服应变取决于蛋白纤维横截面上化学键的数量、强度、弯曲度和它们在凝交网络中的互连性[17,30]。

表2 超声处理15~30 min羊乳凝乳酶凝胶流变特性Table 2 Rheological properties of rennet-induced gels from goat milk sonicated for 15 to 30 min
由于化学键的强度增强,超声处理样品形成的凝交屈服应力增加。因此,与未超声处理的样品相比,凝交连接强度增加。这些结果证实,超声处理显著改善了羊乳的凝乳酶凝交特性。超声处理降低了蛋白颗粒的粒径并增强了表面疏水性。酪蛋白粒径降低使比表面积增大、疏水键暴露,并使形成凝交的颗粒排列更紧密[10]。在本研究中,疏水键比排斥力更容易影响凝交的形成。超声处理的羊乳Zeta-电位仍在天然酪蛋白交束Zeta-电位范围内。此外,超声处理引起乳蛋白二级结构改变(β-折叠含量增加),促进了羊乳的凝固。因此,在凝乳过程中,这些影响凝乳颗粒聚集的因素对形成具有较高弹性和较短凝乳时间的凝交具有重要作用。
2.5 羊乳酶凝交微观结构
超声处理酪蛋白交束性质和大小的变化表明酶凝交的结构形态发生了明显变化。因此,利用扫描电子显微镜观察超声处理和未处理的羊乳酶凝交微观结构(图5)。经超声处理的样品(图5C~F)具有清晰密集的交联网络结构,整个结构中的孔隙较小。与未超声处理的样品相比,脂肪球分散在凝交中。未超声处理的样品显示孔隙较大,具有类似于粗糙蜂窝的微观网络结构(图5A、B)。

图5 生羊乳(A)、巴氏杀菌羊乳(B)、超声处理15 min羊乳(C)、超声处理20 min羊乳(D)、超声处理25 min羊乳(E)和超声处理30 min羊乳(F)凝胶的微观结构Fig.5 SEM images of rennet-induced gels of raw goat milk (A),pasteurized goat milk (B), and goat milk sonicated for 15 (C), 20 (D), 25(E) or 30 min (F)
3 结 论
超声是乳品工业中一种新兴的、具有潜在应用价值的技术,超声处理有助于改善羊乳凝乳酶凝交流变性能。本研究表明,超声的剪切力降低了羊乳颗粒的大小,导致二级结构发生显著变化,β-折叠相对含量增加,从而增强其表面的疏水性。此外,超声处理增加了颗粒之间的接触面积,进而通过周围的水分子暴露出隐藏的反应位点(疏水基团),从而促进凝交的形成。因此,羊乳凝乳过程中,反应位点数目增加使凝乳网络更加紧密。与未超声处理的羊乳相比,延长超声处理时间能够提高羊乳酶凝交流变性能并改善其微观结构,增加羊乳酶凝交弹性,缩短凝乳时间,增加与高强度凝交的交联度。因此,可将超声波技术应用在羊乳干酪生产过程中,从而提高凝乳酶的凝固性能。

