猪lincRNA-CXCL6调控LPS诱导炎症反应的机制研究
邢菲,方晓敏,杨晓阳,付言峰,陈哲,王丽,涂枫,任守文,李碧侠,陈杰,赵为民*
(1.南京农业大学动物科技学院,江苏 南京 210095;2.江苏省农业科学院畜牧研究所/江苏省农业种质资源保护与利用平台,江苏 南京 210014)
集约化、工厂化养猪已成为当今养猪业的发展主流。随着养殖密度的增加,猪容易受到饲养环境中致病菌的感染(如副猪嗜血杆菌、霍乱沙门氏菌),这些致病菌可通过其细胞壁释放的LPS导致机体产生过量炎症因子,出现全身性炎症反应,进而严重影响动物的生长发育、生产性能甚至造成死亡[1],严重阻碍养猪生产业的健康发展。
先天免疫系统是宿主防御病原体感染的第一道防线。它利用位于不同细胞亚区的模式识别受体(PRR)(例如Toll样受体,TLR;NOD样受体,NLR)来识别微生物产物(例如脂多糖,LPS)并诱导细胞内信号网络,引发炎症反应以消除病原体[2-3],而免疫应答基因(immune response gene,IRG)的动态协调表达在炎症反应中发挥了关键作用[4]。
长链非编码RNA(lncRNA)是一类长度大于200 bp的非编码RNA。自从鉴定出2个lncRNAH19和Xist基因以来[5-6],lncRNA被认为在细胞各个生理活动中发挥着重要作用,包括X染色体失活[7-9]、印记基因表达[10]、重编程[11]、细胞凋亡[12]、自噬[13]和肿瘤发生[14]。近年来,lncRNA在调节先天性免疫应答中也发挥着重要作用。例如,lincRNA-Cox2(lincRNA,基因间lncRNA)可调节三酰脂肽(Pam3CSK4)诱导的炎症反应和NOD样受体家族蛋白3(NLRP3)炎性小体[15-16]。lncRNA-NEAT1在poly I∶C刺激下介导白细胞介素8(IL-8)的转录激活[17]。lncRNA-Mirt2与肿瘤坏死因子受体相关因子6(TRAF6)结合并限制促炎因子的表达[18]。lncRNA已成为IRG表达调控的重要调节因子,从lncRNA的层次解析IRG的调控网络有助于深入理解LPS诱导的猪机体炎症反应的机制,为提供更加有效的防控措施提供靶标。
本课题组前期研究鉴定了一批在猪巨噬细胞炎症反应中的差异表达lncRNA[19],发现上调最大倍数之一的lincRNA-CXCL6位于炎症因子CXCL6和CXCL8之间,其在LPS诱导的炎症反应中显著上调,表明该lncRNA可能在LPS诱导的炎症反应中具有重要作用。
本研究探讨了猪lincRNA-CXCL6的表达模式以及lincRNA-CXCL6在LPS介导的炎症反应中的调控机制,为防御由细菌性疾病引起的炎症损伤提供新的基因研究素材。
1 材料与方法
1.1 试验材料
DH5a感受态菌株购于北京擎科新业生物技术有限公司;苏紫猪成年组织样品来源于江苏省农业科学院六合动物实验基地;猪原代肺泡巨噬细胞和质粒载体pcDNA3.1由江苏省农业科学院畜牧研究所动物品种改良和繁育重点实验室保存;RAW264.7细胞购于中国科学院上海生命科学研究院细胞资源中心。
1.2 主要试剂与仪器
RNA提取试剂盒均购于百泰克;DNA聚合酶、RACE试剂盒、限制性内切酶BamHⅠ和EcoRⅠ、T4连接酶、pMD19-T载体、qPCR试剂、反转录试剂盒购于TaKaRa公司;ERK1/2与p-ERK1/2抗体、甘油醛-3-磷酸脱氢酶(GAPDH)抗体购于CST公司;细胞质和核RNA分离试剂盒购自Norgen Biotek公司;DNA纯化回收试剂盒购于Zymo Research公司;无内霉毒素质粒试剂盒购于Omega公司;BCA蛋白定量试剂盒、RIPA裂解液、蛋白酶抑制剂、蛋白marker、超敏ECL化学发光试剂盒(BeyoECL Plus)、PAGE预制胶均购于碧云天公司;DMEM培养基购于武汉博士德公司;聚偏氟乙烯(PVDF)购自Millipore;青(链)霉素、胎牛血清、遗传霉素(G418)和Lipofectamine®3000购于Thermo Fisher公司。基因合成由南京金斯瑞生物科技有限公司完成;引物合成与测序验证由北京擎科新业生物技术有限公司完成。主要仪器有蛋白凝胶电泳仪(Bio-Rad)、紫外分光光度计(NanoDrop 2000,Thermo Fisher)、化学发光成像仪(LAS-4000,GE)、qPCR仪(ABI 7500,Thermo Fisher)等。
1.3 试验方法
1.3.1 3′与5′cDNA末端快速扩增lincRNA-CXCL6的3′和5′末端扩增参照SMARTer RACE Kit(Thermo Fisher)说明书。其3′末端的特异引物3′GSP:5′-TCAGGATGGCAGAGGAGCTCACAGCA-3′。PCR扩增程序:94 ℃ 30 s,68 ℃ 30 s,72 ℃ 2 min,共30个循环。lincRNA-CXCL6的5′末端扩增如下:cDNA第1链先进行dC-tailing,回收纯化后,利用引物5P(5′-AAGCAGTGGTATCAACGCAGAGTAC-GCGGGGGGGGGG-3′)和5′末端的特异引物5′GSP(5′-TCACCCCTGTGGCCTGGATT-CAGTCT-3′)进行扩增。PCR扩增程序:95 ℃ 5 min;95 ℃ 30 s,65 ℃(每个循环降低0.5 ℃)45 s,72 ℃ 50 s,20个循环;95 ℃ 1 min,56 ℃ 45 s,72 ℃ 50 s,20个循环;72 ℃ 5 min。
1.3.2 细胞培养和稳转细胞筛选RAW264.7细胞在含有体积分数为10%胎牛血清和体积分数为1%青链霉素的DMEM培养基中培养,每2 d传代1次。由GenScript公司合成全长的lincRNA-CXCL6,再将其亚克隆到BamHⅠ和EcoRⅠ之间的pcDNA3.1中。将pcDNA3.1和pcDNA3.1-lincRNA-CXCL6表达载体线性化,并使用Lipofectamine 3000转染到RAW264.7细胞中。转染48 h后,将细胞1∶3传代后,加入含500 μg·mL-1G418的全培养基进行筛选。每3 d换1次液,培养14 d左右获得稳定细胞。用PCR分析筛选表达lincRNA-CXCL6和pcDNA3.1的稳转细胞。
1.3.3 反转录与qPCR反转录参照PrimeScriptTMRT Master Mix说明书,取500 ng总RNA进行反转录,生成cDNA。将cDNA用灭菌水稀释3倍,-20 ℃保存。qPCR参照SYBRPremixExTaqTMⅡ说明书。体系如下:10 μL SYBRPremixExTaqⅡ,上、下游引物各0.5 μL,0.4 μL ROX,2 μL cDNA,补水至20 μL。qPCR程序:95 ℃ 2 min;95 ℃ 15 s,60 ℃ 30 s,72 ℃ 30 s,共40个循环。采用2-ΔΔCT法分析数据,以次黄嘌呤鸟嘌呤磷酰基转移酶(HPRT)基因作为内参。引物序列见表1。

表1 本试验的引物序列信息Table 1 Primer sequence information in this study
1.3.4 细胞质和细胞核RNA的提取参照Cytoplasmic & Nuclear RNA Purification Kit(Norgen Biotek)说明,简要步骤如下:用磷酸缓冲盐溶液(PBS)清洗6孔板细胞,然后每孔加入200 μL裂解液,置于冰上 5 min,收集细胞,12 000 r·min-1离心10 min。上清液(包含细胞质RNA)和沉淀(包含细胞核RNA)分别加入200和400 μL buffer SK,分别混匀,再分别加入200 μL无水乙醇,混匀,转入收集管,8 000 r·min-1离心1 min。2管分别加入漂洗液A洗涤后,用洗脱液洗脱,分别得到细胞质RNA和细胞核RNA。
1.3.5 文库构建和转录组测序提取试验组和对照组样品的总RNA,利用Agilent 2 100评估其完整性,选取RNA完整性指数(RIN)大于 9的样品用于测序。利用polyT寡核苷酸的磁珠从总RNA提取polyA+RNA,使用Illumina的NEB Next UltraTMRNA试剂盒构建RNA-seq库并进行高通量测序。测序后,通过除去衔接序列ployN和低质量reads,获取clean reads,用于下游分析。小鼠参考基因组(GRCm38)和Ensemble(Ensemble 97)分别用于reads的比对和基因注释。
1.3.6 差异基因的鉴定利用每千个碱基的转录每百万比对读取的片段(fragments per kilobase per million,FPKM)法来计算基因的表达水平。使用DESeq R软件包对2组基因表达进行差异分析。错误发生率<0.05(false discovery rate,FDR)和log2[倍数变化]≥1设置为差异表达基因的条件。
1.3.7 GO与KEGG分析使用DAVID(Database for Annotation,Visualization and Integrated Discovery)[20]对差异基因进行GO(gene ontotogy)和KEGG(Kyoto encyclopedia of genes and genomes)pathway分析,研究这些差异基因参与的生物学功能。筛选条件选择Count=2,FDR<0.05,富集倍数(fold enrichment)≥1.5。
1.3.8 Western blot分析使用RIPA裂解液于冰上裂解细胞30 min,然后4 ℃、12 000 r·min-1离心 10 min,取上清液,用BCA方法测定蛋白浓度。将30 μg总蛋白进行SDS-PAGE,转移至PVDF。用牛血清白蛋白(BSA)封闭后,将膜与一抗在4 ℃孵育过夜。其中:ERK1/2抗体(p44/42 MAPK兔单抗,CST),1∶1 000;p-ERK1/2 抗体(phospho-p44/42 MAPK,Thr202/Tyr204,CST),1∶2 000;GAPDH抗体(兔单抗,CST),1∶1 000。一抗孵育结束后,用TBST洗3次,二抗[羊抗兔IgG(H+L),HRP conjugate,1∶2 000,Proteintech]室温孵育2 h,然后加ECL试剂进行发光显影,使用ImageQuant LAS 4000系统成像。
1.4 数据统计与分析
2 结果与分析
2.1 lincRNA-CXCL6的基因结构
该lncRNA位于猪第8号染色体上,定位于CXCL8和CXCL6基因之间(图1-A),因而被命名为lincRNA-CXCL6。使用cDNA末端的5′和3′快速扩增,发现lincRNA-CXCL6的5′端长度为473 bp,3′端长度为865 bp(图1-B),总长度为985个核苷酸(nt),其中包含2个外显子和29个poly A(图1-C)。使用开放阅读框查找(ORFfinder)发现,lincRNA-CXCL6并不具有蛋白编码基因超过300 nt的典型阅读框(图1-D)。
2.2 lincRNA-CXCL6的表达模式
LPS和Pam2CSK4刺激猪肺泡巨噬细胞后明显上调了lincRNA-CXCL6的表达(图2-A)。此外,随着LPS刺激时间的增加,lincRNA-CXCL6的表达量也急剧升高,16 h的表达量显著高于0和6 h(图2-B)。利用qPCR检测lincRNA-CXCL6在成年猪组织的表达水平,结果(图2-C)显示,lincRNA-CXCL6仅在肺和肠中有微弱表达,而在其他组织检测不到表达。利用qPCR检测了lincRNA-CXCL6在细胞质和细胞核RNA中的表达分布,结果(图2-D)显示,lincRNA-CXCL6在细胞质和细胞核中均有表达,并且主要表达于细胞质中,作为质控定位于细胞质的核糖体蛋白L30(RPL30)主要表达于细胞质中,而定位于细胞核的核旁斑组装转录本1(NEAT1)主要表达于细胞核中。
2.3 lincRNA-CXCL6在LPS诱导炎症反应中的作用
为了研究lincRNA-CXCL6在调控LPS介导的炎症中的作用,本试验构建了稳转pcDNA3.1(阴性对照组)和pcDNA3.1-lincRNA-CXCL6(试验组)的RAW264.7细胞系。PCR结果(图3-A)显示,在DNA水平上阴性对照和试验组分别整合了pcDNA3.1和pcDNA3.1-lincRNA-CXCL6的序列。RT-qPCR结果(图3-B)显示,相对于阴性对照组,试验组能稳定表达lincRNA-CXCL6。利用LPS刺激阴性对照组和试验组0、2和6 h后,检测炎症因子IL-1β和IL-6mRNA的表达。结果(图4)表明,lincRNA-CXCL6的表达在2和6 h抑制了IL-1β和IL-6mRNA的转录。为了进一步探索lincRNA-CXCL6调控LPS介导炎症反应的机制,对LPS刺激阴性对照和试验组6 h后的RAW264.7细胞进行了转录组测序(RNA-Seq)分析。RNA-Seq的reads数据(表2)显示:与阴性对照组相比,试验组中有104个基因上调,165个基因下调(log2[倍数变化]≥1,FDR<0.05)。进一步分析发现,免疫应答基因(immune response gene,IRG)在104个上调基因中很少见,而明显存在于165个下调基因中,比如炎症基因IL-1β、IL-12β、IL-6和趋化因子CCL5、CXCL16、CCL17。通过 RT-qPCR 验证了RNA-Seq中3个上调的基因(HAP1、HEBP2和FLRT2)和3个下调的基因(IL-12β、CCL17和CCL22)(图5)。
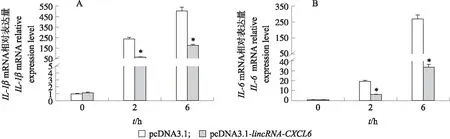
图4 lincRNA-CXCL6对LPS诱导的IL-1β(A)和IL-6(B)mRNA表达的影响Fig.4 Effects of lincRNA-CXCL6 in regulating the mRNA expression of IL-1β(A) and IL-6(B)induced by LPS
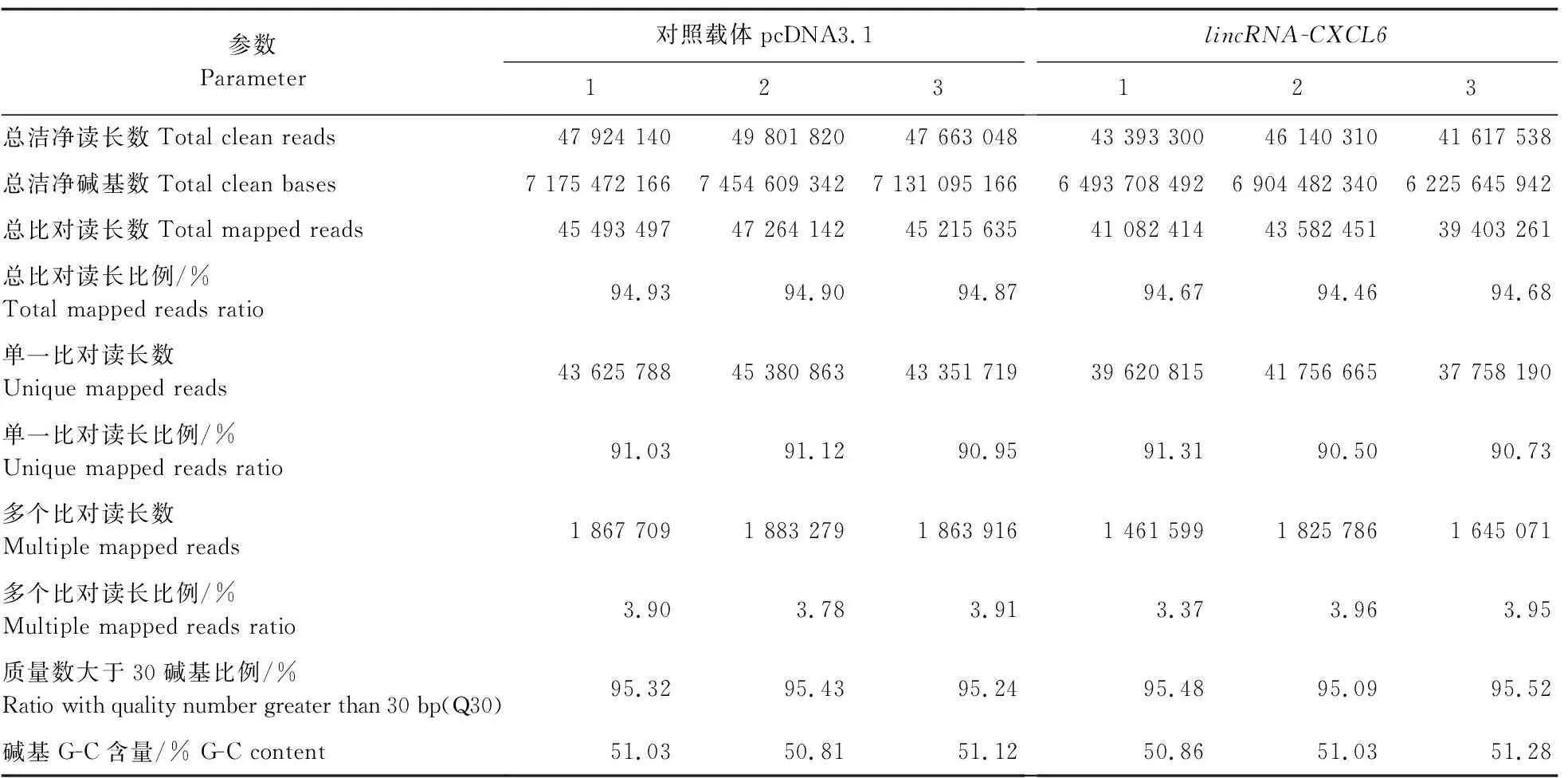
表2 RNA-Seq reads参数Table 2 Parameter of RNA sequencing reads
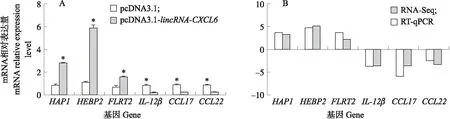
图5 差异表达基因的RT-qPCR验证Fig.5 Validation of differential expressed genes by RT-qPCRA. 差异基因的qPCR验证;B. 测序数据与qPCR结果的比对。A. qPCR verification of differential expressed genes;B. Comparison of sequencing data with qPCR results.
对这些差异基因进行GO分析发现,104个上调的基因在生物过程(BP)中没有明显富集(FDR<0.05,富集倍数≥1.5)。165个下调的基因富集到8个生物学过程(BP),包括炎症反应(17个)、ERK1和ERK2的级联反应(11个)、T细胞增殖的正调控(8个)、细胞对干扰素γ的响应(8个)、细胞对脂多糖的应答(11个)、免疫应答(12个)、中性粒细胞趋化性(7个)和在没有配体的情况下的外在凋亡信号通路(6个)(图6)。

图6 下调差异基因的基因本体(GO)分析Fig.6 Gene ontology(GO)analysis of downregulated differentially expressed genes
2.4 lincRNA-CXCL6调控LPS诱导炎症反应的机制

图8 ERK1/2信号通路对LPS诱导的炎症因子IL-1β和CCL17表达的影响Fig.8 The effect of ERK1/2 pathways in regulation of LPS-induced IL-1β and CCL17 expression level A. LPS刺激对ERK1/2的磷酸化影响;B. ERK1/2抑制剂(U0126)对ERK1/2的磷酸化影响;C. ERK1/2磷酸化抑制剂(U0126)对LPS诱导的IL-1β的表达影响;D. ERK1/2磷酸化抑制剂(U0126)对LPS诱导的CCL17的表达影响。A. Effect of LPS stimulation on phosphorylation of ERK1/2;B. Effect of ERK1/2 inhibitor(U0126)on phosphorylation of ERK1/2;C. Effect of ERK1/2 phosphorylation inhibition(U0126)on the expression of IL-1β induced by LPS;D. Effect of ERK1/2 phosphorylation inhibition(U0126)on the expression of CCL17 induced by LPS.
检测了试验组与阴性对照组在LPS刺激前、后ERK1/2信号通路的激活差异。结果(图7)显示:与阴性对照相比,lincRNA-CXCL6过表达减少了LPS刺激诱导的细胞中ERK1/2的磷酸化(p-ERK1/2)水平。而总ERK1/2蛋白水平在2组中没有差异(GAPDH为内参蛋白)。进一步检验ERK1/2通路是否调控LPS诱导的炎症相关因子的表达。结果表明:LPS刺激细胞15和30 min后,ERK1/2蛋白迅速磷酸化(图8-A),而ERK1/2抑制剂(U0126)则抑制了LPS诱导的ERK1/2磷酸化(图8-B)。我们检测了在抑制ERK1/2信号通路前、后炎症相关因子IL-1β和CCL17的表达量变化。结果表明,LPS刺激后IL-1β和CCL17显著上调,当ERK1/2信号通路被抑制后,IL-1β和CCL17显著下调(图8-C、D)。
3 讨论
本文阐述了猪lincRNA-CXCL6在调节LPS介导的炎症反应中的作用。在静止状态下,猪巨噬细胞中的lincRNA-CXCL6水平相对较低。在LPS刺激下,lincRNA-CXCL6表达在6 h时显著增加,并在16 h达到峰值,这表明lincRNA-CXCL6的表达存在时间依赖性,而且是LPS诱导的lncRNA。本试验结果显示,LPS和Pam2CSK4刺激都可以诱导lincRNA-CXCL6的表达。研究表明,先天性免疫相关的lncRNA可被多种病原体相关分子模式(PAMP)诱导[15]。此外,功能性的lncRNA倾向于在特定组织中表达[21-22]。对于lincRNA-CXCL6,其表达仅在猪的肺和肠组织中检测到,也显示出lincRNA-CXCL6的组织表达特异性。这些结果表明,lincRNA-CXCL6可能参与了先天免疫反应的调控。
LPS是先天性免疫中研究最深入的病原相关分子。它与Toll 样受体4(TLR4)结合并通过释放大量促炎性因子来诱导炎症反应[2,23-24]。本试验结果表明,lincRNA-CXCL6的过表达可以抑制LPS刺激诱导的IL-1β和IL-6表达,说明lincRNA-CXCL6在调节LPS诱导的炎症中发挥作用。在由LPS刺激的试验组和阴性对照组的转录组数据中,lincRNA-CXCL6下调了许多炎症相关因子的表达。对这些下调差异基因GO分析发现,它们显著富集于炎症反应、细胞对脂多糖的应答和免疫反应。这些结果表明lncRNA-CXCL6可通过抑制LPS诱导的炎症相关因子的转录来负调控LPS介导的炎症反应。
本研究进一步发现lincRNA-CXCL6过表达下调的基因中的炎症相关基因显著富集于ERK1和ERK2信号级联反应,因此我们探索lncRNA-CXCL6是否通过ERK1/2途径调节LPS介导的炎症反应。ERK1/2信号传导是丝裂原激活的蛋白激酶(MAPK)途径之一,参与多种细胞过程的调控[25]。在先天性免疫中,ERK1/2的磷酸化可以激活ERK1和ERK2信号级联,并在LPS诱导炎症因子的表达和病毒感染过程中发挥重要作用[26-29]。lincRNA-CXCL6可以抑制LPS刺激后的ERK1/2磷酸化,其过表达抑制了LPS诱导的IL-1β和CCL17表达。此外,抑制ERK1/2磷酸化也降低了炎症相关因子IL-1β和CCL17的表达,表明lincRNA-CXCL6可通过ERK1/2信号通路抑制LPS介导的炎症反应。综上所述,lincRNA-CXCL6可被LPS快速诱导表达,可通过抑制ERK1/2磷酸化来减缓LPS诱导的炎症因子表达,表明其可通过ERK1/2信号通路抑制LPS介导的炎症反应。

