陆地棉E3泛素连接酶基因GhPUB19D的克隆与功能分析
金姝雯,安晓晖,葛冬冬,刘康
(南京农业大学作物遗传与种质创新国家重点实验室/现代作物生产省部共建协同创新中心,江苏 南京210095)
棉花是我国重要的经济作物。在棉花生长发育过程中遭受的各种生物和非生物胁迫会降低棉花的产量和品质。提高棉花耐盐性对于合理规划棉花生产布局,避免粮棉争地和过度依赖灌溉脱盐具有重要意义[1]。棉花黄萎病是一种通过植株根部侵染的土传真菌维管束病害,每年可造成200亿元人民币损失。培育耐盐、抗病棉花品种是最经济有效的途径。泛素-蛋白酶体系统(UPS)是广泛存在于真核生物中的一种蛋白质降解途径,参与调控植物的光形态建成、激素反应以及对逆境胁迫的响应[2]。其中,E3泛素连接酶能特异识别靶蛋白,并将泛素化的蛋白转移到26S蛋白酶体降解,是UPS中决定底物蛋白特异性的关键酶[3-4]。
U-box E3泛素连接酶(PUB)是植物特有的一类E3泛素连接酶[5]。U-box结构域含有约75个高度保守的氨基酸序列,是RING finger结构域的变体[6]。在拟南芥、水稻、大麦的基因组中,根据U-box结构域的位置以及U-box结构域以外其他结构域的结构特点,将PUB蛋白划分为10类亚族[7-9]。目前已有不少PUB被鉴定证实参与植物的非生物胁迫响应:辣椒CaPUB1负调控植株脱水和耐盐性,过表达CaPUB1显著降低干旱胁迫诱导基因RD29a的表达[10];AtPUB30促进降解BKI1从而减弱植株的耐盐性[11];拟南芥pub22和pub23突变体对盐胁迫的耐受性增强,pub22pub23双突变体则表现出加性效应[12];水稻OsPUB15正调节植物对盐度的耐受性,H2O2、盐和干旱胁迫诱导OsPUB15累积,从而增强对这些非生物胁迫的抵御能力[13];TaPUB1可介导盐胁迫负调节因子TaMP的降解,增强转基因烟草的盐胁迫耐受性[14],过表达TaPUB1可以增强转基因植株Na+外排和 K+保持能力,减少H+流入,使细胞质内维持较低的Na+/K+,转TaPUB1基因小麦苗期和开花期耐盐性明显增强,而TaPUB1-RNAi植株对盐胁迫敏感[15]。PUB蛋白在植物的免疫应答中的作用也有报道。PUB22介导病原相关分子模型触发免疫(PTI)所必需的亚基Exo70B2的泛素化和降解[16];PUB12和PUB13泛素化免疫受体FLS2并促进其降解,且pub12和pub13突变体表现出更高的免疫应答[17]。OsSPL11可降解SPIN6,并提高其对稻瘟病和白叶枯病的抗性[18]。在烟草和番茄中,U-box蛋白CMPG1可有效激活由多个抗性基因触发的防御机制[19]。棉花根中的GhPUB17在大丽轮枝菌侵染或外源激素(茉莉酸和水杨酸)处理后显著上调表达,过表达GhPUB17增强植株对病原菌的敏感性,敲除基因植株对大丽轮枝菌的抗性增强[20]。
植物PUB基因功能及其作用机制具有多样性,但是棉花PUB的研究报道较少。本研究鉴定了1个棉花U-box E3泛素连接酶基因GhPUB19D,通过分析其组织表达特征及其对不同非生物胁迫处理的响应,以及VIGS沉默和过表达转基因植株的表型,初步了解GhPUB19D在调控生物和非生物胁迫中的作用。
1 材料与方法
1.1 植物材料与菌株
植物供试材料为陆地棉遗传标准系TM-1和拟南芥哥伦比亚型野生型Col-0。大丽轮枝菌Vd991菌株、大肠杆菌感受态DH5α菌株、根癌农杆菌感受态GV3101菌株、根癌农杆菌感受态EHA105菌株以及亚细胞定位载体pBINPLUS-GFP4、植物过表达载体pBI121-GUS、VIGS载体(pTRV1与pTRV2)均由本实验室保存。
1.2 基因克隆与基因表达分析
棉花总RNA用EASYspin Plus RNA快速提取试剂盒(北京艾德莱)提取,拟南芥总RNA采用TRizol®试剂(Thermo Fisher Scientific公司)提取。提取步骤按产品说明书进行。每个样品取500 ng总RNA用于cDNA合成。以棉花cDNA为模板,PCR扩增GhPUB19DORF全长(引物为:F:ATGATACAAAAGAAATTCAATGAAG,R:CCAAACATGAACTGATTGTTCATTC)。应用7500实时PCR系统(ABI公司)进行qRT-PCR分析,分别以GhACT9(AY305737)和UBQ10作为棉花和拟南芥的内参基因,3个生物学重复,采用2-ΔΔCT法计算基因的相对表达量[21]。
1.3 棉花激素与胁迫处理分析
在MS培养基上培养棉花无菌苗,生长至1周时,分别用200 mg·L-1聚乙二醇PEG-6000和200 mmol·L-1NaCl溶液灌根处理0、1、3、6、12、24、48 h后取样。用0.1 mmol·L-1ABA、2.5 mmol·L-1SA、0.1 mmol·L-1GA3、2.5 mmol·L-1乙烯利(ET)溶液均匀喷洒于棉花叶片表面,分别在处理后0、1、3、6、12、24、48 h取样。所有样品取样后立刻用液氮速冻,保存于-80 ℃冰箱备用。
1.4 病毒介导的基因沉默(VIGS)分析
利用基于烟草脆裂病毒(TRV)的pTRV1和pTRV2载体进行棉花VIGS分析。利用SGN VIGS Tool(http://vigs.solgenomics.net/)设计GhPUB19D基因和阳性对照基因GhCLA1的VIGS干扰序列,通过同源重组分别插入pTRV2载体。将pTRV1、pTRV2、pTRV2:GhCLA1、pTRV2:GhPUB19D载体分别转化到农杆菌GV3101中。将pTRV1与pTRV2或其他插入了基因片段的pTRV2衍生载体按1∶1比例(体积比)混合后注射到棉花子叶下表皮,黑暗中孵育24 h后转移到26 ℃温室中继续生长。
1.5 亚细胞定位
将GhPUB19D全长ORF序列插入pBIN-GFP4质粒构成pBIN-GhPUB19D-GFP融合蛋白表达载体,将其与高尔基体标记的融合蛋白表达载体Man49-RFP分别转化农杆菌后,共同注射到烟草下表皮,置于培养箱中孵育48 h,然后在激光共聚焦荧光显微镜下观察GFP和RFP荧光信号并拍照。
1.6 大丽轮枝菌Vd991的培养、接种以及抗病性鉴定
挑取大丽轮枝菌Vd991的菌丝于含有潮霉素B的Czapek’s液体培养基,25 ℃条件下200 r·min-1培养5~7 d,用4层灭菌纱布过滤后的滤液即为孢子悬浮液。用血球计数板计数孢子数目,用液体Czapek’s培养基稀释至5×106CFU·mL-1。选用5周龄的棉花,用针头在叶节下方1 cm处主茎上刺1个小孔至木质部,再用微量注射器注射2 μL孢子悬浮液到小孔内。接菌21 d后统计发病率和病情指数。选用3周龄拟南芥植株,用水洗去培养基质后,将根系在孢子液中浸泡10 min再移植到灭菌的营养土中。以无菌水代替孢子液接种为对照,每个处理16株,3次生物学重复。接种大丽轮枝菌24 h后取样,通过qRT-PCR分析拟南芥抗病相关基因表达水平;接种大丽轮枝菌12 d时,取同一位置的莲座叶,提取总DNA,采用qPCR定量检测拟南芥莲座叶中真菌DNA含量,扩增引物为:F:5′-CATCAGTCTCTCTGTTTATACCAACG-3′和R:5′-CGATGCGAGCTGTAACTACTACGCAA-3′,3次生物学重复。棉花和拟南芥病情分级标准、发病率和病情指数的计算参照文献[22]的方法。
1.7 拟南芥抗逆性鉴定
将拟南芥种子春化后,点播在含有0、1、5、10 μmol·L-1ABA的1/2 MS培养基。22 ℃光照培养箱中培养12 d,观察拟南芥种子的萌发情况。将4日龄拟南芥移植到营养土中,生长3周后,加入200 mmol·L-1NaCl溶液浸透,1周后拍照观察。每个处理3个生物学重复。
1.8 生物信息学分析
利用BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)查找GhPUB19D同源蛋白,利用 ClustalX 2.0进行多重序列比对,利用MEGA-X10邻接法(Neighbor-Joining)构建系统发育树[23],bootstrap 重复1 000次。利用SeqHunter从陆地棉TM-1参考基因组序列中提取GhPUB19D上游2 000 bp 基因组序列,利用PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)预测顺式调控元件。
2 结果与分析
2.1 GhPUB19D基因克隆及其序列分析
陆地棉基因组中有2个编码PUB19的基因,分别位于A12(Gh_A12G2472)和D12(Gh_D12G2600)染色体上。NCBI公共数据库RNA-seq数据分析结果表明,2个基因均受低温、NaCl、PEG诱导表达。利用RNAseq发现,大丽轮枝菌处理TM-1幼苗可以诱导GhPUB19D(GenBank:XP_040963758)上调表达。为了分析该基因的功能,以cDNA为模板,扩增获得GhPUB19D基因的全长ORF序列,序列长2 043 bp,编码680个氨基酸,预测等电点为8.46,蛋白相对分子质量为75.8×103;含有1个修饰的RING指型U-Box结构域和3个ARM重复(Armadillo repeats)结构域。与其他植物PUB19蛋白序列进行比对,结果显示:陆地棉GhPUB19D与GhPUB19A相似性达99.71%,与亚洲棉GaPUB19、海岛棉GbPUB19、雷蒙德氏棉GrPUB19都高度相似,在系统进化树上聚为一类;与榴莲DzPUB19-like、可可TcPUB19、黄麻CcPUB19相似度在80%左右,这些物种的PUB19聚为另一类;与甜橙CsPUB19-like、杨树PtPUB19、葡萄VvPUB19-like、拟南芥AtPUB19的同源性较低,这些物种的PUB19在系统进化树上归属不同类型(图1-A)。水稻中没有发现与之高度相似的直系同源蛋白。从功能结构域的构成来看,所有的PUB19蛋白都含有1个U-box结构域,但是拟南芥的U-box还含有zf-Nse和zf-RING_UBOX结构域,除甜橙CsPUB19-like外,其他PUB19蛋白都有Arm结构域(图1-B)。

图1 植物PUB19蛋白的进化树与功能结构域分析Fig.1 Phylogenetic tree and function domain of PUB19 in plant A. 利用ClustalX 2.0对12个PUB19蛋白进行多重序列比对,利用MEGA-X10构建系统进化树,分支上的数字为Bootstrap值;B. 利用Pfam分析的功能结构域示意图。A. Multiple sequence alignment of 12 PUB19 proteins was carried out using ClusalX 2.0,and the phylogenetic tree was constructed by MEGA-X10,numbers on branches were indicative of the bootstrap values;B. Schematic diagram of functional domain analyzed by Pfam.
2.2 GhPUB19D表达特征分析
利用PlantCARE对GhPUB19D的上游基因组序列进行顺式调控元件预测,发现在启动子区存在ABA响应元件ABRE、干旱胁迫响应元件MBS、厌氧诱导响应元件ARE、赤霉素反应元件GARE-motif和P-box、低温响应元件LTR、光响应元件(如AE-box、ATCT-motif、Box4和G-box等)以及MYBHv1结合元件CCAAT-box等多种顺式作用元件。因此,GhPUB19D可能参与对激素、环境以及逆境胁迫的响应。
利用qRT-PCR分析GhPUB19D在陆地棉不同组织的相对表达量,发现GhPUB19D在陆地棉根、茎、叶、胚珠中均有表达,在根和叶中表达量较高,而在茎和幼嫩胚珠中的表达量较低(图2)。
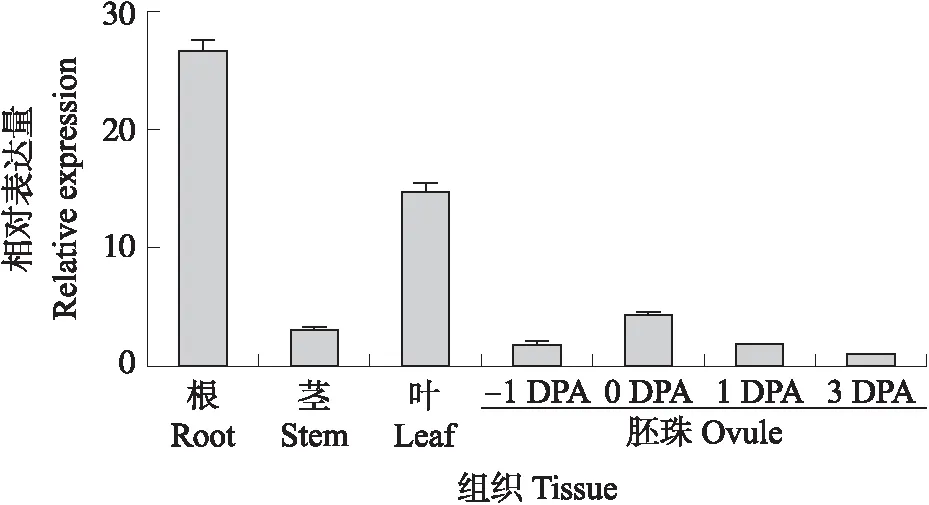
图2 GhPUB19D在陆地棉TM-1不同组织中的表达量Fig.2 GhPUB19D expression level in different tissues of cotton 根、茎、叶采自3叶期棉花植株,-1 DPA、0 DPA、1 DPA、3 DPA胚珠分别采自开花期1 d、开花当天、开花后1 d和3 d花蕾中的完整胚珠(含表皮毛)。Roots,stems and leaves were collected from cotton plants at 3-leaf stage,and -1 DPA,0 DPA,1 DPA and 3 DPA ovules were collected from intact ovules(bearing trichome)in flower buds at 1 day before anthesis,anthesis,1 day and 3 days post-anthesis,respectively.
分析PEG、NaCl、ABA、ET、GA3、SA处理对GhPUB19D表达的影响,发现PEG、NaCl、ABA、ET、GA3处理1 h,GhPUB19D诱导上调表达达到峰值,而SA处理表现为先下调表达,处理后24 h上调表达达到峰值。GhPUB19D的表达对ABA处理最为敏感,处理后1 h其表达上调355倍,NaCl、ET、PEG和GA3分别为62倍、31倍、28倍和22倍,而SA处理24 h后,该基因的表达才达到峰值,为对照的2.7倍(图3)。上述结果表明,GhPUB19D可能参与激素信号的转导,调节植物生长发育以及多种胁迫响应。
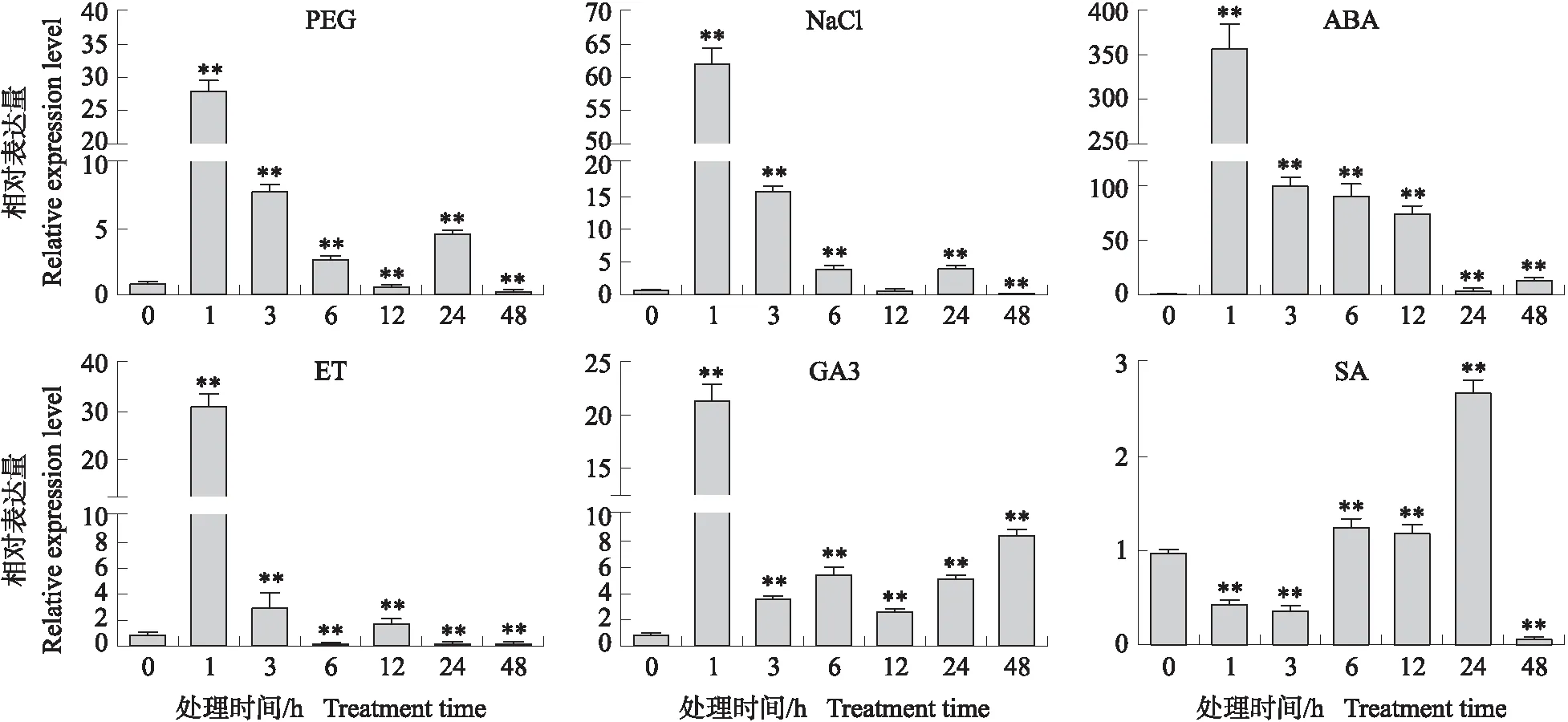
图3 不同非生物胁迫和激素对棉花GhPUB19D表达的影响Fig.3 Effects of different abiotic stresses and hormones on GhPUB19D expression in cotton**P<0.01. The same below.
2.3 GhPUB19D蛋白的亚细胞定位
亚细胞定位结果(图4)显示,GhPUB19D-GFP融合蛋白与高尔基体标记的融合蛋白Man49-RFP高度重合,表明GhPUB19D定位于高尔基体。GhPUB19D可能参与蛋白的加工。

图4 GhPUB19D蛋白在本氏烟草中的亚细胞定位Fig.4 Subcellular localization of GhPUB19D protein in Nicotiana benthamiana A. GhPUB19D-GFP融合蛋白的亚细胞定位;B. Man49-RFP融合蛋白的细胞定位;C. GFP和RFP信号叠加。A. Localization of GhPUB19D-GFP fusion protein in a cell;B. Localization of Man49-RFP fusion protein in a cell;C. Superimposition of GFP and RFP signals.
2.4 VIGS沉默GhPUB19D对棉花黄萎病抗性的影响
U-box决定GhPUB19D的泛素化功能,而Arm结构域在胞内信号转导中起重要作用。为了分析GhPUB19D的生物学功能,我们利用VIGS分别针对GhPUB19D的U-box结构域(TRV2∶GhPUB19D-a)和Arm结构域(TRV2∶GhPUB19D-b)沉默棉花GhPUB19D基因,分析其对表型的影响。将对照和VIGS幼苗接种大丽轮枝菌Vd991孢子21 d后,所有棉花植株均出现黄化和枯萎等黄萎病典型病症,但与对照TRV∶00植株相比,TRV∶GhPUB19D沉默植株病症更为严重(图5-A)。当TRV2∶GhCLA1阳性对照植株出现白化时,qRT-PCR检测发现VIGS沉默植株(TRV∶GhPUB19D-a和TRV∶GhPUB19D-b)中GhPUB19D的mRNA水平均显著低于对照植株(TRV∶00)(图5-B),表明GhPUB19D得到有效沉默。沉默植株发病率和病情指数极显著增加(图5-C、D)。表明VIGS沉默GhPUB19D显著减弱棉花对大丽轮枝菌Vd991的抗性,因此GhPUB19D是陆地棉抗黄萎病所必需的。
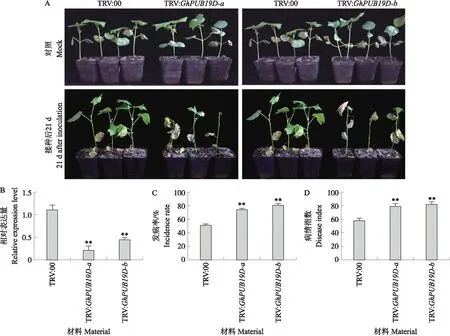
图5 病毒诱导沉默GhPUB19D对棉花抗黄萎病的影响Fig.5 Effect of virus-induced silencing GhPUB19D on Verticillium wilt resistance of cotton A. 大丽轮枝菌Vd991侵染棉花21 d后的症状;B. qRT-PCR分析棉花植株中GhPUB19D的转录水平;C. Vd991侵染21 d后棉花黄萎病发病率;D. Vd991侵染21 d后棉花黄萎病病情指数。A. Symptoms of cotton plants at 21 d after inoculation with V.dahliae Vd991;B. The transcript levels of GhPUB19D in cotton analyzed using qRT-PCR;C. The incidence of Verticillium wilt disease at 21 d;D. Disease index Verticillium wilt disease at 21 d.
2.5 转GhPUB19D基因拟南芥的ABA敏感性鉴定
将CaMV 35S启动子驱动的GhPUB19D,通过农杆菌泡花法导入拟南芥,获得7株阳性苗。从中挑选2个GhPUB19D基因表达水平较高的株系。为了分析GhPUB19D对种子萌发及其ABA敏感性的影响,分别将拟南芥种子置于含有0、1、5和10 μmol·L-1ABA的1/2 MS培养基上进行发芽试验。1 μmol·L-1ABA对种子的萌发率没有显著影响,随着ABA浓度的增加,野生型拟南芥(WT)和转基因拟南芥种子的发芽率均降低,但转基因拟南芥的发芽率显著高于野生型拟南芥(图6-A、B)。以上结果表明,转GhPUB19D显著降低ABA对拟南芥种子萌发的抑制作用。
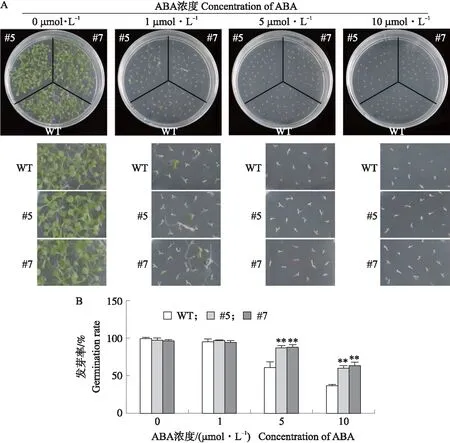
图6 转GhPUB19D基因对拟南芥种子萌发及其对ABA敏感性的影响Fig.6 Effects of transgenic GhPUB19D on Arabidopsis seed germination and sensitivity to ABAA. 不同浓度ABA处理对拟南芥种子萌发的影响;B. 不同浓度ABA处理后拟南芥种子的发芽率。A. Effects of ABA treatment on seed germination of Arabidopsis;B. Germination rate of Arabidopsis seeds treated with different concentrations of ABA.
2.6 转GhPUB19D基因拟南芥的耐盐性鉴定
以200 mmol·L-1NaCl处理3周的拟南芥幼苗,盐胁迫7 d后,拟南芥植株叶片发生黄化和枯萎等盐害症状。与WT相比,GhPUB19D转基因拟南芥株系症状相对较弱,其中GhPUB19D表达水平最高的5#株系最轻(图7-A、B)。盐胁迫下转基因拟南芥的莲座叶叶面积显著大于WT(图7-C)。说明GhPUB19D能够增强拟南芥幼苗期的耐盐性。

图7 转GhPUB19D基因对拟南芥苗期耐盐性的影响Fig.7 Effect of transgenic GhPUB19D on the salt tolerance of Arabidopsis seedlings A. 盐胁迫下拟南芥植株的表型;B. 盐胁迫下拟南芥莲座叶的比较;C. 盐处理拟南芥莲座叶叶面积。A. Phenotype of Arabidopsis in salt stress;B. Comparison of Arabidopsis rosette leaves in stress;C. The rosette leaf areas of Arabidopsis under salt treatment. *P<0.05. The same below.
利用qRT-PCR分析转GhPUB19D基因对拟南芥AtRD26、AtABF1、AtABF3、AtABF4、AtSLAH3、AtRAB18、AtMYB44这7个与ABA信号转导和胁迫响应相关基因表达的影响。结果(图8)表明,7个基因的表达量在未经盐胁迫处理的WT和转基因拟南芥中均没有显著差异。200 mmol·L-1NaCl处理后,AtABF1和AtRAB18在WT和转基因拟南芥中均显著上调表达,但在转基因拟南芥中的表达水平显著低于WT;AtABF3和AtABF4只在盐胁迫的转基因拟南芥中显著上调表达;AtRD26和AtSLAH3只在盐胁迫的WT中显著上调表达;AtMYB44则在盐胁迫的转基因拟南芥中显著下调表达。转GhPUB19D基因提高了ABA信号通路中SnRK2.3/2.6下游的AtABF3和AtABF4对盐胁迫的响应,钝化或削弱了由渗透胁迫强烈诱导的ABA信号转导的正调节因子AtRD26和AtMYB44、响应干旱胁迫的AtRAB18以及S型阴离子通道蛋白SLAH3对盐胁迫的响应。
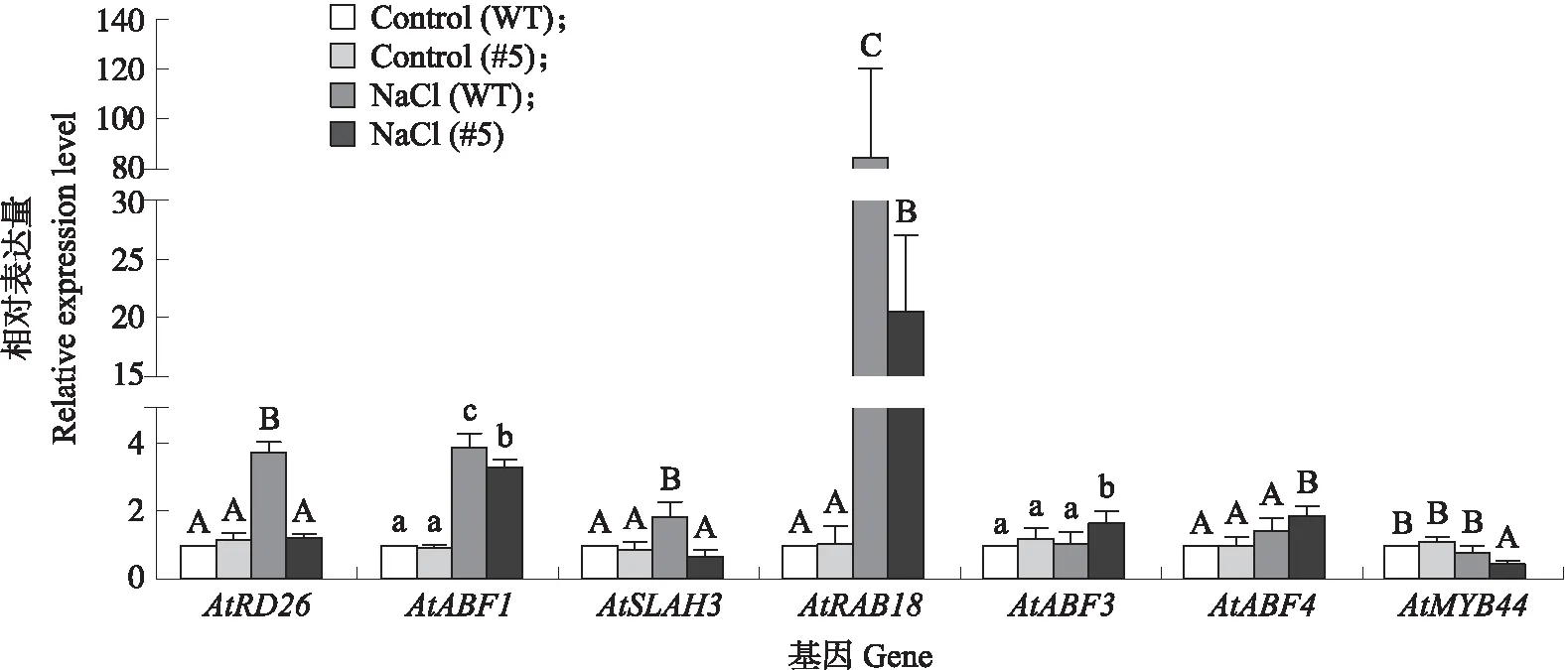
图8 转GhPUB19D基因对拟南芥盐胁迫相关基因表达的影响Fig.8 Effect of transgenic GhPUB19D on the expression of salt stress related genes in Arabidopsis plants不同大、小写字母表示在0.01和0.05水平差异显著。下同。Different capital and small letters represent significant difference at 0.01 and 0.05 levels. The same below.
2.7 转GhPUB19D基因拟南芥的抗病性鉴定
采用蘸根法对3周龄拟南芥幼苗定量接种大丽轮枝菌Vd991的孢子。接菌12 d后,WT出现叶片黄化、枯萎、萎蔫等黄萎病病症,与WT相比,GhPUB19D转基因拟南芥病症相对较弱(图9-A),植株中真菌DNA相对含量显著低于对照(图9-B)。说明转GhPUB19D基因能显著增强拟南芥幼苗对大丽轮枝菌抗性。
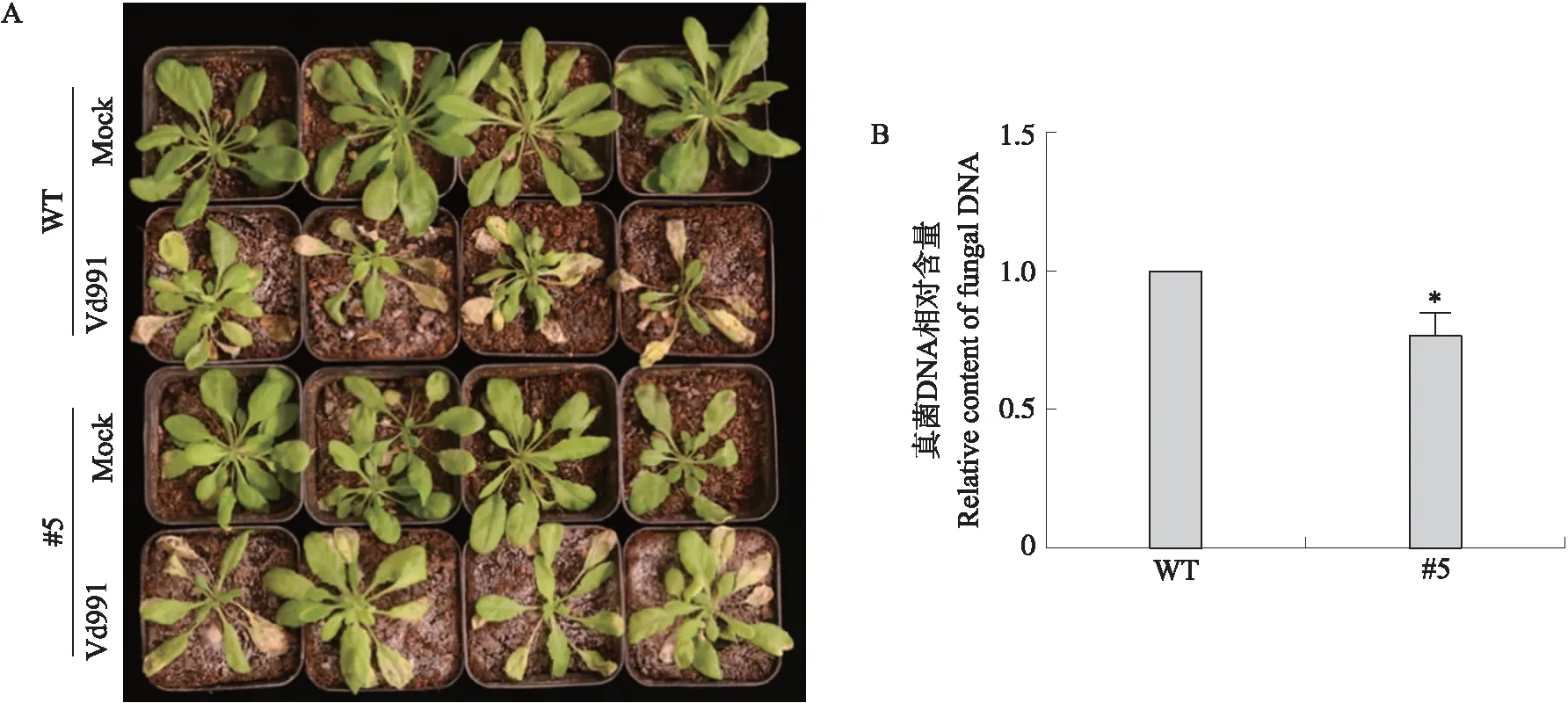
图9 转GhPUB19D基因拟南芥对大丽轮枝菌Vd991抗性的影响Fig.9 Effect of transgenic GhPUB19D Arabidopsis on the resistance to V.dahliae A. 接种大丽轮枝菌Vd991孢子12 d的拟南芥幼苗;B. 接种大丽轮枝菌Vd991孢子12 d拟南芥植株中大丽轮枝菌含量。A. Seedlings of Arabidopsis at 12 d after inoculation with V.dahliae Vd991;B. The content of V.dahliae in Arabidopsis plants at 12 d after inoculation with V.dahliae Vd991.
为了分析转GhPUB19D基因提高拟南芥抗病性的分子机制,利用qRT-PCR分析AtPR1、AtPR2、AtPR3、AtPR4、AtPR5、AtNPR1这6个与系统获得抗性(SAR)信号通路相关基因的表达量。结果(图10)表明:无论是否接种Vd991,转基因GhPUB19D拟南芥AtPR1、AtPR2、AtPR3、AtPR5、AtNPR1的表达量均高于WT。接种大丽轮枝菌转基因拟南芥中AtPR2、AtPR3、AtPR4和AtNPR1的表达量分别上调16.4、30.4、20.4、3.19倍。可见,GhPUB19D可以调节水杨酸(AtPR2、AtNPR1)和乙烯/茉莉酸(AtPR3、AtPR4)信号通路,提高对黄萎病的抗性。
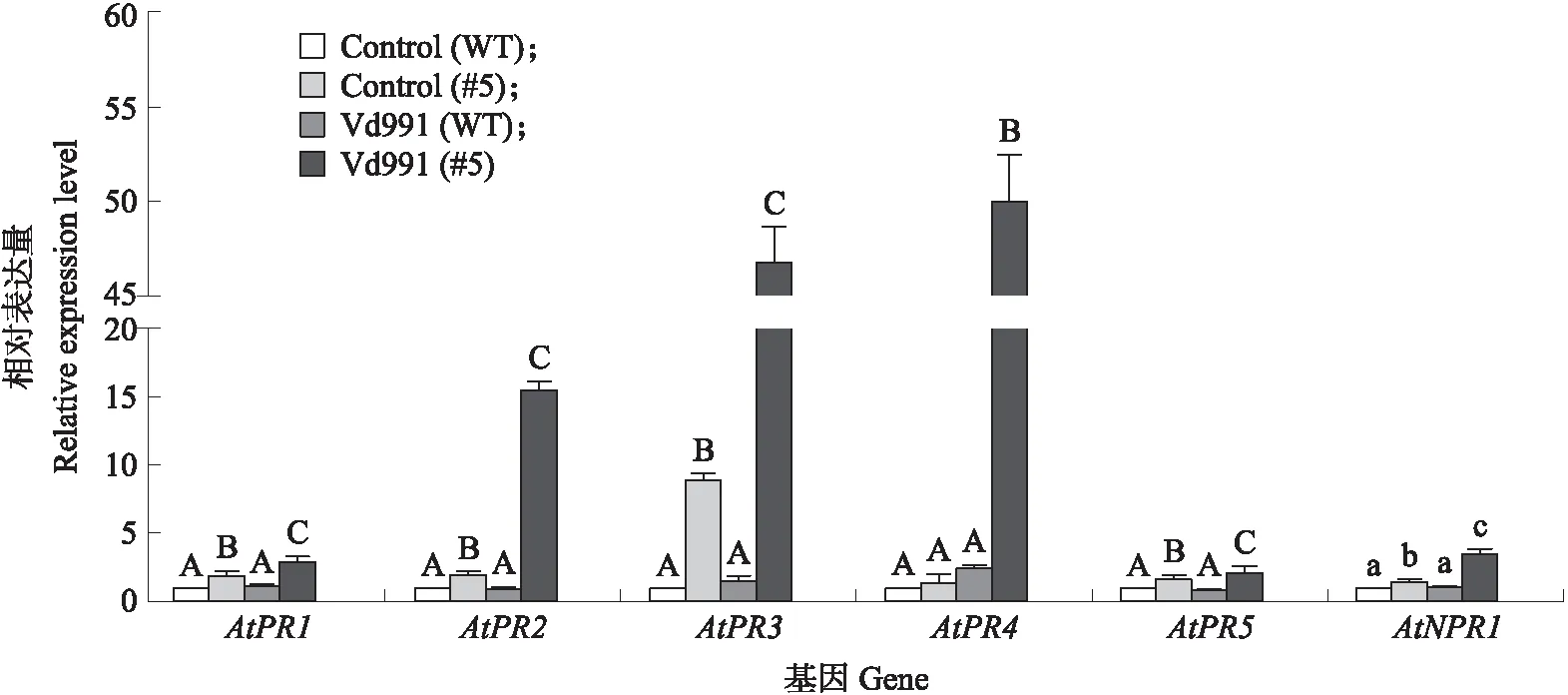
图10 转GhPUB19D基因对拟南芥抗病相关基因表达的影响Fig.10 Effect of trasgenic GhPUB19D on the expression of resistance-related genes in Arabidopsis plants
3 讨论
植物U-box蛋白在植物生长发育、逆境胁迫应答和抗病过程中均发挥着重要作用[24]。U-box结构域是植物U-box E3泛素连接酶(PUB)的特征结构域,含有约75个高度保守的氨基酸序列。拟南芥基因组编码64个含有U-box的蛋白,其中含ARM结构域的蛋白有41个[25];棉花基因组中有185个蛋白含有 U-box,其中78个有ARM结构域,占42%[26],数目比拟南芥多。说明棉花有更为复杂的U-box/ARM基因家族参与调控棉花的生长发育和逆境响应。已有报道证明GhPUB17负调控棉花对大丽轮枝菌的抗性[20]。但尚未见有关其他棉花PUB基因的研究报道。本研究从陆地棉中分离鉴定了1个U-box E3泛素连接酶基因GhPUB19D,该基因上游启动子区存在多种逆境胁迫响应顺式作用元件,NaCl、PEG、ABA、GA3、ET均能诱导该基因迅速上调表达,对ABA尤为敏感,对SA响应较慢且上调表达的倍数最低。转GhPUB19D基因降低拟南芥萌发期对ABA的敏感性,表明GhPUB19D在种子萌发过程中作为ABA信号的负调控因子。转GhPUB19D基因对ABA抑制植物的生长效应没有影响,但是可以提高拟南芥的耐盐性。研究表明,拟南芥PUB18或者PUB19的单突变体对ABA或者NaCl的响应与WT没有差异,而pub18pub19双突变体对ABA和NaCl的敏感性都显著降低[27],本研究结论与之相反。但是,也有PUB正向调节植物耐盐性的报道:盐胁迫下TaPUB1过表达会导致转基因植株中的渗透调节物质如脯氨酸、可溶性糖积累,减轻盐胁迫的危害[14];转OsPUB15拟南芥在盐处理下生长比野生型植株更快,到后期野生型植株已经严重萎蔫时,转基因拟南芥生长依旧正常[13]。可见不同植物的不同PUB蛋白质的结构、功能和分子调节功能与机制具有多样性。转GhPUB19D基因使ABA信号通路中SnRK2.3/2.6下游的AtABF3和AtABF4对盐胁迫的响应增强,而渗透胁迫诱导的ABA信号转导的正调节因子AtRD26[1]和AtMYB44、干旱胁迫的AtRAB18[12]以及S型阴离子通道蛋白SLAH3对盐胁迫的响应被削弱[28]。可见,GhPUB19D可通过ABA信号调节对非生物胁迫的反应。
很多PUB蛋白被证明在植物的免疫应答过程中起重要的调控作用。例如:PUB12与PUB13通过共受体BAK1招募来泛素化降解FLS2,最终导致PUB12和PUB3负调控鞭毛蛋白-FLS2引起的PTI抗性反应。pub22pub23pub24三突变体由鞭毛蛋白、几丁质和elf18等引起的PTI反应明显增强,PUB22、PUB23和PUB24负调控植物的免疫反应[24]。棉花GhPUB17对棉花黄萎病抗性也起负调控作用[20]。本研究中,VIGS沉默GhPUB19D使棉花黄萎病发病率和病情指数极显著增加,而转GhPUB19D基因则显著减轻拟南芥黄萎病病症并显著降低植株体内真菌DNA相对含量。转GhPUB19D可以提高AtPR1、AtPR2、AtPR3、AtPR5、AtNPR1的表达量,而接种大丽轮枝菌可诱导转基因拟南芥中与乙烯/茉莉酸信号相关的AtPR3、AtPR4过量表达20倍以上,同时也可以使与水杨酸信号相关的AtPR2、AtNPR1大幅上调表达,不符合典型的茉莉酸-水杨酸拮抗关系[29],但对乙烯/茉莉酸通路的基因表达调控作用更大。
本研究发现GhPUB19D可以通过调节ABA信号提高植物耐盐性,而通过乙烯/茉莉酸信号通路能调节植物对黄萎病的抗性。由于GhPUB19D是一种E3泛素连接酶,研究GhPUB19D如何通过U-box和ARM与其他蛋白相互作用,是进一步阐述其作用分子机制的关键。

