植物开花素FT的功能及其表观调控机制的研究进展
蒋甲福,杨一曼,王琦,陈素梅,陈发棣
(南京农业大学园艺学院/农业农村部景观农业重点实验室,江苏 南京 210095)
开花是高等植物生活史中的一个重要环节,包括花芽分化、发育及开放等过程。花期早晚对于植物能否在合适环境条件下完成生活史具有重要意义,同时花期对于观赏植物的周年生产及应时供应亦十分重要。开花是一个受多基因精细调控的过程,光照、温度、植物激素等多种因子参与这一调控过程[1]。
生物学家在菊花中观察到一类光周期诱导后在叶片产生并运输到茎顶端的开花刺激物,命名为开花素(florigen)[2]。后来,这种开花素被确认是FLOWERINGLOCUST(FT)基因的产物[3]。FT基因是叶片中开花途径的汇集点,它可以整合不同开花途径的信号,FT蛋白运输到茎尖后与CbZIP转录因子FD形成复合物以诱导花器官决定基因如APETALA1(AP1)和FRUITFULL(FUL)的表达,在植物成花转变和花发育过程中发挥着重要作用[1]。除了开花功能,FT还参与其他发育进程。为此,本文总结了近年来FT的功能和表观调控机制的研究进展,以期为深入研究FT提供参考。
1 FT的功能
1.1 成花转变
FT的主要功能是促进植物开花。尽管开花素很早就已经被提出[2],但直到十几年前在模式双子叶植物拟南芥[4]和单子叶植物水稻[5]中才分别确认这种开花素蛋白是由FT基因编码的,并通过长距离运输至茎尖以完成成花转变过程,在南瓜中也鉴定到FT蛋白从叶片到茎尖的运输[6]。在其他作物中也鉴定到FT的同源基因,如小麦和大麦的VRN3[7]、玉米的ZCN8[8],大豆中则有多个成员如GmFT2a和GmFT5a[9]及GmFT2b[10]。在园艺作物中也鉴定到FT的同源基因具有促进开花的功能,如从野菊(Chrysanthemumseticuspe)中克隆了FT的同源基因CsFTL3,并验证了其开花素功能[11];菊花CmFTL1可能是长日照下开花素同源基因[12-13];另一个同源基因CmFTL2也具有开花素的功能[14];还有春兰的CgFT[15]、蝴蝶兰的PhFT-1[16]和玫瑰的RoFT[17]等;蔬菜作物如荠菜的BjuFT[18]和番茄的SlSP3D[19]等;果树作物如苹果的MdFT1和MdFT2[20]、葡萄的VvFT[21]和梨的PcFT2[22]等。但随着植物物种研究种类的增加,研究人员发现FT的同源基因功能并不完全保守,一些关键氨基酸位点的突变导致其成为开花抑制基因,这主要是由于FT和TFL1基因编码的蛋白都属于PEBP家族成员,它们在构象上存在微小差异,导致它们在植物体内行使着相反的功能:FT-like往往起到促进开花的作用而TFL1-like则使花芽分化受到抑制[23]。研究表明,至少4个氨基酸位点的变化足以将FT转变成TFL1所具有的功能,分别是109位Glu、138位Trp、140位Gln和152位Asn[23]。通过蛋白构象解析,发现蛋白质四级结构中,FT第85位的酪氨酸(Tyr)和第140位的谷氨酰胺(Gln)能够形成1个特殊的loop环状结构,而TFL1蛋白第88位带氢键的组氨酸(His)与第144位的天冬氨酸(Asp)则构成了天然屏障,不能形成loop环状结构,从而导致FT与TFL1亚家族成员具有相反的功能[24]。Hanzawa等[25]的研究表明,只要改变拟南芥TFL1蛋白的1个氨基酸,就可以将TFL1转变为开花素基因,反之亦然。菊花CmFTL3中1个氨基酸的改变也会导致其开花功能的丧失[26]。这在其他作物中也有发现,如郁金香中的TgFT1[27]、矮牵牛中的PhFT1[28]、番茄中的SlSP5G[19]、龙眼中的DlFT1[29]以及甜菜中的BvFT1[30]等都具有抑制开花的功能。
1.2 花发育
FT在维持花序分生组织的稳定性方面也有重要作用。Melzer等[31]在拟南芥soc1-3ful-2突变体中超表达FT,发现转基因植株不仅晚花,开花时主花序变短,共生花序变少且及早停止发育,导致转基因植株的花序分生组织更多地逆转成顶生莲座叶,且重复该过程,导致大量的莲座叶分生组织产生并保持营养生长达几个月,说明在soc1-3ful-2突变体中超表达开花素基因FT并不能导致成花转变,反而导致长期的营养生长和明显的营养发育表型,表明FT基因的确不仅与控制成花转变有关,而且与花序发育也有关。进一步研究发现,成花转变后,FT在茎生叶、萼片和发育的果荚中的高表达,对维持花序分生组织稳定性非常重要[32]。拟南芥在生长发育过程中,根据茎尖分生组织产生的形态器官不同,划分为3个阶段:营养生长阶段(V)形成莲座叶;成花阶段(I1)生成伸长的茎、茎生叶和腋生侧枝;只生成花而没有茎生叶和腋生侧枝的花发育阶段则称为I2阶段。有研究发现,多梳蛋白(PcG)的双突变体emf2-10vrn2-1从长日照转到短日照,会在I2阶段后回复到I1阶段,这是由于短日照下emf2-10vrn2-1中FT在花梗中不表达造成的,而与叶片中FT无关,表明PcG复合体对维持花分生组织特征非常重要[33]。菊花现蕾后将其转到长日照条件超过2周,菊花叶片中高表达的CmFTL3则会在长日照条件下迅速被抑制,花蕾停止发育而形成僵花;当以CmFTL3超表达转基因植株为砧木,非转基因菊花为接穗进行嫁接时,并将接穗的叶片全部去除以防止长日照条件下产生抑制开花的物质(如反花素基因AFT),嫁接苗在长日照条件下也只能完成成花转变,发育到现蕾阶段就停止发育而不能开花[11]。这暗示转基因菊花叶片中FTL3负责成花转变,而接穗其他组织(如茎)中表达的FTL3,对于花蕾的继续发育和开放发挥着重要作用。FT调控花序发育的功能在其他作物中也存在,如波罗和紫苏[34]。番茄中FT同源基因SINGLEFLOWERTRUSS(SFT)功能丧失,也会导致花序转为营养生长或转变为单生花,并产生叶状的萼片[35]。
1.3 FT的其他功能
FT除了调控植物开花和花发育,还参与植物的其他过程。Navarro等[36]把水稻的FT同源基因Hd3a在马铃薯中超表达,发现转基因植株与野生型相比很容易长出块茎,内源基因StSP6A也具有类似功能,说明FT促进块茎的形成;草莓FT1则促进走茎形成[37]。在杨树中超表达PtFT2可以促进休眠芽的萌动[38];FT也参与种子休眠的打破[39];在拟南芥中FT通过与FD互作结合在FLC基因的启动子区从而促进休眠种子的萌发[40]。FT还可以通过与BRC1(BRANCHED1)互作抑制侧枝的形成,相反BRC1通过抑制FT的活性以防止未长出的侧枝过早开花[41]。研究还表明,过表达FT可以促进气孔开放,而突变体则导致气孔关闭,说明FT参与气孔的开放调节[42];近期发现该过程与FT调控的SOC1表达及H3K4me3表观修饰有关[43]。
2 FT表达的表观调控
染色质修饰和DNA甲基化是动、植物中调控表观遗传的主要方式,其通过响应各种环境信号以建立和维持这种修饰,从而影响转录复合体能否接近目的基因,进而调控基因的表达以适应环境的变化[44],特别是PcG复合体在调控组蛋白H3修饰方面起着关键作用[45]。植物的开花时间依赖FT在叶片韧皮部伴胞中精确的时空表达调控[46],然而这种调控尚不明确。PcG复合体中的基因突变后都会导致FT抑制的解除,如embryonicflower2(emf2)和emf1、curlyleaf(clf)、multicopysuppressorofira1(msi1)和like-heterochromatinprotein1(lhp1),从而导致突变体植株在长、短日照下都提前开花[47-48]。主要原因是它们形成的蛋白复合体在靶基因的染色质区域发生了H3K27me3修饰[49]。与拟南芥中其他PcG靶基因不同,拟南芥FT基因的启动子、编码区及其下游区域都会发生H3K27me3修饰[50]。FT启动子近端Block A区域可被节律钟调控的转录因子CYCLING DOF FACTOR(CDF)、TEMPRANILLO(TEM)结合以抑制FT的转录,CRYPTOCHROME-INTERACTING BASIC-HELIX-LOOP HELIX(CIB)结合在富含蓝光条件下诱导FT的表达,SHORT VEGETATIVE PHASE(SVP)在低温下会抑制FT的表达,PHYTOCHROME INTERACTING FACTOR 4(PIF4)在高温下诱导FT的表达,CONSTANS(CO)响应光周期的变化促进FT的表达;而MADS转录因子FLOWERING LOCUS C(FLC)、SVP、FLOWERING LOCUS M(FLM)和MADS AFFECTING FLOWERING(MAF)在低温下或春化前通过结合FT的第1个内含子抑制其转录,AP2转录因子TARGET OF EAT 1(TOE1)、TOE2、CHAFLMüTZE(SMZ)和SCHNARCHZAPFEN(SNZ)在光周期开花路径通过结合 3′UTR 附近的区域抑制其表达(图1)[34]。
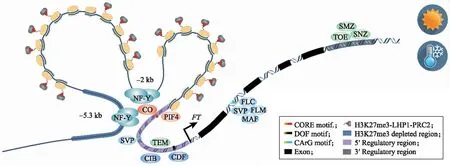
图1 各种转录因子、组蛋白H3修饰和染色体构象协同调控拟南芥FT基因的表达[34]Fig.1 Transcriptional regulation of the FT gene by transcript factors,Histone H3 modification and chromation remodeling synergeticly[34] CORE motif:CCACA box motif;DOF motif:[A/T]AAAG box motif;CArG motif:CC(A/T)6GG box motif;H3K27me3-LHP1-PRC2:Like-heterochromatin protein1(LHP1)and polycomb repressive complex 2(PRC2)produced H3K27me3.
CO作为调控FT表达的重要转录因子,在其他物种中其同源基因也具有类似的功能。如月季RcCO和RcCOL4[51]、菊花CmBBX8[13]和甜菜BvBBX19[52]。然而这些调控区域通常会被LHP1-PRC2进行H3K27me3修饰,很难被转录因子结合,只有FT启动子区的远端Block C区域不能被H3K27me3修饰,染色质呈开放的状态[53]。原因是结合Block C区域的NUCLEAR FACTOR Y C(NF-YC)转录因子与组蛋白H3甲基转移酶(CLF)互作后,拮抗后者结合在启动子区的染色质上,避免产生H3K27me3,进而促进FT的转录[54]。一旦NF-Y结合到Block C区域,就会招募CO,从而使LHP1从启动子区脱离,此时染色质Block A区域和Block C区域互作,这种互作依赖启动子区形成染色质环(chromatin loop)[55]。有充分的遗传证据表明,LHP1从启动子区之所以脱离,是因为CO调控的FT上调与染色质修饰因子有关,CO会与H3K36me3识别蛋白MRG1/MRG2-HAM1/HAM2互作,后者调控组蛋白H3K36me/H3K4me及乙酰化修饰[56-57]。有研究发现LHP1除了作为PcG复合体成员识别H3K27me3外,还具有调控染色质拓扑结构以控制基因的转录,说明LHP1在染色质初级到高级结构层面都发挥着重要作用,以精确调控基因的表达[58]。拟南芥的染色质重塑复合体SWR1的重要成分SWC4,也具有抑制FT基因表达的功能[59],染色质重塑因子PICKLE(PKL)与CO互作促进CO在黄昏时结合FT的启动子区来激活FT转录[60]。PKL和COMPASS蛋白ATX1能够相互作用,介导FT位点H3K4的三甲基化,从而拮抗PcG蛋白对FT表达的抑制作用[61]。说明染色体构象对于FT的表达调控也具有重要作用[34]。
FT表达在长日照下具有节律性,在拟南芥和水稻中发现PcG蛋白在黄昏和夜间抑制FT的表达,且与B3结构域转录因子VAL1识别RY基序有关,VAL1将PcG蛋白LHP1和MSI1募集到FT染色质区域导致H3K27me3水平上升[62]。同时,JMJ14(PKDM7B)负责擦除具有促进FT表达的组蛋白H3K4me3修饰[63],JMJ14可以作为PcG复合体即EMF1c的组分,抑制夜晚FT的表达[64]。这样,H3K4me3与H3K27me3通过相互拮抗,在调控FT正常表达过程中起重要作用[65];正是因为这种拮抗作用,继续进行长日照处理,FT的表达并不会升高,与第1天长日照诱导表达的水平基本一致[66]。短日照培养24 d的拟南芥,给予1个长日照周期(1 d)处理,然后再转至短日照条件下,拟南芥的开花时间即可显著提前,暗示一次长日照处理就诱导出足以完成开花的FT[66]。这是由于叶中FT诱导花分生组织相关基因表达后,尽管叶中FT不再表达,但PcG复合体可继续维持FT基因在花梗中表达以完成开花和花发育[33]。在短日照植物牵牛花中,1个短日照周期也足以诱导出完成花芽分化和花发育的PnFT表达量[67-68]。与拟南芥和牵牛花不同,在菊花中长期的短日照才能使菊花完成成花转变而现蕾,在此过程中成熟叶片中FT的表达量会逐渐升高并维持到现蕾,暗示菊花开花需要FT表达量达到一定的阈值[14];在菊花野生二倍体材料C.seticuspe[69]和甘菊(C.lavandulifolium)中也有类似的发现[70]。光周期诱导的FT表达剂量效应在其他重要作物中也存在,如早熟禾亚科的二穗短柄草、小麦和大麦等的FT2[71]以及无花果FcFT1[72]、杨树PtFT1[38]、日本山毛榉(Faguscrenata)FcFT[73]等,但这种效应至今没有合理的解释,机制仍不清楚。
在DNA甲基化修饰调控FT表达研究方面,通过构建1个反向重复(inverted repeats,IR)序列来诱导BlockC区域的DNA甲基化,以期FT下调表达,延迟开花。BlockC位于FT转录起始位点上游5 kb处,是1个转录增强子。研究人员发现除了IR介导的DNA甲基化发生在BlockC区域外,还鉴定到1个新的增强子BlockE也发生了甲基化修饰,它位于FT基因下游1 kb处,且与组蛋白H3K9me2修饰相关[74]。但在非人工介导条件下,还没有发现FT基因区域可以发生DNA甲基化修饰。另外,在FT转录后调控方面,二穗短柄草在短日照条件下miR5200上调表达会导致FT下调,从而使花期推迟[75];另外,研究还发现在二穗短柄草中FT2可变剪切翻译的蛋白FT2β与FT1互作,干扰FT1与FD的互作从而推迟开花[71];而FT在mRNA水平上受m6A修饰调控还未见报道。
3 展望
FT在植物开花及其他发育进程中扮演着重要角色,但具体的调控机制还不清楚,尽管在拟南芥上的研究表明其可能是通过FD转录因子来实现的[76],但这种机制在其他物种中是否保守,仍未可知。FT需要从叶片运输到茎尖来发挥作用,但FT蛋白是如何从伴胞运输到其他细胞的,值得进一步研究[77]。在调控FT表达方面,除了受光周期调节,FT的表达还受温度和营养成分的调节。如BvFT1参与甜菜的春化响应过程[30],高温下菊花CmFTL3表达被显著抑制,导致开花推迟[69];而在郁金香[78]和水仙[79]的鳞茎中FT则受高温的诱导表达。另外,氮作为植物生长和作物产量的限制养分,FT介导了氮素调控开花过程[80-81],但对调控机制的了解还不深入。
尽管FT的表观调控在拟南芥中已经比较明确,但最新的研究表明,lncRNA(long non-coding RNA)、组蛋白和DNA修饰、染色重塑复合体和转录因子都参与基因组三维构象的结构调节,影响基因的表达[82-83]。因此,在研究FT基因表达调控时,需要整合多种技术和手段,才能全面了解染色质结构的动态变化,从而揭示FT基因表达变化和性状的关系。

