木霉生物育苗基质中功能菌数量对辣椒促生效应的影响
李瑞敏,商美妮,李荣,刘红军,王其传,吴亚胜,沈宗专*,沈标,沈其荣
(1.南京农业大学资源与环境科学学院/江苏省固体有机废弃物资源化研究重点实验室/江苏省有机固体废弃物协同创新中心/作物免疫学重点实验室,江苏 南京 210095;2.淮安柴米河农业科技发展有限公司,江苏 淮安 223001)
随着农业现代化的发展,工厂化育苗已经成为现代农业,尤其是设施蔬菜产业高效发展的重要保障措施之一[1]。工厂化育苗不仅能够节约用种,提高复种指数,缩短田间生长期,还能有效防治病虫害,便于集中管理,培育健壮幼苗,是提高农业生产综合效益的关键措施之一[2]。育苗基质的开发成为工厂化育苗产业中最为关键的环节之一,其不仅能够节水省肥、提高作物产量,还具有清洁省工的优点[3]。随着微生物技术的不断发展,向基质中添加生物菌剂研制相应生物育苗基质的研究日益增多[4]。生物育苗基质因生物功能菌的作用可增强植物吸收养分的能力、促进种苗的生长及抗逆能力,对基质产业的发展具有重要意义[4-5]。
近年来生物育苗基质产业发展迅速,但对于基质中功能菌的含量尚未有相关的国家或行业标准。目前有关生物育苗基质的研究多侧重于基质中功能菌种的筛选以及某一接种量下其对所育种苗生物量的影响[6-7],而对功能菌不同接种量下育苗效应的研究相对较少。此外,功能菌的添加量还直接与企业的成本密切相关,因此,统筹生物育苗基质生产成本与实际促生应用效果对于生物育苗基质产业的可持续发展具有重要的意义。生物育苗基质培育的种苗具有出苗整齐、病虫害轻、苗壮、根系发达等优势[8],移栽至田间后可显著促进辣椒产量的增加[9]。然而,含不同数量级功能菌的生物育苗基质所育种苗移栽至田间后的促生效应尚未有相关研究。
木霉是一种广泛存在于自然界且具有重要的植物促生及抗逆潜能的真菌,其对作物的生长发育和产量的提高有显著的促生作用[10-11]。木霉菌具有一定的根际定殖能力,能够维持根系的正常生长,提高土壤肥力,拮抗多种土传病原菌[12]。因此,木霉生物育苗基质不仅具有普通育苗基质的功能特性,其所含的功能菌还对植物具有直接或间接的促生作用,提高作物的抗逆能力[12]。因此,本研究以本实验室分离筛选的具优异作物促生及抗逆能力的贵州木霉NJAU4742(TrichodermaguizhouenseNJAU4742)制备的木霉生物育苗基质为对象,通过室内育苗及田间试验系统研究含不同数量级木霉菌生物育苗基质对辣椒苗的促生效应以及其移栽至田间后的促生及增产的效应,为生物育苗基质中添加功能菌数量的限定标准提供数据支撑,为生物育苗基质产业的发展提供理论依据。
1 材料与方法
1.1 供试材料
1.1.1 供试木霉固体菌剂木霉固体菌种为贵州木霉NJAU4742(T.guizhouenseNJAU4742),由本实验室提供。木霉固体菌剂由江苏省淮安市柴米河农业科技股份有限公司提供,发酵原料是菇渣和麸皮按照质量比为4∶1混合制成。固体菌种发酵产物pH值为5.81,电导率为1 601 μs·cm-1,含N 1.9 g·kg-1、P2O56.0 g·kg-1及K2O 8.4 g·kg-1,含木霉孢子数为4×109CFU·g-1(干重)。木霉选择性培养基配制:称取孟加拉红琼脂培养基36.6 g,超纯水定容至1 L,121 ℃、0.13 MPa条件下灭菌30 min,倒平板前添加五氯硝基苯(PCNB)0.2 g、1%氯霉素、3%链霉素、10%曲拉通。
1.1.2 供试普通育苗基质供试普通育苗基质由江苏省淮安市柴米河农业科技股份有限公司提供。其基本性质:含水量38.4%,容重0.32 g·cm3,总孔隙度66.2%,通气孔隙17.9%,持水孔隙48.3%,气水比 1∶4(体积比),有机质26.18 g·kg-1,含N 4.03 g·kg-1、P2O53.23 g·kg-1和K2O 4.89 g·kg-1。
1.1.3 供试木霉生物育苗基质将NJAU4742木霉固体菌种按1∶9(质量比)与普通育苗基质拌匀后,制成含108CFU·g-1孢子的木霉生物育苗基质,再将该木霉生物育苗基质按1∶9(质量比)与普通育苗基质拌匀后,制成含107CFU·g-1孢子的木霉生物育苗基质,依次10倍稀释制成含107、106、105和104CFU·g-1木霉菌的生物育苗基质。
1.1.4 供试作物与土壤辣椒品种为‘苏椒5号博士王’,购自江苏省农业科学院明天种业有限公司。田间试验供试土壤的基本理化性质:pH7.96,电导率111 μS·cm-1,速效钾610 mg·kg-1,速效磷93 mg·kg-1,铵态氮2.2 mg·kg-1,硝态氮24.3 mg·kg-1。
1.2 试验设计
1.2.1 木霉生物育苗基质的辣椒育苗试验于2019年4—5月及5—6月分别于江苏省柴米河农业科技股份有限公司育苗大棚内进行两季辣椒育苗试验。每季试验均共设5个处理:普通育苗基质育苗对照(SCK)和分别含104、105、106和107CFU·g-1木霉菌NJAU4742的生物育苗基质育苗的4个处理(S1、S2、S3和S4)。每个处理设置3个重复,每个重复含24株种苗。育苗所用育苗盘为72孔,上孔径为39 mm,下孔径为18 mm,深度为42 mm。育苗前将辣椒种子浸种消毒催芽:辣椒种子经去离子水浸泡10 min后用3% NaClO消毒5 min,再用70%乙醇处理1 min,最后用去离子水冲洗3~4次,放置于湿润的纱布中,自封袋封口,于30 ℃培养箱中催芽3~4 d,待75%以上的种子露白后,选取露白均一的种子埋入基质中,各处理间水分管理一致。
1.2.2 生物育苗基质所育辣椒种苗的田间试验于2019年5—7月及6—8月在江苏省淮安市柴米河农业科技股份有限公司种植基地(32°43′00″ N,118°12′00″ E)分别开展两季田间试验。两季田间试验均设5个处理:普通育苗基质所育辣椒种苗移栽后对照(CK)和分别含104、105、106和107CFU·g-1木霉菌NJAU4742的生物育苗基质所育种苗移栽后处理(T1、T2、T3和T4)。每个处理共设置3个重复,每个重复10株,各处理选取相应育苗基质中长势一致的种苗移栽,每个重复移栽至同1排,株、行距分别为40、55 cm。处理间水肥管理一致。
1.3 测定项目与方法
1.3.1 基质中木霉数量采用平板涂布计数法,称取5 g基质于45 mL无菌水中,28 ℃、170 r·min-1振荡30 min。梯度稀释后,涡旋混匀后吸取0.1 mL稀释液于木霉选择性培养基上,将均匀涂布好的平板倒置于28 ℃的真菌培养箱中培养,72 h后计数。基质中木霉的数量以每克干重基质形成的菌落数计算。
1.3.2 辣椒苗生物量指标待辣椒种苗长到4叶2心(约30 d)后,每个处理选取10株长势均一的种苗,测定茎粗、株高、整株鲜重、地下部鲜重、地上部鲜重及干重。测定时将种苗连同基质小心取出,轻轻抖落基质后,用清水冲洗根部3遍,以去除根系附着的基质,用游标卡尺测定茎粗和株高。用吸水纸吸干植株后称重,即为种苗整株鲜重,用剪刀将植株地上部和地下部剪开,称取种苗地上部和地下部鲜重;种苗地上部于烘箱中105 ℃杀青15 min后,75 ℃烘干至恒重,称重并记为地上部干重。壮苗指数=(茎粗/株高+根干重/地上部干重)× 总干重。
1.3.3 辣椒田间生物量及单株果实重辣椒种苗移栽至田间生长40 d后,辣椒进入花期,分别采用卷尺和游标卡尺测定株高和茎粗。生长60 d后,辣椒果实开始成熟,分批次采收。单株辣椒全部商品果平均累计质量即为单株果实重(kg)。
1.3.4 辣椒根际土壤样品的采集于每季收获期最后1次采收果实时,采集根际土壤样品,每个重复随机采集5棵辣椒植株,连根带土取出,轻轻抖落附着在辣椒根系上的土壤,将根系用无菌手术刀切成3 cm小段,放入预先载有150 mL无菌水的三角烧瓶中,170 r·min-1振荡30 min后取出根系,5 000 r·min-1离心10 min,收集离心管中沉淀物即为根际土壤,于4 ℃保存,用于土壤微生物分析。
1.3.5 根际土壤中木霉数量采用平板稀释涂布法,称取5 g根际土壤样品于45 mL无菌水中,28 ℃、170 r·min-1振荡30 min。梯度稀释后,涡旋混匀后吸取0.1 mL稀释液于木霉选择性培养基上,涂布均匀后将其倒置于28 ℃培养箱中培养,72 h后计数。根际土壤中木霉数量以每克干重土壤形成的菌落数计算。
1.4 数据统计与分析
采用Excel 2013和SPSS 23.0软件进行数据统计分析,使用单因素方差分析(ANOVA)进行数据比较,采用最小显著差异法(LSD)进行多重比较。
2 结果与分析
2.1 不同处理生物育苗基质木霉功能菌的数量
由图1可知:通过10倍梯度稀释制备而成的含不同数量级NJAU4742木霉菌的生物育苗基质中,木霉功能菌数量随稀释梯度的增加而显著降低,S4、S3、S2及S1处理实际检测出的功能菌数量均低于理论估算值,其木霉菌数量分别为1.4×107、5.1×105、7.8×104和4.6×103CFU·g-1。
2.2 不同处理对辣椒种苗地上部干重及壮苗指数的影响
从图2可知:与不含木霉的普通育苗基质对照(SCK)相比,两季育苗试验中S4处理培育的辣椒种苗地上部干重均显著增加;相比于SCK,第1季S4处理辣椒种苗地上部干重显著增加42.9%;第2季S4、S3和S2处理辣椒种苗地上部干重分别显著增加75.0%、50.0%和50.0%。与SCK相比,第1季含木霉功能菌生物育苗基质各处理(S4、S3、S2及S1)种苗的壮苗指数均显著增加,分别增加61.4%、40.4%、15.8%和12.3%;第2季S4、S3及S2处理壮苗指数均显著增加,分别增加66.7%、50.0%和18.8%。与SCK相比,S4处理两季育苗试验中地上部干重均显著增加,S4、S3和S2处理壮苗指数均显著增加,表明木霉生育基质在种苗培育过程中对辣椒的促生效应明显。
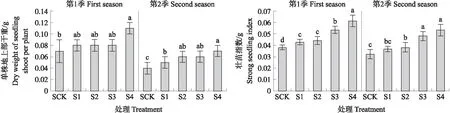
图2 不同处理对辣椒种苗地上部干重及壮苗指数的影响Fig.2 Effect of different treatments on dry weight of pepper seedlings shoot and strong seedling index
2.3 不同处理对辣椒种苗移栽至田间后株高和茎粗的影响
如图3所示,相比于CK,两季田间试验中T4、T3和T2处理的辣椒株高显著增加;T1处理第2季辣椒株高显著增加,第1季则无显著性差异。田间试验结果表明:与CK相比,第1季T4、T3和T2处理辣椒株高分别显著增加61.4%、29.4%和4.9%,第2季T4、T3和T2处理辣椒株高分别显著增加64.3%、24.8%和14.7%。相比于CK,两季田间试验中T4、T3处理的辣椒茎粗显著增加;相比于CK,第2季T2、T1处理株高显著增加,第1季则无显著性差异。与CK相比,第1季T4、T3处理辣椒茎粗分别显著增加41.2%和28.8%,第2季T4、T3处理辣椒茎粗分别显著增加30.2%和15.1%。

图3 不同处理对辣椒种苗移栽至田间后株高及茎粗的影响Fig.3 Effects of pepper seedlings cultivated in different nursery substrates on pepper height and stem diameter after transplanted into filed
2.4 不同处理对辣椒种苗移栽至田间后单株果实重的影响
从图4可知:相比于CK,两季田间试验中T4、T3和T2处理的单株果实重均显著增加。与CK相比,第1季T4、T3及T2处理辣椒单株果实重分别显著增加58.3%、36.1%和19.4%,第2季T4、T3及T2处理辣椒单株果实重则分别显著增加65.7%、42.9%和25.7%。
2.5 不同处理对辣椒种苗移栽至田间后土壤中木霉菌数量的影响
从图5可知:相比于CK,两季田间试验中T4、T3处理的辣椒根际土中木霉菌数量显著增加;相比于CK,T2处理第2季辣椒根际土中木霉菌数量显著增加,第1季的则无显著性差异。与CK相比,第1季T4、T3处理辣椒根际土中木霉菌数量分别显著增加10.7%和6.0%,第2季T4、T3处理辣椒根际土中木霉菌数量分别显著增加5.4%和4.7%。

图4 不同处理对辣椒种苗移栽至田间后 单株果实重的影响Fig.4 Effects of pepper seedlings cultivated in different nursery substrates on fruit weight per plant of pepper after transplanted into filed
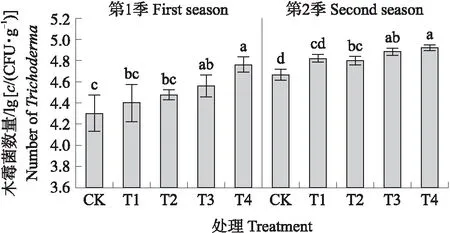
图5 不同处理对辣椒种苗移栽至田间后 根际土中木霉菌数量的影响Fig.5 Effects of pepper seedlings cultivated in different nursery substrate on the number of Trichoderma in rhizosphere soil of pepper after transplanted into filed
2.6 基质中木霉菌数量与辣椒生物量、单株果实重和根际土木霉菌数量的相关性分析
从表1可知:基质中的木霉菌数量与第1季及第2季辣椒种苗的整株鲜重以及地下部鲜重、地上部鲜重及地上部干重均呈现极显著正相关关系,与移栽后辣椒的株高、茎粗、单株果实重和收获期根际土壤中木霉菌数量也呈显著正相关关系,表明木霉菌数量与辣椒基质育苗及田间生产密切相关。

表1 基质中木霉菌数量与辣椒生物量的相关性Table 1 Correlation of the number of Trichoderma in soil and the biomass of pepper
3 讨论
生物育苗基质具有解磷、解钾、提高作物免疫能力等功能,为植物提供营养及适应逆境胁迫等作用[13]。将功能菌优化组合后添加到基质中,生物育苗基质在提高番茄幼苗生理指标上具有显著的效果[14];生物育苗基质所育种苗能够有效促进黄瓜生长和提高黄瓜产量[15];生物育苗基质中的功能菌数量达107CFU·g-1的多功能菌群在育苗基质中具有明显的促生作用[16]。本研究将发酵好的NJAU4742木霉菌种固体发酵物添加到普通育苗基质制成生物育苗基质,并以辣椒为供试作物进行两季育苗试验,探究含不同数量级功能菌的生物育苗基质对种苗的促生效应。两季辣椒育苗试验结果表明,含木霉菌的生物育苗基质促生效果显著,且含105CFU·g-1的木霉菌生物育苗基质对辣椒能够表现出稳定的促生效果。微生物菌剂的加入能够改善基质的结构,提高基质中的养分供应能力,加强植物吸收营养元素的能力[17]。
苗期作物在移栽后的生物学指标的提高与苗期作物的生长量有着紧密的联系。通常来说,幼苗期的生长指标和移栽后作物的生长指标呈正相关的关系[18-19]。任季平等[20]研究发现,种苗生物量显著增加的小麦和白菜移栽后,其生物量仍增加。文春燕等[8]研究结果也表明,生物基质显著促进辣椒和番茄在苗盘期的生长,并且种苗移栽后,无论是生长指标还是果实产量,均显著高于对照。牛聪聪等[21]研究尿素配施木霉菌剂能够在苗期显著增加甜瓜的生物量,且能延续其优势到成熟期,提高甜瓜产量、品质。本研究两季田间试验结果均表明,含木霉的生物育苗基质所育的辣椒种苗移栽到至田间后对辣椒促生及增产效果显著。种苗移栽至田间后仍表现出显著的促生效果,一方面可能是因为育苗过程中,木霉功能菌即能够在苗期定殖于作物根际,预计到田间后能够进一步发挥促生功能;另一方面可能是因为“先发优势”,苗期的生长优势直接作用于后期的作物生长。因此,生物育苗基质能够提高种苗的质量,促进功能菌在苗期的定殖,进而两者协同作用,对种苗移植田间后具有促生作用。
功能菌的有效活菌数与基质育苗及其移栽后田间生长效应密切相关[22]。施用添加木霉生物有机肥的番茄生物量显著增加,且与其根际可培养木霉数量具有显著正相关[23];利用辣椒根际枯草芽胞杆菌研制的生物育苗基质促生效果类似[7]。本试验中,土壤木霉菌数量与辣椒种苗生物量、移栽后田间辣椒单株果实重等指标间显著正相关,因此推测不同处理的促生作用由木霉功能菌决定。两季试验的生物量以及产量之间有较小差异,可能与开展两季田间试验时温度的变化有关;实测木霉菌数量与理论值有较小差异,可能由于基质未混匀或者涂布检测的局限性。木霉菌生物育苗基质促生增产效果均达到显著,进一步说明其具有稳健的促生抗逆作用。本研究中实测木霉菌数量超过105CFU·g-1的生物基质所育的辣椒种苗生物量显著增加,移栽后仍具有显著的增产效果,且有效活菌数数量越多,促生增产效果越好。今后,我们将进行含不同木霉菌数量的生物育苗处理对土壤理化性质、土壤酶活性等方面的研究,而且木霉菌生物育苗基质提升辣椒种苗生物量及移栽田间后产量的作用机制仍需研究。
总之,含不同数量级木霉菌的生物育苗基质对设施辣椒的育苗以及其移栽至田间后增产效果不同,含105CFU·g-1木霉菌基质能够显著促进辣椒种苗生长并增加其移栽至田间后的生物量及果实重,且木霉菌数量越高,其育苗促生及移栽后增产效应越明显。

