不结球白菜抗病相关基因BcCPR1的克隆和功能分析
邵岑,袁水林,王远,朱蔚曈,侯喜林,李英
(南京农业大学作物遗传与种质创新国家重点实验室/农业农村部华东地区园艺作物生物学与种质创新重点实验室/园艺学院,江苏 南京 210095)
不结球白菜(Brassicacampestrisssp.chinensis)具有重要的经济价值,在我国蔬菜市场供应中起着重要的作用[1]。灰霉病是十字花科蔬菜常见的贮藏病害,其病原菌为灰霉菌(Botrytiscinerea),它主要危害植株的叶柄、叶片。植株感染灰霉病后,在发病前期叶片呈水渍状,之后病斑扩大呈褐色,最后叶片腐烂[2]。十字花科作物霜霉病是由芸薹属寄生卵菌(Hyaloperonosporaparasiticavar.brassicae)引起,严重时可导致不结球白菜产量损失达90%[3]。使用杀菌剂是控制感染的有效措施,但这严重危及食品安全和农业可持续发展[4]。因此,筛选抗病基因,通过基因工程解决抗病育种问题,将有利于减少不结球白菜因灰霉病、霜霉病等病害造成的损失。
抗病基因的激活是植物免疫过程中必不可少的一步,但在没有病原菌的情况下激活抗病基因或在病原菌入侵时过度激活抗病基因对植物都是有害的[5]。抑制抗病基因激活的一种普遍方法是通过泛素介导的26S蛋白体系统(ubiquitin 26S-proteasome system,UPS)。UPS在泛素激活酶E1(ubiquitin activating enzyme,UBA)、泛素结合酶E2(ubiquitin conjugating enzyme,UBC)、泛素连接酶E3(ubiquitin ligase,UBL)等的作用下,将泛素分子连接到底物蛋白上。其中,F-box蛋白作为泛素连接酶E3的组成部分,直接与底物蛋白相互作用,使底物蛋白被26S蛋白酶体降解[6-7]。在拟南芥中有700多个F-box蛋白,这表明大量蛋白质受26S蛋白酶体的调控[8]。
CPR1是一种F-box蛋白,其N端含有F-box基序,C端含有FBA基序。F-box基序是结合SKP1(S-phase kinase-associated protein 1)形成SCF(SKP1-CULLIN1-F-box)复合物所必需的,而FBA基序通常结合其他蛋白参与蛋白的泛素化[9]。F-box蛋白在识别底物蛋白过程中发挥特异性的识别作用。在拟南芥中,CPR1可以特异识别抗病蛋白SNC1(suppressor of NPR1,constitutive 1)、RPS2(ribosomal protein S2),在植物体内与其相互作用,cpr1功能缺失型突变体可以使SNC1、RPS2蛋白积累增多,并且激活植物自身的免疫反应[10-11]。CPR1作为免疫反应中的一种负调节因子,它可能通过泛素蛋白酶体途径调节拟南芥的水杨酸(SA)依赖性和SA非依赖性防御信号,而EDS1(enhanced disease susceptibility 1)、PAD4(phytoalexin deficient 4)和NDR1(non race-specific disease resistance 1)作为SA途径的标记基因[12-14]可在cpr1突变体中被激活,并对丁香假单胞菌(Pseudomonassyringaepv.tomato)产生抗性。茉莉酸(JA)的生物合成和信号传导也是响应病原菌所必需的[15],在cpr1突变体中JA途径标记基因PDF1.2(plant defensin 1.2)的表达并没有被激活[16-17],因此JA途径中CPR1基因在抗病方面的作用还有待进一步研究。
本研究在不结球白菜数据库中对比CPR1同源基因,根据其基因序列设计特异引物,克隆BcCPR1基因;利用同源重组法构建pRI101-BcCPR1-GFP融合载体,对其进行亚细胞定位分析,并通过农杆菌介导法转入拟南芥进行基因过表达功能分析,同时利用RT-qPCR技术研究BcCPR1基因在生物和非生物胁迫下的响应,旨在为研究BcCPR1基因对病原菌及非生物胁迫应答的机制提供科学依据。
1 材料与方法
1.1 试验材料与病原菌收集
不结球白菜‘苏州青’由南京农业大学白菜系统生物学实验室提供。待幼苗长至4片真叶时,对植株进行诱导处理。在南京农业大学试验田中收集白菜类霜霉菌,灰霉菌由浙江大学园艺系师恺教授惠赠。霜霉菌的收集及菌液的保存采用Sun等[18]的方法,灰霉菌的保存及培养采用AbuQamar等[19]的方法。
1.2 BcCPR1基因的克隆
取4叶1心期不结球白菜的叶片0.1 g,用RNA Simple Total RNA Kit(TaKaRa)提取叶片总RNA,使用PrimeScriptTMⅡ 1st Strand cDNA Synthesis Kit(TaKaRa)反转录成cDNA,用于后续基因克隆。
在不结球白菜数据库(http://nhccbase.njau.edu.cn/website/)中查找CPR1同源基因,基因编号为CabbageG_a_f_g038565[20],根据其基因序列设计特异引物BcCPR1-F/R(表1)。

表1 本文所用引物序列Table 1 Primer sequences in this study
以不结球白菜‘苏州青’的cDNA为模板,利用特异性引物BcCPR1-F/R进行PCR扩增。扩增体系 20 μL:上、下游引物各1 μL,模板1 μL,PrimeSTAR Max Premix(2×)(TaKaRa)10 μL,ddH2O 7 μL。反应程序:98 ℃ 10 s,55 ℃ 15 s,72 ℃ 2 min,共35个循环;4 ℃保存。扩增产物在12 g·L-1琼脂糖凝胶中电泳20 min。确定目标序列长度的正确性及条带单一性后,用凝胶提取试剂盒(天根生化科技有限公司)回收DNA片段,然后连接到pEASY-Blunt Simple(北京全式金生物技术有限公司)载体上。连接体系 5 μL:pEASY-Blunt 1 μL,胶回收产物4 μL。反应程序:37 ℃ 30 min,4 ℃保存。通过热激法将产物转化至大肠杆菌DH5α(TaKaRa)后,涂布在含有50 mg·L-1卡那霉素(Kanamycin)的LB培养基(胰蛋白胨10 g·L-1、酵母提取物5 g·L-1、氯化钠10 g·L-1、琼脂14 g·L-1)上,倒置在37 ℃恒温培养箱中培养12 h左右,挑取单个菌落进行PCR验证,并将阳性单菌落送往南京擎科生物科技有限公司测序。
1.3 BcCPR1生物信息学分析
在NCBI数据库网站(https://www.ncbi.nlm.nih.gov/)下载不同物种CPR1基因序列及氨基酸序列;使用MEGA 7软件中的邻接法构建系统发育树,修正参数bootstrap设置为1 000次;在NCBI数据库网站分析BcCPR1蛋白结构域;利用DNAMAN 6.0软件翻译BcCPR1基因编码的氨基酸序列,并计算蛋白质相对分子质量和等电点。
1.4 BcCPR1过表达载体的构建
BcCPR1与pRI101的融合表达载体的构建采用同源重组的方法[21],引物为BcCPR1-pRI101-F/R(表1)。以BcCPR1-pEASY质粒为模板,使用PrimeSTAR Max Premix(TaKaRa)进行PCR扩增,使用ClonExpress Ⅱ One Step Cloning Kit(南京诺唯赞生物科技股份有限公司)进行同源重组连接反应,反应程序及过程同1.2节。
1.5 BcCPR1亚细胞定位
将空载pRI101和重组过表达载体pRI101-BcCPR1-GFP通过液氮冻融法转化农杆菌GV3101(TaKaRa)后,涂布在含有50 mg·L-1卡那霉素和50 mg·L-1利福平的LB培养基上,倒置在28 ℃恒温培养箱中培养48 h左右,挑取单个菌落进行PCR验证。将阳性克隆的单菌落在含有卡那霉素和利福平的LB液体培养基中28 ℃、200 r·min-1培养20 h,然后取1%(体积分数)的菌液扩大培养。当菌液D600达到 1.0~2.0时,6 000 r·min-1离心5 min,用注射缓冲液[10 mmol·L-1MgCl2、10 mmol·L-1MES(pH5.7)、150 μmol·L-1乙酰丁香酮]重悬菌体,调节菌液浓度至D600达到0.8~1.0。室温静置3~4 h后,用1 mL注射器分别将含有pRI101和pRI101-BcCPR1-GFP的注射缓冲液注射至30 d左右苗龄烟草的叶背面。将注射后的烟草先置于人工气候室黑暗培养12 h,然后在正常条件下培养60 h左右,使用激光共聚焦显微镜观察,分析pRI101的表达部位和BcCPR1蛋白的亚细胞定位。
1.6 BcCPR1过表达植株的获得
通过蘸花法将重组过表达载体pRI101-BcCPR1-GFP转入处于开花期的拟南芥中,然后混合收种并记为T0代。在含有50 mg·L-1卡那霉素抗性的1/2 MS平板上筛选种子10~15 d,得到T1代阳性植株。通过RT-qPCR和激光共聚焦显微镜观察阳性植株,将T1代阳性植株移栽至人工气候室,单株收种后再次筛选得到T2代及T3代。
1.7 BcCPR1过表达植株的灰霉菌接种
将野生型(WT)和T3代过表达转基因拟南芥(35S∷BcCPR1)植株置于光照/黑暗时间为16 h/8 h、温度为22 ℃/16 ℃、相对湿度为85%的条件下培养15~20 d。将灰霉菌用孢子悬浮液(1%蛋白胨,4%麦芽糖)悬浮,经4层纱布过滤,将孢子浓度调至2×106mL-1。在过表达转基因拟南芥(35S∷BcCPR1)和WT叶片上分别接种8 μL灰霉菌孢子悬浮液,每株接种至少3片子叶。接种后于22 ℃黑暗条件下培养12 h,覆罩子保湿培养3~4 d后,统计病斑大小并观察发病情况,重复3次。
1.8 病斑大小统计
接种灰霉菌3~4 d后,观察拟南芥叶片上的圆形褐色病斑,根据病斑直径大小判断灰霉菌的发病情况。用ImageJ(National Institutes of Health)和Excel 2016软件处理和分析数据。
1.9 菌量测定及防御相关基因的表达
通过检测灰霉菌内参基因BcActin的表达水平来判断植株的发病情况。利用拟南芥AtActin基因作为内参基因,实时荧光定量 PCR检测野生型植株和BcCPR1过表达植株的菌量及防御相关基因EDS1和PDF1.2的表达情况。
1.10 逆境胁迫处理
将白菜类霜霉病菌(孢子囊1×105mL-1)接种于4叶1心期的不结球白菜幼苗叶片的背面,接种后盖上罩子保湿,以清水处理作为对照。分别于接种后0、6、12、24、48、72和96 h采集样品,将样品用液氮冷冻,保存于-70 ℃冰箱。
分别用0.1 μmol·L-1脱落酸(ABA)、2 μmol·L-1水杨酸(SA)、1 mmol·L-1茉莉酸甲酯(MeJA)、250 mmol·L-1NaCl溶液喷施4叶1心期的幼苗叶片,以喷施缓冲液作为对照,分别于处理后0、2、6、12、24、48和72 h采集样品,液氮冷冻后保存于-70 ℃冰箱。
1.11 实时荧光定量PCR分析
用Simple Total RNA Kit(天根生化科技有限公司)提取总RNA,使用Hifair®Ⅲ 1st Strand cDNA Synthesis Kit(上海翊圣生物科技有限公司)将RNA反转录成cDNA。将反转录的cDNA模板稀释5倍后用于RT-qPCR。反应体系:正、反引物各0.4 μL,模板 2 μL,Hieff®qPCR SYBR Green Master Mix 10 μL,ddH2O 7.2 μL。反应程序:95 ℃ 5 min,95 ℃ 10 s,60 ℃ 30 s,共40个循环。采用2-ΔΔCT的方法分析数据,利用IBM SPSS Statistics 24软件进行误差分析和差异显著性分析。

图1 不结球白菜BcCPR1基因的克隆Fig.1 Cloning of the BcCPR1 gene in non-heading Chinese cabbageM. DL2000 marker;1. BcCPR1扩增产物BcCPR1 amplification product.
2 结果与分析
2.1 不结球白菜BcCPR1基因的克隆与序列分析
以不结球白菜‘苏州青’叶片cDNA为模板,用特异引物BcCPR1-F/R扩增出约1 200 bp的目的条带(图1)。序列分析表明:BcCPR1基因含有1个 1 221 bp的开放阅读框(ORF),编码406个氨基酸,相对分子质量为46.6×103,等电点为8.7。测序结果表明,扩增产物片段与CPR1同源基因(CabbageG_a_f_g038565)完全一致。
2.2 不结球白菜BcCPR1的系统进化分析
利用BLASTp对BcCPR1基因所编码的氨基酸序列同源性进行检索,共获得9个CPR1基因所编码的氨基酸序列。由图2-A可见:BcCPR1与同属的甘蓝和芜菁相似度最高,分别为97.54%和 92.66%,而与萝卜、山嵛菜、玉山筷子芥、亚麻荠、甘蓝型油菜、拟南芥的相似度分别为96.80%、88.67%、77.98%、83.82%、73.12%、71.91%。系统进化树分析表明,BcCPR1蛋白与芜菁、甘蓝型油菜和拟南芥蛋白同源关系最近(图2-B)。用NCBI软件分析BcCPR1蛋白二级结构域中的保守结构域,结果(图2-C)显示,该蛋白含有F-box结构域,属于FBA_1超家族。
2.3 BcCPR1的亚细胞定位分析
由图3可见:pRI101-BcCPR1-GFP在GFP激发光下可以检测到在细胞膜上有明显的绿色荧光信号,表明pRI101-BcCPR1-GFP融合蛋白在细胞膜上发挥作用。
2.4 BcCPR1基因对生物及非生物胁迫的响应
由图4可见:霜霉菌、激素、盐处理均能诱导BcCPR1基因的表达。在霜霉菌诱导下,不结球白菜‘苏州青’中BcCPR1基因在0~12 h下调表达,在24~96 h表达量逐渐上调,96 h时表达量达到最大。2 μmol·L-1SA处理后,BcCPR1基因在0~72 h表达量呈先下降后上升规律;0.1 μmol·L-1ABA处理后,BcCPR1基因在2 h达到峰值,2~24 h表达量逐渐下降,48~72 h表达量趋于稳定;1 mmol·L-1MeJA处理后,0~2 h表达量上升,6~24 h表达量变化不大,48 h达到峰值,之后表达量下降。250 mmol·L-1NaCl处理后,BcCPR1基因在0~6 h表达量上升,6 h表达量达到最大,之后表达量下降。
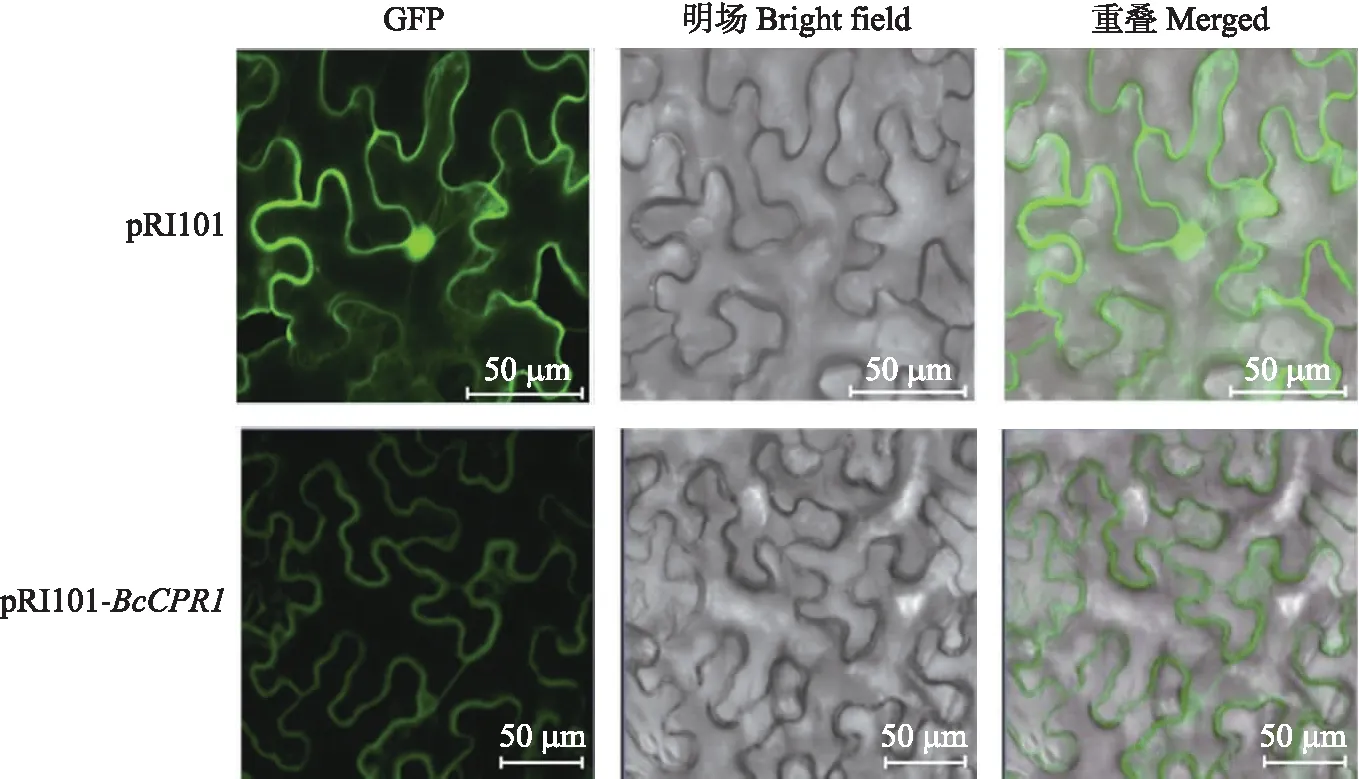
图3 BcCPR1在本氏烟草叶片中的亚细胞定位Fig.3 Subcellular localization of BcCPR1 in leaves of Nicotiana benthamiana
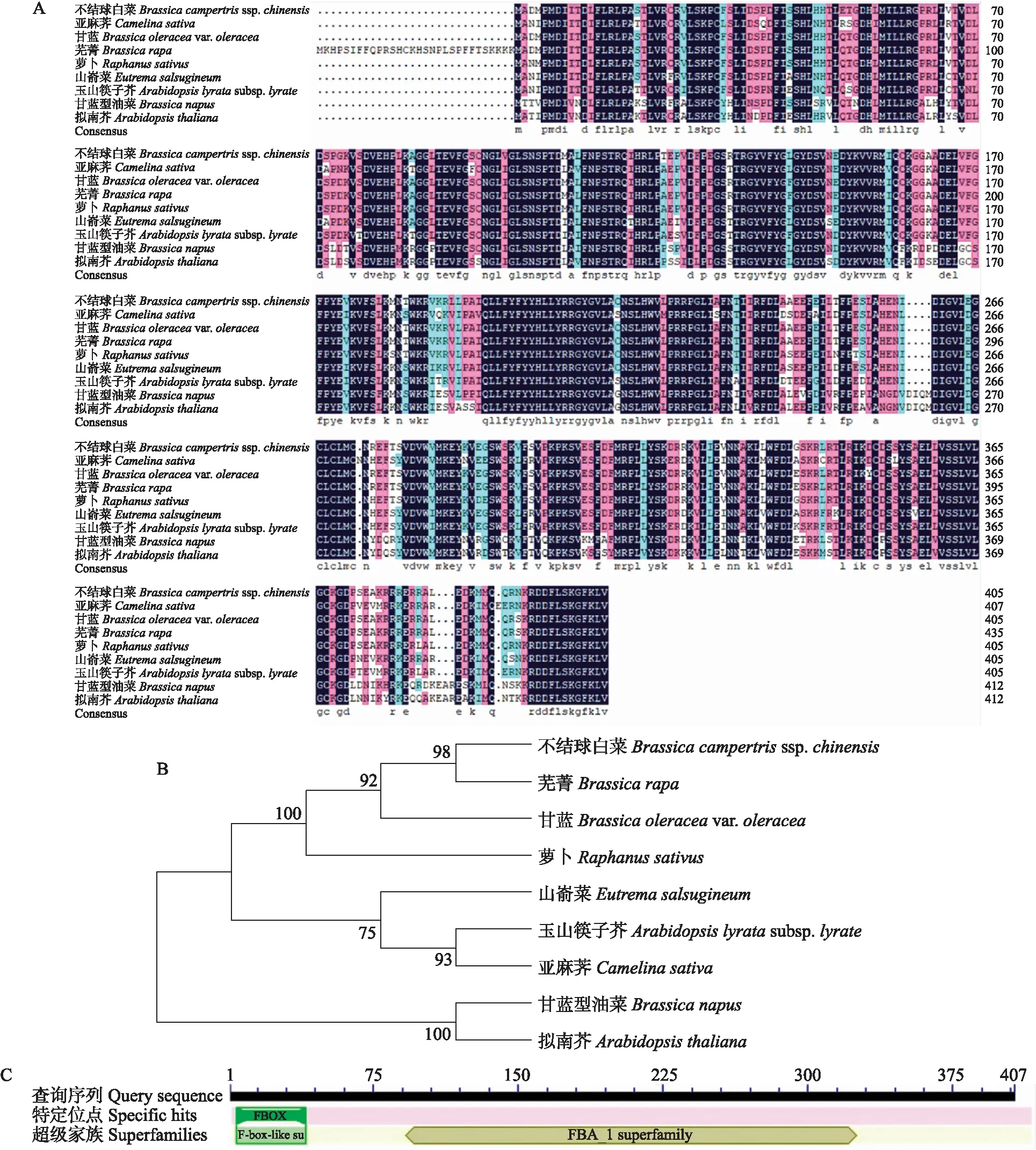
图2 BcCPR1与其他物种CPR1蛋白的多序列比对(A)、进化树分析(B)及氨基酸序列的保守结构域(C)Fig.2 Multiple sequence alignment(A)and phylogenetic tree analysis(B)of BcCPR1 in non-heading Chinese cabbage and other species and conserved domains of amino acid sequences of BcCPR1(C)
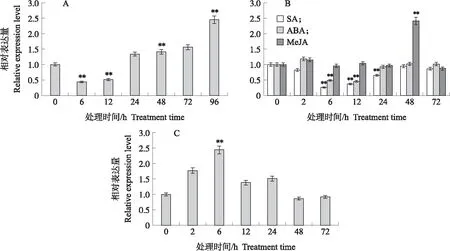
图4 BcCPR1基因在生物和非生物胁迫处理下的表达分析Fig.4 Expression analysis of BcCPR1 gene under biotic and abiotic stress treatmentA. 霜霉菌处理Hyaloperonospora parasitica treatment;B. 激素处理Hormone treatment;C. NaCl处理NaCl treatment.**P<0.01. The same as follows.
2.5 转基因拟南芥植株的鉴定
T0代在卡那霉素抗性的培养基中筛选出7株35S∷BcCPR1转基因拟南芥植株,通过RT-qPCR技术和激光共聚焦显微镜检测,转基因株系中BcCPR1均可在蛋白水平表达(图5-A),并且BcCPR1基因的表达量显著高于野生型植株(图5-B),选取表达量较高的OE-1、OE-5转基因株系进行后续研究。
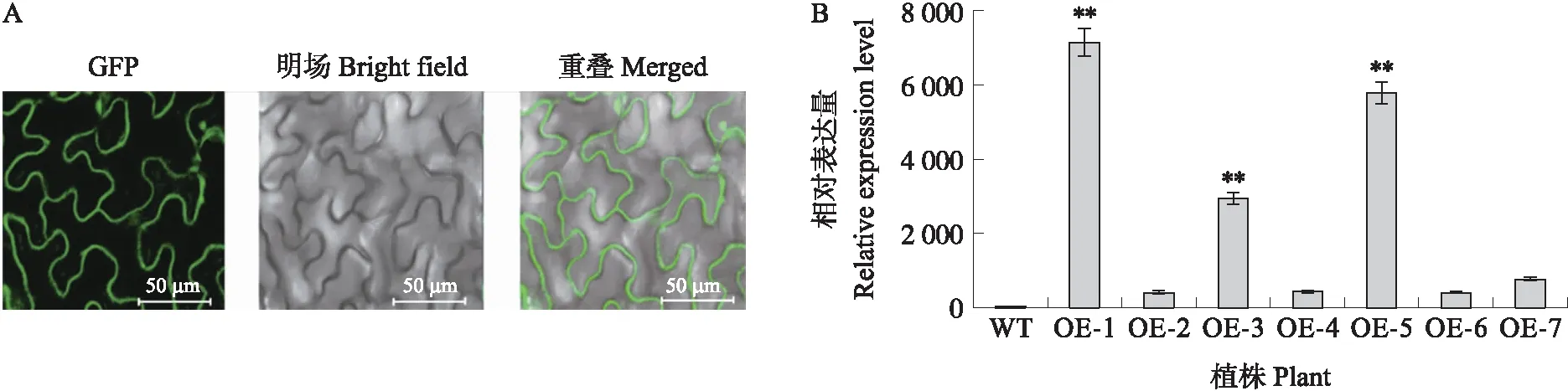
图5 过表达BcCPR1拟南芥植株的鉴定Fig.5 Identification of BcCPR1-overexpressed transgenic plants in Arabidopsis thaliana A. 转基因植株中BcCPR1的表达Expression of BcCPR1 in transgenic plants;B. 转基因植株中BcCPR1基因的相对表达量Relative expression analysis of BcCPR1 gene in transgenic plants.WT:野生型 Wild-type;OE-1—OE-7:转基因植株 Transgenic plants. 下同。The same as follows.
2.6 接种灰霉菌后转基因拟南芥病害表型分析
在T3代35S∷BcCPR1转基因拟南芥植株上接种灰霉菌,3 d后观察结果并拍照。由图6可见:T3代35S∷BcCPR1转基因拟南芥在侵染灰霉菌后,抗病性相较于野生型明显增强,35S∷BcCPR1株系每轮基生莲座叶的叶片病斑直径都明显小于野生型,其灰霉菌相对菌量也较野生型明显减少。上述结果表明,BcCPR1在拟南芥中过表达会提高植株对灰霉菌的抗性。
2.7 BcCPR1基因对转基因植株灰霉菌抗病机制分析
如图7所示:在受到灰霉菌侵染后,OE-1和OE-5转基因株系中PDF1.2表达量上调,EDS1表达量与野生型相比差异不显著。表明过表达BcCPR1基因的拟南芥植株通过改变防御相关基因的表达量来增强其对灰霉菌的抗性,并且可能主要通过JA作用通路来调节其对灰霉菌的抗病性。

图6 过表达BcCPR1拟南芥植株接种灰霉菌后的发病统计Fig.6 Disease statistic of BcCPR1-overexpressed A.thaliana after inoculation with Botrytis cinerea A. 发病症状Disease symptom;B. 病斑直径Lesion size;C. BcCPR1基因相对表达量Relative expression level of BcCPR1 gene;D. 灰霉菌相对菌量Relative amounts of B.cinerea. *P<0.05.
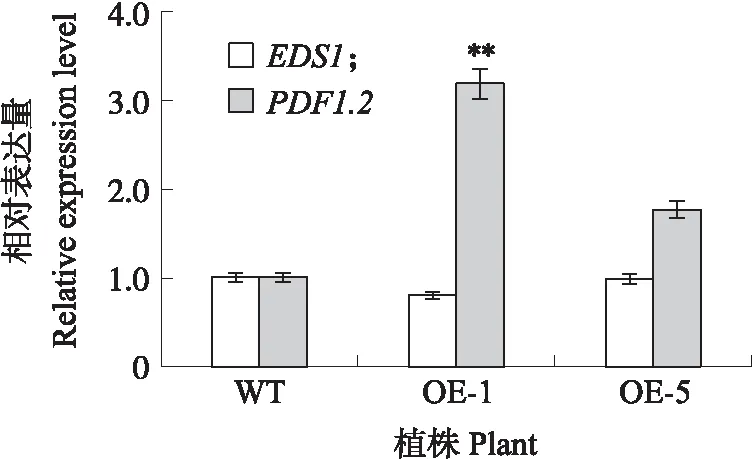
图7 过表达BcCPR1拟南芥植株接种灰霉菌后 EDS1和PDF1.2基因的表达分析Fig.7 Expression analysis of EDS1 and PDF1.2 gene in BcCPR1-overexpressed plant of A.thaliana after inoculation with B.cinerea
3 讨论
研究表明,防御调控基因可以激活抗病相关基因的活性,与单一基因相比,它为植物提供了更加有效且持久的保护[22]。抗病基因的负调控有2个目的:一是在没有病原体入侵的情况下,降低抗病蛋白的基础水平;二是控制免疫应答,使其不会过量表达引起超敏反应[5]。本研究分离并鉴定了BcCPR1基因,结果表明BcCPR1与拟南芥蛋白同源关系较近,推测两者在功能和结构上具有相似性。
van Wees等[23]研究表明,拟南芥防御突变体cpr1对细菌性病原体丁香假单胞菌具有抗性,cpr1突变体的PR1表达量升高,说明该突变体对某些活体营养型病原体的抗性增加。Love等[24]发现拟南芥突变体cpr1-1和cpr5-2比野生型Col-0对花椰菜花叶病毒(CaMV)的抗性增强。本研究中,BcCPR1基因对于活体营养型病原体霜霉菌和坏死营养型病原菌灰霉菌均有响应,并且过表达BcCPR1基因的拟南芥植株对灰霉菌的抗性增强。在SA处理下BcCPR1基因在0~72 h表达量先下降后上升,在MeJA处理下BcCPR1基因6~24 h表达量变化不大,48~72 h表达量下降。通常水杨酸信号积极诱导植物对活体营养型病原体的防御,而JA/ET途径是主要抵抗坏死营养型病原体和食植性昆虫所需的防御途径[25-26]。本研究中,EDS1作为SA信号通路标记基因在过表达BcCPR1基因的拟南芥植株中表达量与野生型相比差异不显著,PDF1.2作为JA/ET途径标记基因表达量上调,说明过表达BcCPR1基因的拟南芥植株可能主要通过JA防御途径对灰霉菌产生抗性。
FBP(F-box protein)除病原菌外还对其他非生物胁迫具有响应[27-29]。如AtARKP1在干旱胁迫条件下作为正调节因子[28],arkp1突变体表现出ABA介导的对种子萌发、根伸长和离体叶失水率的抑制作用。Zhou等[30]和Zhao等[31]对TaFBA1的研究表明,盐胁迫下TaFBA1过表达转基因植株抗氧化酶活性较高,活性氧积累较少,叶片和根中钾离子含量比野生型高,说明TaFBA1基因在植物耐盐性方面的提高可能与抗氧化能力和钾离子含量的提高有关。本研究发现,BcCPR1基因对盐处理和ABA处理均有响应,说明BcCPR1基因响应除病原微生物外的其他胁迫反应,但具体调控机制还有待进一步研究。
综上所述,不结球白菜BcCPR1基因参与多种生物和非生物胁迫反应,并受到SA和JA等激素信号通路的调节。在下一步研究中,我们将通过酵母双杂交技术筛选出与BcCPR1基因互作的抗病基因,明确该基因在不结球白菜抗病过程中的作用机制。

