MIF依赖性巨噬细胞在顺铂诱导的急性肾损伤中的作用
徐文倩 李金红 郑智华
【关键词】巨噬细胞迁移抑制因子;巨噬细胞;急性肾损伤;肾脏炎症
急性肾损伤(AKI)在临床中较为常见。在AKI早期阶段的肾小管损伤中,炎症起关键作用,肾脏中可观察到大量炎性细胞因子释放和炎性细胞浸润。注射脂质体氯膦酸盐系统性耗竭单核细胞和巨噬细胞可缓解AKI,体现了巨噬细胞在AKI中的重要性[1]。其中,M1型巨噬细胞参与促炎反应导致肾脏损伤,而M2型巨噬细胞参与抗炎反应抑制肾脏损伤[2-3]。巨噬细胞迁移抑制因子(MIF)是免疫和炎症反应的上游细胞因子,参与AKI的损伤和修复[4-7]。近年研究结果阐明了MIF在肾小球肾炎中的致病作用[8-10]。阻断MIF可以部分逆转快速进展新月体肾小球肾炎的肾损伤;MIF基因敲除或药理学阻断对AKI有保护作用[11-12]。然而,MIF是否通过巨噬细胞促进AKI尚无定论。本研究旨在阐明MIF依赖性巨噬细胞在AKI中的具体作用和机制。
材料与方法
一、主要试剂
顺铂(美国SigmaAldrich);肌酐检测试剂盒(南京建成);胎牛血清(美国ThermoFisherScientific);大鼠抗小鼠Mincle抗体(美国MBL),兔抗小鼠iNOS抗体(美国Abcam);山羊抗小鼠MCP-1抗体(美国SantaCruz),山羊抗小鼠TNF-α抗体(美国SantaCruz);LiberaseTM(美国Roche);流式固定液,流式染色液(美国eBioscience);APC标记的抗小鼠NOS2抗体(美国eBioscience),AlexaFluor?488标记的抗小鼠Mincle抗体(美国SantaCruz),PECy5标记的抗小鼠F4/80抗体(美国eBioscience);苏木素-雪夫试剂(美国SigmaAldrich)。
二、造模方法和分组
3只6~8周龄野生型C57BL/6J雄性小鼠、27只6~8周龄MIF基因敲除(MIF-/-)雄性小鼠(C57BL/6J背景)由香港中文大学惠赠。其中,3只野生型雄性小鼠和3只MIF-/-雄性小鼠用于培养骨髓来源的巨噬细胞。24只MIF-/-雄性被随机分为正常对照组(n=6)和实验组(n=18)。小鼠飼养于标准环境,自由进食、饮水,而且保持12h(光照)∶12h(黑暗)的昼夜循环,小鼠培养完全符合相关管理要求,所有动物操作均按照中山大学有关动物保护和管理办法执行,研究过程符合动物伦理要求。
正常对照组小鼠尾静脉注射生理盐水。实验组小鼠腹腔注射顺铂,剂量为20mg/kg,建立顺铂诱导的AKI模型(Cis-AKI)。建模6h后将18只实验组小鼠随机分为AKI模型组、巨噬细胞对照组和MIF-/-巨噬细胞组(每组n=6)。AKI模型组的小鼠通过尾静脉注射生理盐水,巨噬细胞对照组的小鼠通过尾静脉注射2×106个提取自野生型小鼠的骨髓来源巨噬细胞(BMDM),MIF-/-巨噬细胞组的小鼠通过尾静脉注射2×106个提取自MIF-/-小鼠的BMDM。3d后处死小鼠,留取血清和肾脏组织标本。
三、BMDM培养和转移
物理分离野生型C57BL/6J和MIF-/-小鼠的骨髓细胞。将骨髓细胞培养在含有10%胎牛血清(FBS)和50ng/ml巨噬细胞集落刺激因子(M-CSF)的DMEM/F12培养基中,培养7d后得到成熟的巨噬细胞,期间每3d更换培养基。收取成熟的BMDM,用F4/80抗体鉴定BMDM纯度>98%,并用预冷的盐水以每毫升5×106个细胞的密度重悬。顺铂注射6h后将2×106个BMDM细胞通过尾静脉注射到各组小鼠体内。
四、血清肌酐检测
离心管中的血样在室温下静置1h,待血液凝固、血清析出后,4000转/分离心10min取上层血清。采用南京建成肌酐定量分析试剂盒,按照说明书中的方法步骤进行操作:将肌酐标准品、双蒸水和血清样品分别加入96孔板中,每孔6μl,复孔;每孔加入酶溶液A180μl,轻轻拍板混匀;37℃下孵育5min,酶标仪(546nm)测定吸光度值A1;每孔加入酶溶液B60μl,轻轻拍板混匀;37℃下孵育5min,酶标仪(546nm)测定吸光度值A2;根据计算公式算出待测血清的肌酐水平。每组测量3个样品。
五、过碘酸雪夫(PAS)染色
将石蜡包埋的肾脏组织切成4μm厚的薄片,脱蜡复水后用雪夫试剂孵育30min至组织呈淡粉色,流水冲洗5min后,可见组织变为深粉红色。持续冲洗玻片15min,然后用苏木素复染1min,3%冰醋酸复染15s,流水冲洗至少30min。在室温下风干玻片并封片。
六、免疫组织化学(免疫组化)染色
4μm肾脏组织常规切片后,用3%过氧化氢溶液封闭,一抗湿盒中4℃孵育过夜,一抗分别为:兔抗小鼠F4/80单克隆抗体(1∶200),山羊抗小鼠MCP-1单克隆抗体(1∶200),山羊抗小鼠TNF-α单克隆抗体(1∶200)。辣根过氧化物标记的IgG二抗室温孵育1h,用DAB显色,苏木素染1min,3%冰醋酸复染15s,在室温下风干玻片并封片,在显微镜下观察并计数,每组计数3个样品,每个样品计数5个高倍镜视野并取平均值。
七、流式细胞仪检测
肾脏组织剪碎后用1%LiberaseTM消化成单细胞悬液,然后用流式固定液固定20min。取106个细胞重悬在100μl流式染色液中,抗体4℃孵育过夜,抗体分别为APC标记的抗小鼠NOS2单克隆抗体(1∶100),AlexaFluor?488标记的抗小鼠Mincle单克隆抗体(1∶100),PECy5标记的抗小鼠F4/80单克隆抗体(1∶100),次日加入1ml磷酸盐缓冲液(PBS)清洗细胞,离心后去除上清,用200~500μl流式染色缓冲液重悬,用BDFACSAriaⅢ流式细胞仪分析荧光信号,用FlowJo软件进行数据处理。每组测量3个样品。
八、统计学处理
采用GraphPadPrism6.0进行数据的统计学处理,多组间比较采用单因素方差分析,进一步两两比较采用Bonferroni法,文中所示P值均为校正后P值。α=0.05。
结果
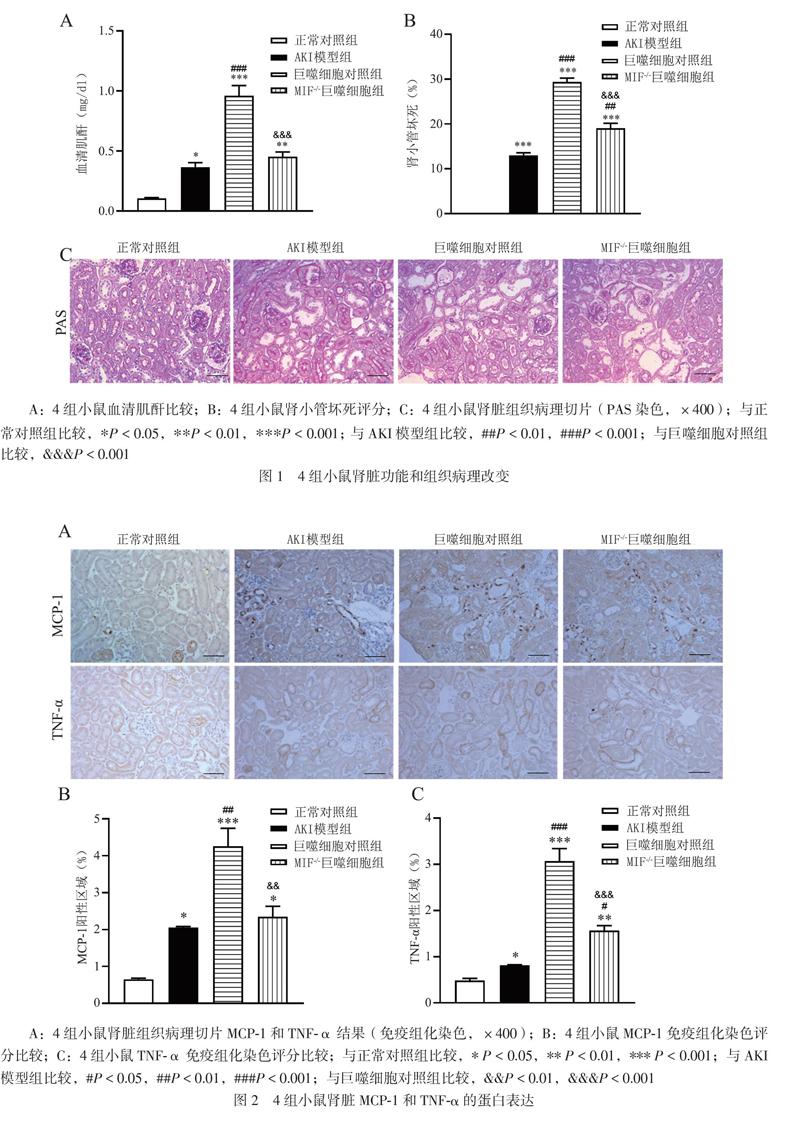
一、4组小鼠肾脏组织病理和血清肌酐的比较
与AKI模型组相比,巨噬细胞对照组小鼠的血清肌酐水平升高(t=8.318,P<0.001),MIF-/-巨噬细胞组小鼠的血清肌酐水平比较差异无统计学意义(t=1.195,P>0.999),巨噬细胞对照组和MIF-/-巨噬细胞组小鼠的肾小管坏死加重(t=14.770,P<0.001;t=5.427,P=0.004)。与巨噬细胞对照组相比,MIF-/-巨噬细胞组小鼠的血清肌酐水平降低(t=7.122,P<0.001),肾小管损伤程度减轻(t=9.347,P<0.001),见图1。给Cis-AKI小鼠注射巨噬细胞可加重小鼠肾小管结构和肾功能损伤,注射MIF-/-巨噬细胞则小鼠肾小管结构和腎功能损伤明显减轻,说明巨噬细胞加重Cis-AKI小鼠的肾小管结构和肾功能损伤是MIF依赖性的。
二、4组小鼠肾脏炎症因子的比较
免疫组化染色结果显示,与AKI模型组相比,巨噬细胞对照组小鼠肾脏中MCP-1和TNF-α的蛋白表达水平升高(t=5.435,P=0.004;t=10.700,P<0.001),MIF-/-巨噬细胞组小鼠肾脏中TNF-α的蛋白表达水平升高(t=0.708,P>0.999;t=3.562,P=0.044)。与巨噬细胞对照组相比,MIF-/-巨噬细胞组小鼠肾脏中MCP-1和TNF-α的蛋白表达水平降低(t=4.727,P=0.009;t=7.141,P<0.001),见图2。给Cis-AKI小鼠注射巨噬细胞可加重小鼠肾脏炎症损伤,注射MIF-/-巨噬细胞则小鼠肾脏炎症因子表达明显减轻,说明巨噬细胞加重Cis-AKI小鼠的肾脏炎症损伤是MIF依赖性的。
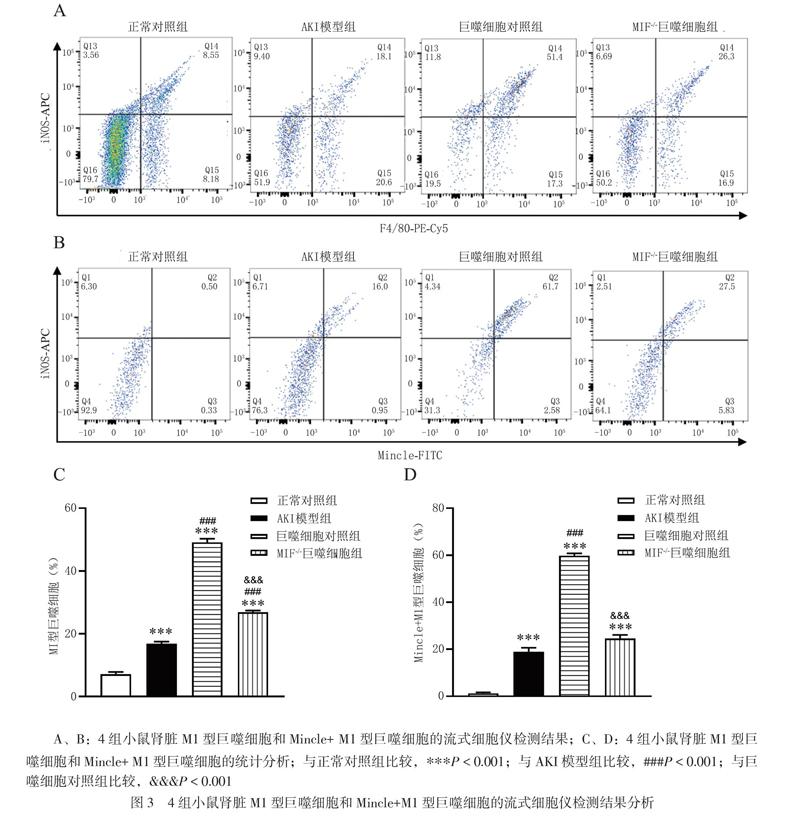
三、4组小鼠巨噬细胞比例的比较
流式分析结果显示,与AKI模型组相比,巨噬细胞对照组和MIF-/-巨噬细胞组小鼠肾脏中M1型巨噬细胞的比例升高(t=28.020,P<0.001;t=8.725,P<0.001)。与巨噬细胞对照组相比,MIF-/-巨噬细胞组小鼠肾脏中M1型巨噬细胞的比例降低(t=19.300,P<0.001),见图3。而且,与AKI模型组相比,巨噬细胞对照组小鼠肾脏中Mincle+M1型巨噬细胞的比例升高(t=23.650,P<0.001;t=3.252,P=0.070)。与巨噬细胞对照组相比,MIF-/-巨噬细胞组小鼠肾脏中Mincle+M1型巨噬细胞的比例降低(t=20.400,P<0.001),见图3。给Cis-AKI小鼠注射巨噬细胞可促进Mincle表达和M1型巨噬细胞激活,注射MIF-/-巨噬细胞则小鼠Mincle表达和M1型巨噬细胞比例明显减少,说明巨噬细胞促进Cis-AKI小鼠的肾脏Mincle表达和M1型巨噬细胞激活是MIF依赖性的。
讨论
AKI是由多种病因导致、涉及多学科的临床常见重症,是慢性肾脏病的主要原因。目前尚无AKI的特效治疗药物。缺血-再灌注损伤、肾毒性药物和感染是AKI的主要原因。炎症反应是AKI的重要表现,同时也是导致组织损伤的重要原因。受损组织及活性氧等募集炎性细胞浸入,同时分泌TNF-α、MCP-1、IL-1β和IL-6等炎性因子,而炎性因子可进一步募集白细胞渗入,导致肾组织损伤加重以及肾功能减退,因此抑制炎性细胞聚集及细胞因子释放对减轻AKI损伤具有重要意义。其中,巨噬细胞是AKI的关键参与者。虽然剔除巨噬细胞可减弱AKI带来的肾损伤,但是直接剔除巨噬细胞导致肾脏修复过程延缓,可能不是AKI的最佳治疗方案[11,13-17]。因此,研究巨噬细胞介导AKI的病理生理进展的分子机制是制定AKI新治疗策略的必要条件。MIF是由巨噬细胞分泌的位于炎症反应上游的调节因子[18]。我们的前期研究显示MIF在AKI小鼠肾组织中高表达,全身性MIF基因敲除或MIF药理学阻断对小鼠AKI有保护作用,MIF缺失后AKI小鼠的肾功能改善,巨噬细胞浸润和炎性细胞因子释放大幅减少[11-12]。
为了探究MIF依赖性巨噬细胞对顺铂诱导的AKI的影响,我们在AKI造模6h后将MIF+/+或MIF-/-巨噬细胞注射到小鼠体内,并在注射后第3日分别分析肾脏病理、功能和肾脏中的巨噬细胞浸润情况等,结果显示在顺铂诱导的AKI发展过程中MIF通过增强M1型巨噬细胞活化加重AKI。促炎因子(如TNF-α、MCP-1、IL-1β和IL-6等)在肾组织中的过量生成与AKI的发病机制有关。本研究在Cis-AKI小鼠模型中发现,与MIF-/-巨噬细胞组小鼠相比,巨噬细胞对照组小鼠的炎性细胞因子如MCP-1和TNF-α表达增高,肾小管损伤和血清肌酐升高更严重,提示巨噬细胞通过促进肾组织炎性反应进而加重AKI是MIF依赖性的,证实了MIF依赖性巨噬细胞在AKI中的致病作用。Mincle是M1型巨噬细胞激活的关键因素[3]。坏死肾小管细胞中的β-葡萄糖神经酰胺可以通过Mincle激活巨噬细胞,诱导小鼠AKI后的持续炎症[19]。MIF-/-巨噬细胞组小鼠肾脏Mincle+M1型巨噬细胞的比例较巨噬细胞对照组低,提示MIF能通过增强巨噬细胞中Mincle的表达促进AKI肾小管损伤阶段M1型巨噬细胞的活化。这些结果表明,MIF通过促进巨噬细胞活化,进一步增加了炎性细胞因子的产生,在很大程度上加剧了AKI。
综上所述,MIF依赖的巨噬细胞通过促进肾脏M1型巨噬细胞表面Mincle激活,增加促炎因子表达,加重AKI介导的肾脏结构和功能损伤。后续我们将进一步在小鼠巨噬细胞中特异性敲除MIF来验证MIF对巨噬细胞的调控机制,探讨可能的AKI治疗靶点。

