miR-591靶向ABCC3对肺癌细胞吉西他滨耐药性的影响
林辉雄 林海锋 逯 妍 王小泉 王闻通 (琼海市人民医院肿瘤内科,琼海571400)
肺癌是全世界癌症相关死亡的最常见原因[1]。目前,肺癌的标准治疗策略包括手术切除、化学疗法和放射疗法,化学疗法仍是晚期肺癌的常用治疗方案之一[2]。吉西他滨作为一线治疗药物已被用于肺癌治疗,但耐药性限制其临床应用,耐药性的确切机制尚未阐明,耐药性相关基因仍需进一步探索[3]。微小RNA(microRNA,miRNA)是内源性非编码RNA,是肿瘤发生发展的关键调控因素[4]。miR-591 在多种生物学和病理学过程中起重要作用,备受关注。研究表明,miR-591 在乳腺癌组织中表达下调,过表达miR-591 抑制乳腺癌细胞增殖和侵袭[5]。miR-591在肝癌细胞中呈低表达,可缓解肝癌细胞耐药性[6]。ABCC3 是ATP-结合盒(ATP-binding cassette,ABC)转运蛋白家族成员,ABC 转运蛋白在肿瘤细胞中高表达,可主动释放多种抗肿瘤药物,导致多药耐药[7]。ABCC3 在脑胶质瘤中表达升高,在非小细胞肺癌耐药细胞中高表达,干扰ABCC3表达可抑制膀胱癌细胞的集落形成,增强癌细胞对顺铂的敏感性[7-9]。但miR-591在肺癌细胞和肺癌吉西他滨耐药细胞中的表达及其对肺癌细胞吉西他滨耐药性的影响,以及miR-591 是否通过靶向调控ABCC3 表达影响肺癌细胞吉西他滨耐药性尚未明确。因此,本研究建立肺癌吉西他滨耐药细胞A549/GR,并观察miR-591 对其增殖、凋亡的影响,并结合ABCC3探索其分子机制。
1 材料与方法
1.1 材料 肺癌细胞株A549购自美国典型培养物保藏中心;吉西他滨(99.8%)购自中国食品药品检定研究院;RPMI1640 培养基、胎牛血清(FBS)购自美国Gibco 公司;吉西他滨购自美国Sigma-Aldrich公司;CCK-8 检测试剂盒购自日本Dojindo 公司;双荧光素酶试剂盒购自美国Promega 公司;Annexin VFITC/PI 细胞凋亡检测试剂盒购自江苏凯基生物公司;RIPA 裂解液购自上海碧云天生物技术研究所;BCA 蛋白测定试剂盒购自美国Pierce 公司;ABCC3、细胞周期蛋白D1(CyclinD1)、p21、B 细胞淋巴瘤/白血病-2(B cell lymphoma/lewkmia-2,Bcl-2)、Bcl-2 相关X 蛋白(Bcl-2 Associated X Protein,Bax)一抗购自美国CST公司。
1.2 方法
1.2.1 细胞培养与耐药细胞株(A549/GR)构建 采用含10%FBS、100 μg/ml链霉素和100 U/ml青霉素的RPMI1640 培养基培养A549 细胞,37℃、5%CO2的潮湿条件下培养。参考 WEI 等[10]方法构建A549/GR 细胞株,将对吉西他滨敏感的A549 亲本细胞连续暴露于浓度逐渐增加的吉西他滨中,初始浓度为10 nmol/L,6个月后增加至10 μmol/L。
1.2.2 细胞转染与处理 肺癌A549细胞或吉西他滨耐药细胞株A549/GR 接种于6 孔板,待细胞生长至70%融合,按照说明书,采用Lipofectamine2000将miR-591、si-ABCC3、pcDNA-ABCC3及相应阴性对照转染至细胞,吉西他滨(0.1 μmol/L)处理48 h。
1.2.3 CCK-8法检测细胞增殖 细胞以5×103个/孔接种于96 孔板,37℃下采用不同浓度吉西他滨(0.01、0.1、1、2、5、10 μmo/lL)处理A549、A549/GR细胞48 h,或收集转染后的A549/GR细胞,10 μ/l孔加入CCK-8 溶液,37℃、5%CO2孵育2 h,酶标仪检测450 nm处吸光度(OD)值,计算细胞增殖抑制率和半数抑制浓度(IC50)。
1.2.4 qRT-PCR 检测 miR-591 和 ABCC3 mRNA 表达 采用 TRIzol 提取 A549 和 A549/GR 细胞总RNA,采用PrimeScripte RT 试剂盒进行逆转录,SYBR®Premix Ex Taq 试剂盒进行 qPCR 反应,以GAPDH 为内参,2-ΔΔCt法计算基因相对表达。引物序列:miR-591 F:5'-GAGGTAGACCATGGGTTCTCA-3',R:5'-AGCCAGGGAGTCCACAGTTA-3';U6 F:5'-CTCGCTTCGGCAGCACA-3',R:5'-AACGCTTCACGAATTTGCGT-3';ABCC3 F:5'-CCTTTGCCAACTTTCTCTGC-3',R:5'-AGGGCACTCAGCTGTCTCAT-3';GAPDH F:5'-CCACCCATGGCAAATTCCATGGCA-3',R:5'-TCTAGACGGCAGGTCAGGTCCACC-3'。
1.2.5 TargetScan 预测和双荧光素酶报告实验 TargetScan 网站(http://www. targetscan. org/)预测 miR-591 靶基因,ABCC3 3'UTR 中预测 miR-591的假定结合位点。分别构建野生(WT)和突变(MUT)-ABCC3 质粒,采用Lipofectamine2000 试剂共转 染 WT-ABCC3 或 MUT-ABCC3 与 miR-591 模 拟 物或miR 阴性对照(NC),转染后48 h,双荧光素酶报告分析试剂盒评估荧光素酶活性。
1.2.6 流式细胞术检测细胞凋亡 A549/GR 细胞在 Binding Buffer 缓冲液中稀释至 1×105个/ml,取100 μl 细胞悬液加入 5 μl Annexin V-FITC 和 5 μl PI工作液,室温避光孵育15 min,BD FACSCalibur 流式细胞仪分析染色细胞。
1.2.7 Western blot 检 测 ABCC3、CyclinD1、p21、Bcl-2、Bax 蛋白表达 采用冷磷酸盐缓冲液洗涤细胞2次,与含有蛋白酶抑制剂混合物的冷RIPA 缓冲液孵育,冰上裂解30 min,4℃ 离心15 min。采用BCA 蛋白测定试剂盒测定上清中蛋白浓度,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(8%)分离等量蛋白(20 μg),转至PVDF膜,加入ABCC3、CyclinD1、p21、Bcl-2、Bax一抗(1∶1 000)和GAPDH(1∶5 000)4℃ 孵育过夜,加入相应二抗室温孵育2 h,采用增强的化学发光检测剂显影,ImageJ软件定量分析。
1.3 统计学分析 采用SPSS22.0软件进行统计学分析,数据以表示。两组间比较采用t检验,多组间比较采用单因素方差分析,组间多重比较采用SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度吉西他滨对肺癌A549 细胞和肺癌吉西他滨耐药细胞A549/GR抑制率的影响 CCK-8检测结果显示,与A549细胞相比,0.01、0.1、1、2、5、10 μmo/lL 吉西他滨显著降低A549/GR 细胞增殖抑制率;吉西他滨作用的A549/GR 细胞IC50显著高于A549细胞(P<0.05,表1)。
表1 不同浓度吉西他滨对肺癌细胞和肺癌吉西他滨耐药细胞抑制率的影响(,n=9)Tab.1 Effects of different concentrations of gemcitabine on lung cancer cells and lung cancer gemcitabine-resistant cells(,n=9)
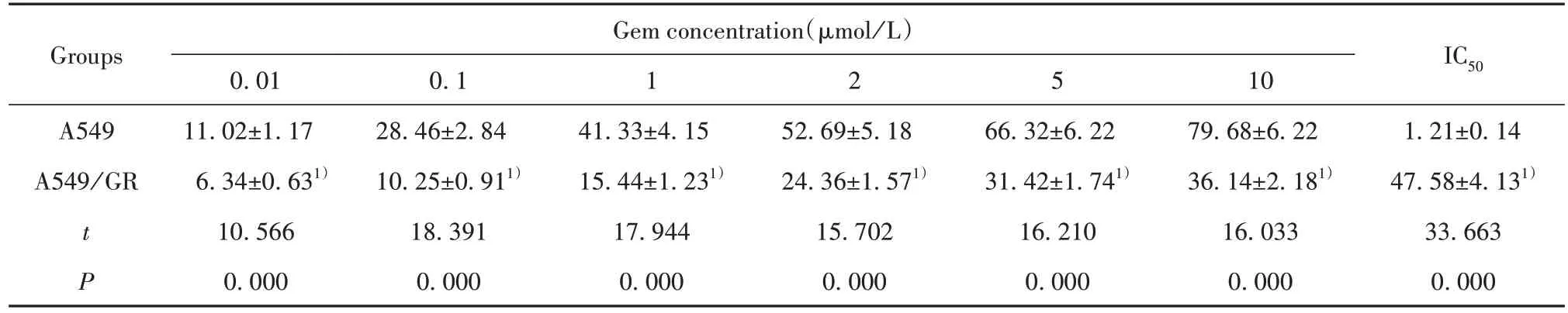
表1 不同浓度吉西他滨对肺癌细胞和肺癌吉西他滨耐药细胞抑制率的影响(,n=9)Tab.1 Effects of different concentrations of gemcitabine on lung cancer cells and lung cancer gemcitabine-resistant cells(,n=9)
Note:Compared with A549,1)P<0.05.
Groups Gem concentration(μmol/L)1 2 5 IC50 1.21±0.14 47.58±4.131)33.663 0.000 A549 A549/GR t P 0.01 11.02±1.17 6.34±0.631)10.566 0.000 0.1 28.46±2.84 10.25±0.911)18.391 0.000 41.33±4.15 15.44±1.231)17.944 0.000 52.69±5.18 24.36±1.571)15.702 0.000 66.32±6.22 31.42±1.741)16.210 0.000 10 79.68±6.22 36.14±2.181)16.033 0.000
2.2 miR-591和ABCC3 在肺癌A549 细胞和肺癌吉西他滨耐药细胞A549/GR 中的表达 qRT-PCR 和Western blot 检测结果显示,与A549 细胞相比,A549/GR 细胞中miR-591 表达明显减少,ABCC3 mRNA和ABCC3蛋白表达显著增加(P<0.05,图1)。
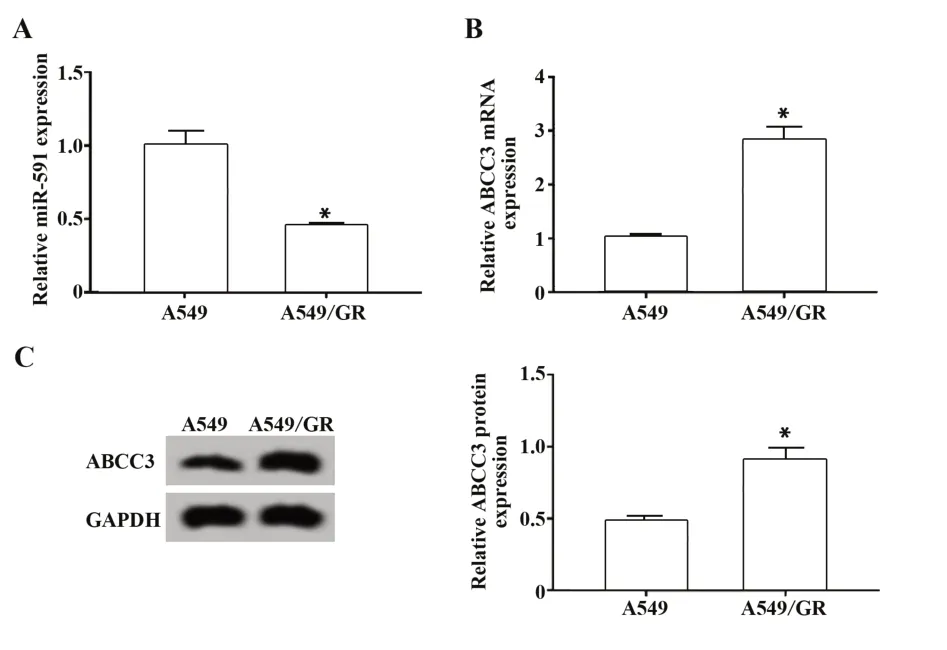
图1 肺癌A549细胞和肺癌吉西他滨耐药细胞A549/GR中miR-591、ABCC3表达Fig.1 Expressions of miR-591 and ABCC3 in lung cancer cells A549 and lung cancer gemcitabine-resistant cells A549/GR
2.3 miR-591靶向调控ABCC3表达 TargetScan 预测发现,miR-591 与ABCC3 3'UTR 区碱基可形成互补配对(图2A)。双荧光素酶报告实验结果显示,与miR-NC 组相比,miR-591 明显降低 WT-ABCC3 细胞荧光素酶相对活性(P<0.05),而对MUT-ABCC3 细胞荧光素酶相对活性无显著影响(图2B)。Western blot检测结果表明,与miR-NC 组相比,转染miR-591明显降低ABCC3 蛋白表达;与anti-miR-NC 组相比,转染anti-miR-591 显著提高ABCC3 蛋白表达(P<0.05,图2C)。

图2 miR-591靶向调控ABCC3表达Fig.2 miR-591 targeting regulates ABCC3 expression
2.4 miR-591 过表达联合吉西他滨(0.1 μmol/L)对A549/GR细胞和A549细胞增殖和凋亡的影响与 Con 组相比,Gem+miR-NC 组、Gem+miR-591 组A549 细胞和 A549/GR 细胞中 miR-591 表达明显降低,抑制率、凋亡率、p21、Bax 蛋白表达显著提高,CyclinD1、Bcl-2 蛋白水平明显降低;与Gem+miR-NC组相比,Gem+miR-591 组 A549 细胞和 A549/GR 细胞miR-591表达、抑制率、凋亡率、p21、Bax蛋白表达明显提高,CyclinD1、Bcl-2 蛋白水平显著降低(P<0.05,图3、表2)。
表2 miR-591 过表达联合吉西他滨对A549/GR 细胞和A549细胞增殖和凋亡的影响(,n=9,%)Tab.2 Effects of miR-591 overexpression combined with gemcitabine on proliferation and apoptosis of A549/GR cells and A549 cells(,n=9,%)
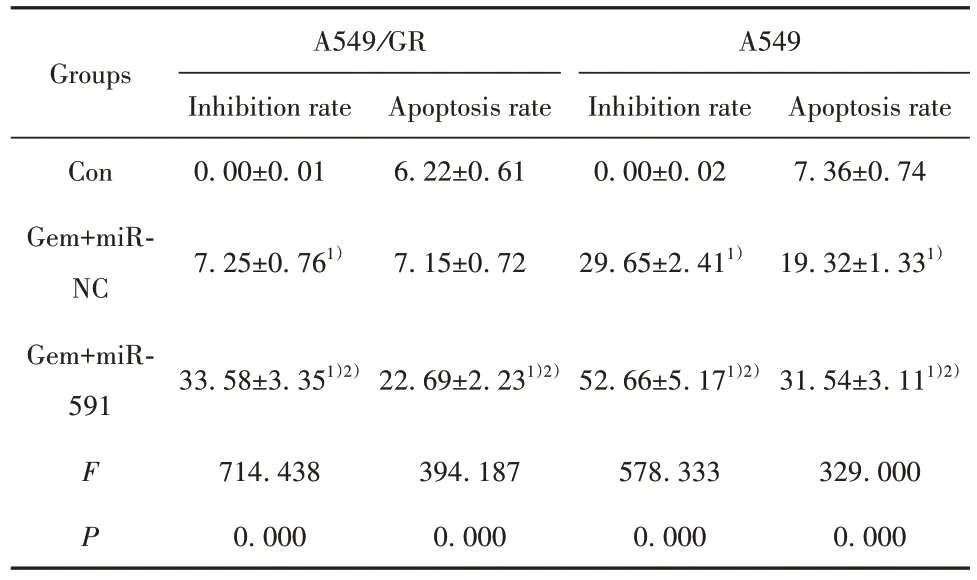
表2 miR-591 过表达联合吉西他滨对A549/GR 细胞和A549细胞增殖和凋亡的影响(,n=9,%)Tab.2 Effects of miR-591 overexpression combined with gemcitabine on proliferation and apoptosis of A549/GR cells and A549 cells(,n=9,%)
Note:Compared with Con,1)P<0.05;compared with Gem+miR-NC,2)P<0.05.
Groups Con Gem+miRNC Gem+miR-591 A549/GR Inhibition rate 0.00±0.01 Apoptosis rate 6.22±0.61 A549 Inhibition rate 0.00±0.02 Apoptosis rate 7.36±0.74 7.25±0.761)7.15±0.7229.65±2.411)19.32±1.331)33.58±3.351)2)22.69±2.231)2)52.66±5.171)2)31.54±3.111)2)329.000 0.000 F P 714.438 0.000 394.187 0.000 578.333 0.000

图3 miR-591 过表达联合吉西他滨对A549/GR 细胞和A549细胞增殖和凋亡的影响Fig.3 Effect of miR-591 overexpression combined with gemcitabine on proliferation and apoptosis of A549/GR cells and A549 cells
2.5 干扰ABCC3 表达联合吉西他滨(0.1 μmol/L)对A549/GR细胞和A549细胞增殖和凋亡的影响与 Con 组 相 比 ,Gem+si-NC 组 、Gem+si-ABCC3 组A549/GR 细胞和A549 细胞抑制率、凋亡率、ABCC3、p21、Bax蛋白水平明显提高,CyclinD1、Bcl-2蛋白表达显著降低;与Gem+si-NC 组相比,Gem+si-ABCC3 组 A549/GR 细胞和 A549 细胞抑制率、凋亡率、p21、Bax 蛋白水平明显提高,ABCC3、CyclinD1、Bcl-2蛋白表达明显降低(P<0.05,图4、表3)。
表3 干扰ABCC3 表达联合吉西他滨对A549/GR 细胞和A549细胞增殖和凋亡的影响(,n=9,%)Tab.3 Effects of interfering with ABCC3 expression com⁃bined with gemcitabine on proliferation and apop⁃tosis of A549/GR cells and A549 cells(,n=9,%)

表3 干扰ABCC3 表达联合吉西他滨对A549/GR 细胞和A549细胞增殖和凋亡的影响(,n=9,%)Tab.3 Effects of interfering with ABCC3 expression com⁃bined with gemcitabine on proliferation and apop⁃tosis of A549/GR cells and A549 cells(,n=9,%)
Note:Compared with Con,1)P<0.05;compared with Gem+si-NC,2)P<0.05.
Groups Con Gem+si-NC Gem+si-ABCC3 A549/GR Inhibition rate 0.00±0.01 9.87±0.991)Apoptosis rate 6.24±0.61 6.58±0.66 A549 Inhibition rate 0.00±0.02 27.14±2.651)Apoptosis rate 7.14±0.71 18.69±1.331)31.25±3.121)2)19.45±1.881)2)48.33±4.271)2)27.31±2.411)2)342.207 0.000 F P 643.036 0.000 352.630 0.000 627.429 0.000
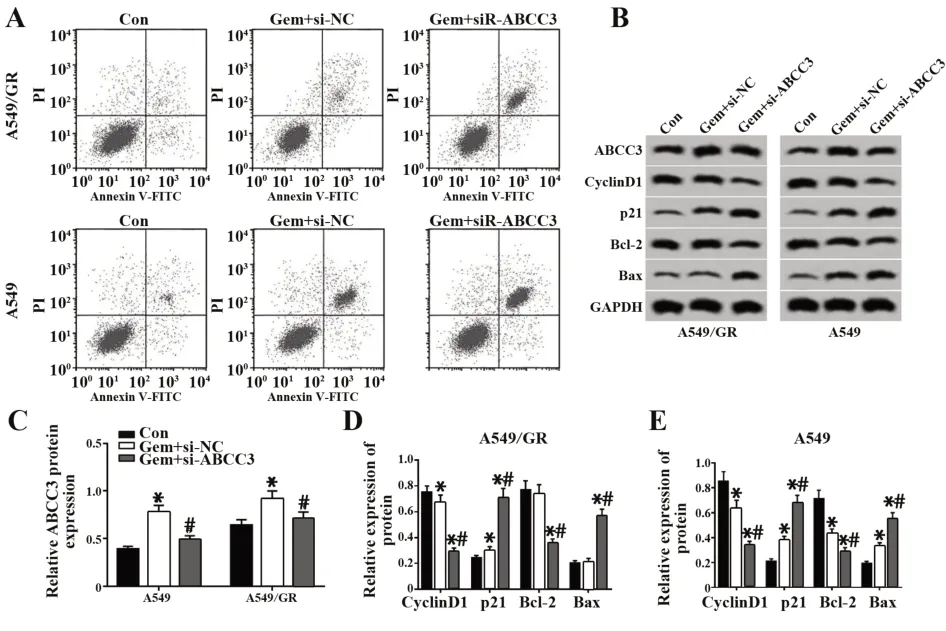
图4 干扰ABCC3 表达联合吉西他滨对A549/GR 细胞和A549细胞增殖和凋亡的影响Fig.4 Effect of interfering with ABCC3 expression com⁃bined with gemcitabine on proliferation and apop⁃tosis of A549/GR cells and A549 cells
2.6 ABCC3 过表达逆转miR-591 过表达对肺癌吉西他滨耐药细胞A549/GR 吉西他滨耐药性的作用 与 Gem+miR-NC 组 相 比 ,Gem+miR-591 组A549/GR 细胞 ABCC3、CyclinD1、Bcl-2 蛋白表达明显减少,细胞抑制率、凋亡率、p21、Bax 蛋白水平显著提高(P<0.05),与Gem+miR-591+pcDNA 组相比,Gem+miR-591+pcDNA-ABCC3 组 A549/GR 细 胞ABCC3、CyclinD1、Bcl-2 蛋白水平明显升高,细胞抑制率、凋亡率、p21、Bax蛋白表达显著降低(P<0.05,表4、图5)。
表4 ABCC3 过表达逆转miR-591 过表达在肺癌吉西他滨耐药细胞A549/GR中的作用(,n=9,%)Tab.4 ABCC3 overexpression reversed miR-591 overex⁃pression on lung cancer gemcitabine resistant cells A549/GR(,n=9,%)

表4 ABCC3 过表达逆转miR-591 过表达在肺癌吉西他滨耐药细胞A549/GR中的作用(,n=9,%)Tab.4 ABCC3 overexpression reversed miR-591 overex⁃pression on lung cancer gemcitabine resistant cells A549/GR(,n=9,%)
Note:Compared with Gem+miR-NC,1)P<0.05;compared with Gem+miR-591+pcDNA,2)P<0.05.
Apoptosis rate 6.935±0.71 21.36±2.141)23.65±2.33 13.28±1.332)172.497 0.000 Groups Gem+miR-NC Gem+miR-591 Gem+miR-591+pcDNA Gem+miR-591+pcDNA-ABCC3 F P Inhibition rate 10.65±1.13 35.58±3.481)37.19±3.71 19.25±1.282)207.463 0.000
3 讨论
吉西他滨作为一线化疗药物,广泛用于多种癌症治疗,包括肺癌治疗[11-12]。尽管患者治疗开始时对吉西他滨反应良好,但部分患者最终会产生继发性耐药,导致治疗失败,并最终导致死亡[13]。因此,吉西他滨耐药性分子机制的进一步研究将促进新型治疗方法开发并改善患者预后。本研究在体外建立肺癌吉西他滨耐药细胞株A549/GR,发现不同浓度吉西他滨处理的A549/GR 细胞增殖抑制率明显低于A549 亲本细胞,IC50显著高于A549 细胞,说明耐药A549/GR 细胞对吉西他滨敏感性显著降低。本研究考察 miR-591 和 ABCC3 在 A549/GR 细胞中的表达,及其对细胞耐药性的影响,有助于克服肺癌吉西他滨耐药的靶向疗法开发。
肺癌耐药发病机制中,miRNA 失调起关键作用[14]。已确定多种miRNA 失调与肺癌化疗耐药性有关,如 miR-324-5p、miR-140-5p、miR-326 等[15-17]。既往研究表明,miR-591 在恶性胸膜间皮瘤组织中明显下调,是恶性胸膜间皮瘤中一种有效的肿瘤抑制因子[18]。miR-591 与乳腺癌放疗抵抗性密切相关[19]。耐紫杉醇的卵巢癌细胞中,miR-591 显著下调,恢复miR-591 表达可使耐药性卵巢癌细胞对紫杉醇重新敏感,并可能通过抑制其靶基因ZEB1 降低癌细胞迁移和增殖,但其在肺癌吉西他滨耐药细胞中的表达和机制尚未阐明[20]。本研究中,与A549细胞相比,A549/GR细胞中miR-591表达明显减少,提示miR-591 影响肺癌细胞对吉西他滨的敏感性。功能实验结果发现,miR-591 过表达可抑制吉西他滨作用的A549/GR 细胞增殖,并诱导细胞凋亡,从而降低肺癌细胞对吉西他滨的耐药性,与HUH等[20]报道结论相符。
转运蛋白ABC 家族表达增加与化疗失败有关,ABCC3 与多种耐药性和较差的临床反应联系密切[21]。悬浮状态使乳腺癌细胞MDA-MB-231耐药性增强,也可诱导ABCC3 表达增加,而ABCC3 沉默显著降低悬浮MDA-MB-231细胞耐药性[22]。人膀胱癌组织中ABCC3 mRNA 和蛋白水平显著高于正常组织,过表达ABCC3 可促进细胞增殖、耐药和需氧糖酵解,并与膀胱癌患者不良预后有关[23]。敲除乳腺癌化疗患者ABCC3,化疗药物在乳腺癌细胞中的保留和细胞凋亡明显增加,敏感性更高。本实验A549/GR细胞中ABCC3 mRNA 和ABCC3 蛋白表达显著增加,与既往报道一致[9]。干扰ABCC3 表达可抑制吉西他滨作用的A549/GR 细胞增殖,并促进其凋亡,增强肺癌细胞对吉西他滨的敏感性,减轻其耐药程度。进一步研究发现,miR-591 可靶向调控ABCC3表达。ABCC3过表达逆转miR-591过表达对吉西他滨作用的A549/GR 细胞增殖、凋亡、CyclinD1、p21、Bcl-2、Bax 蛋白表达的影响。说明miR-591 逆转肺癌细胞对吉西他滨的耐药性可能通过靶向调控ABCC3表达实现。
综上所述,miR-591 在肺癌吉西他滨耐药细胞A549/GR 中表达下调,过表达miR-591 可抑制吉西他滨诱导的A549/GR 细胞增殖,并促进其凋亡,减轻肺癌细胞对吉西他滨的耐药性,机制与靶向调控ABCC3 表达有关,为吉西他滨治疗肺癌的耐药性提供了新见解。

