Sox9 基因过表达对人脂肪干细胞增殖、凋亡及成软骨分化的影响及机制研究①
李春亮 秦 凤 齐普良 孙凯华 韩雪来 张金柱 刘延蓉 李钊伟 王 凯 李泽清
(青海省人民医院骨科,西宁810001)
创伤性关节炎、关节退行性变、风湿性关节炎等以关节软骨的退化变性为主要病理变化的疾病具有较高的发病率和致残率,不仅影响患者的工作与生活,也造成了严重的社会负担,成为临床骨科工作中的重要难题[1-2]。目前常用的治疗方式有保守药物治疗及人工关节置换,但存在不良反应严重及假体松动、磨损等缺陷[3]。近年来组织工程学不断发展,为骨科软骨缺损的治疗提供了新方向。人脂肪干细胞(human adipose derived stem cells,hAD⁃SCs)是具有多向分化潜能的干细胞,有促进组织细胞的修复和细胞再生功能,也是软骨组织工程发展中常用的种子细胞,有取材方便、增殖能力强的特点[4]。性别决定区Y 框蛋白9(sex determining region Y box protein 9,Sox9)基因是人们发现的第1 个具有内含子的Sox(sry-type HMG box)蛋白家族成员,对于促进软骨的分化、维持软骨细胞表型方面有重要作用[5]。研究显示,Sox9 基因可与软骨特异性基因中增强子元件结合,促进关节软骨细胞再分化[6]。目前关于hADSCs 向软骨分化的相关研究较多,但关于Sox9 基因对hADSCs 向软骨分化影响的相关研究较少。因此,本研究通过Sox9 基因过表达慢病毒液感染hADSCs,观察对hADSCs 增殖、凋亡、成软骨分化的影响,并探讨机制,旨在为hADSCs 成软骨分化提供新的途径。
1 材料与方法
1.1 材料
1.1.1 细胞 hADSCs 取自青海省人民医院骨科膝关节置换手术中废弃脂肪。
1.1.2 药物、主要试剂和仪器 10%胎牛血清(南京科佰生物科技);青-链霉素混合液(河北华北制药);含有Sox9 基因的慢病毒载体(Lenti-Sox9-EGFP)及空载体慢病毒(Lenti-EGFP)(深圳市默赛尔生物医学科技);辣根过氧化物酶标记IgG 抗体(广州健仑生物科技);Ⅱ型胶原多克隆抗体、GAP⁃DH 单克隆抗体(上海信帆生物科技);转化生长因子 β1(transforming growth factor-β1,TGF-β1)抗体、信号转导蛋白 3(sekelsky mothers against dpp 3,Smad 3)抗体(上海远慕生物科技);逆转录试剂盒(海联迈生物工程);BCA 蛋白定量试剂盒(北京普利莱基因技术)。ELx 800 酶标仪(美国Bio-Tek 公司);Biosciences FACSCanto Ⅱ流式细胞仪(美国BD公司);ABI 7900 实时荧光定量PCR 仪(美国ABI 公司);E-Gel Imager 凝胶成像仪(美国 Invitrogen 公司);AE31 EF-INV 倒置荧光显微镜(香港麦克奥迪实业集团)。
1.2 方法
1.2.1 hADSCs 培养及鉴定[7]无菌条件下获取脂肪组织,以胰蛋白酶消化(37℃水浴60 min),8 000/rmin离心5 min,离心半径12.0 cm,弃去漂浮脂肪细胞和上清液,DMEM 培养液(含10%胎牛血清、100 μg/ml 青霉素与100 μg/ml 链霉素)重悬细胞,接种于培养皿中,密度为3.0×104个/cm2,37℃,5%CO2培养箱中传代培养。观察细胞生长状态,至细胞融合度达70%,按照1∶3比例传代,倒置显微镜下观察细胞形态。取第3 代细胞,PBS 重悬细胞,调整细胞密度为 1×106个/ml,分别加入 CD29、CD44、CD105 单抗和相应同型对照抗体,室温避光孵育30 min,PBS 洗涤后重悬细胞,于流式细胞仪上检测细胞表面标志物表达情况。
1.2.2 细胞转染及分组 取融合度达70%细胞,消化、重悬调整密度为 1.0×107个/ml 接种于 24 孔板,每孔5 个复孔,分3 组,分别为过表达组、空载组和对照组,同条件培养24 h。过表达组、空载组和对照组分别加入 50 μl Lenti-Sox9-EGFP、Lenti-EGFP、无菌生理盐水,37℃继续培养48 h,倒置荧光显微镜下确定转染效率>70%进行后续实验。
1.2.3 Western blot 检测Sox9 蛋白表达情况 取各组感染48 h 后的细胞,加入裂解液充分裂解,4℃下8 000/rmin离心5 min,离心半径12.0 cm,收集上层清液,BCA 法检测蛋白浓度,转移至PVDF 膜,5%脱脂奶粉封闭2 h,TBST 缓冲液冲洗2 遍,加入Sox9一抗(1∶1 000),4℃ 过夜,TBST 缓冲液洗膜 3 次,10 min/次,加入二抗(1∶5 000),室温孵育1 h,TBST缓冲液洗膜3 次,10 min/次,加入ECL 试剂,曝光3 min,暗室中显影,Image J软件分析条带灰度值,以Sox9 灰 度 值/GAPDH 灰 度 值 为 Sox9 蛋 白 相 对 表达量。
1.2.4 MTT 试验检测细胞增殖情况 取稳定感染过表达组、空载组与对照组细胞,胰蛋白酶消化后接种于 96 孔板,密度为 1.0×104个/ml,每组 5 个复孔,每孔分别培养24 h、48 h、72 h 时加入5 mg/ml的MTT 溶液 20 μl,继续培养 4 h 后,弃培养液,加入150 μl DMSO 溶液,充分溶解后使用酶标仪检测490 nm 波长处吸光度(A)值(A 值为活细胞数量,其值越高表示细胞增殖能力越强)。
1.2.5 Western blot 检测培养不同时间 TGF-β1、Smad 3 蛋白表达情况 稳定转染各组细胞,分别在培养24 h、48 h、72 h 后检测 TGF-β1、Smad 3 蛋白相对表达量,具体方法同1.2.3。
1.2.6 流式细胞技术检测Sox9 过表达对hADSCs细胞凋亡的影响 收集干预48 h 的过表达组、空载组及对照组细胞,PBS 洗涤3 次后重悬,8 000 r/min离心5 min,加入预冷70%乙醇,4℃固定过夜,加入RNA 酶 100 μg/ml,37℃ 孵育 30 min,加入 5 μl An⁃nexin V-FITC,室温避光15 min,加入7-氨基放射线菌素D 5 μl,1 h 内流式细胞仪检测,统计右上、下象限细胞凋亡率。
1.2.7 成软骨诱导分化 取第3 代过表达组、空载组及对照组细胞,接种于24 孔板,密度调整为1.0×107个/ml,加入成软骨诱导培养基(含高糖DMEM,1% 胎牛血清,10 μg TGF-β1,50 nmol/L 抗坏血酸,1%青链霉素原液,6.25 mg/L 胰岛素),置于37℃、5%CO2恒温、恒湿箱中培养,诱导分化2 周,每72 h换液1次,显微镜观察。
1.2.8 甲苯胺蓝染色及Ⅱ型胶原免疫组化染色观察 甲苯胺蓝染色:收集诱导分化2周各组细胞,加入4%多聚甲醛固定细胞,10 min 后水洗,甲苯胺蓝染色15 min。Ⅱ型胶原免疫组化染色:4%多聚甲醛固定细胞,蒸馏水洗涤,0.2 U/ml 软骨素酶ABC,37℃孵育30 min,3%H2O2甲醇去除内源性过氧化物酶,蒸馏水洗涤,5%BSA室温作用30 min,加入Ⅱ型胶原多克隆抗体(1∶500),4℃ 孵育过夜,实施免疫组化染色。
1.2.9 Western blot 检测诱导分化 2 周后 TGF-β1、Smad 3 蛋白表达情况 检测各组诱导分化2 周后TGF-β1、Smad 3蛋白相对表达量,方法同1.2.3。
1.3 统计学分析 数据的统计及处理使用SPSS 24.0,计量数据以表示,多样本计量资料比较采用单因素方差分析,两两样本比较采用SNK-q检验。P<0.05表示差异有统计学意义。
2 结果
2.1 hADSCs 细胞形态及鉴定 显微镜观察,原代hADSCs 细胞培养0.5 d 贴壁生长,呈圆或椭圆形;培养第3 天增殖原代细胞呈纤维细胞样生长,为束状;培养第7 天,细胞增殖速度明显增快,呈旋涡状排列,见图1。流式细胞技术检测第3 代hADSCs 各表面标志物CD29、CD44、CD105 为阳性表达,表达率分别为99.82%、99.50%、98.26%。见图2。

图1 hADSCs形态观察(×40)Fig.1 Morphological observation of hADSCs(×40)

图2 流式细胞技术鉴定第3代hADSCs表面标志物Fig.2 Identification of surface markers of third genera⁃tion hADSCs by flow cytometry
2.2 Sox9 蛋白相对表达情况比较 感染48 h 后3 组Sox9 蛋白相对表达量比较,差异有统计学意义(P<0.001),与空载组和对照组比较,过表达组Sox9蛋白相对表达量更高,差异均有统计学意义(P<0.001),空载组和对照组比较,差异无统计学意义(P>0.05)。见图3、表1。
表1 Sox9 蛋白相对表达情况比较()Tab.1 Comparison of relative expression of Sox9 protein()

表1 Sox9 蛋白相对表达情况比较()Tab.1 Comparison of relative expression of Sox9 protein()
Note:Compared with control group,1)P<0.001;compared with no-load group,2)P<0.001.
Relative protein expression 0.32±0.10 0.34±0.11 0.90±0.151)2)36.457<0.001 Groups Control No-load Overexpression F P
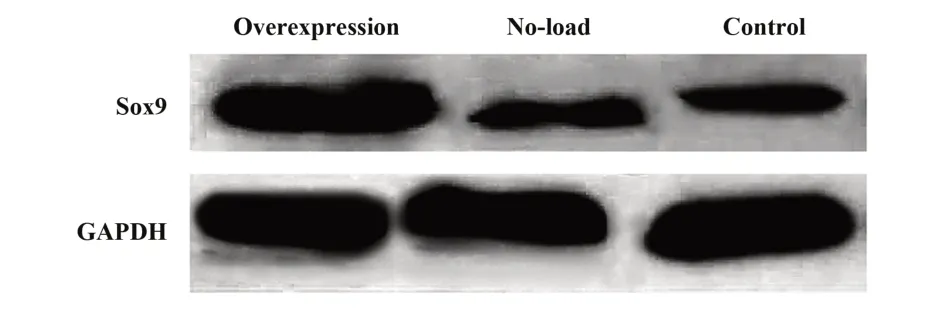
图3 各组细胞Western blot图Fig.3 Western blot of cells in each group
2.3 各组细胞不同时刻MTT 试验A 值比较 3 组MTT 试验A 值均随时间延长而升高(P<0.001);与对照组和空载组比较,过表达组 24、48、72 h 的 A 值更高,差异均有统计学意义(P<0.001);对照组和空载组不同时间、组间的A值比较,差异无统计学意义(P>0.05)。见表2。
表2 各组细胞不同时刻MTT试验A值比较(,%)Tab.2 Comparison of MTT test A values of cells in each group at different times(,%)
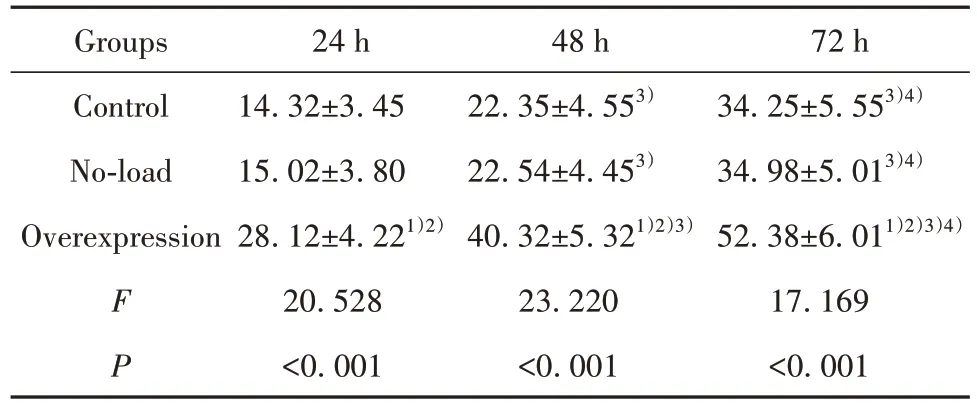
表2 各组细胞不同时刻MTT试验A值比较(,%)Tab.2 Comparison of MTT test A values of cells in each group at different times(,%)
Note:Compared with control group,1)P<0.05;compared with no-load group,2)P<0.05;compared with 24 h,3)P<0.05;compared with 48 h,4)P<0.05.
72 h 34.25±5.553)4)34.98±5.013)4)52.38±6.011)2)3)4)17.169<0.001 Groups Control No-load Overexpression F P 24 h 14.32±3.45 15.02±3.80 28.12±4.221)2)20.528<0.001 48 h 22.35±4.553)22.54±4.453)40.32±5.321)2)3)23.220<0.001
2.4 各组细胞不同时刻TGF-β1、Smad 3 蛋白相对表达量比较 过表达组TGF-β1、Smad 3蛋白相对表达量随时间延长而升高(P<0.05);与空载组和对照组比较,过表达组24 h、48 h、72 h TGF-β1、Smad 3蛋白相对表达量更高,差异有统计学意义(P<0.05);对照组和空载组不同时间、组间的A值比较,差异无统计学意义(P>0.05)。见图4、表3。
表3 各组细胞不同时刻TGF-β1、Smad 3 蛋白相对表达量比较()Tab.3 Comparison of the relative expression of TGF-β1 and Smad 3 protein in different time points()

表3 各组细胞不同时刻TGF-β1、Smad 3 蛋白相对表达量比较()Tab.3 Comparison of the relative expression of TGF-β1 and Smad 3 protein in different time points()
Note:Compared with control group and no-load group for 24 h,1)P<0.001;Compared with control group and no-load group for 48 h,2)P<0.001;Compared with control group and no-load group for 72 h,3)P<0.001;Compared with 24 h in overexpression group,4)P<0.001;Compared with 48 h in overexpression group,5)P<0.001.
Smad 3 0.33±0.04 0.35±0.05 0.36±0.06 0.31±0.05 0.32±0.04 0.35±0.06 0.45±0.041)0.66±0.052)4)0.88±0.083)4)5)14.164<0.001 Groups Control No-load Overexpression Time(h)24 48 72 24 48 72 24 48 72 F P TGF-β1 0.28±0.05 0.30±0.04 0.31±0.06 0.29±0.06 0.31±0.05 0.32±0.06 0.54±0.081)0.75±0.092)4)0.92±0.013)4)5)47.830<0.001
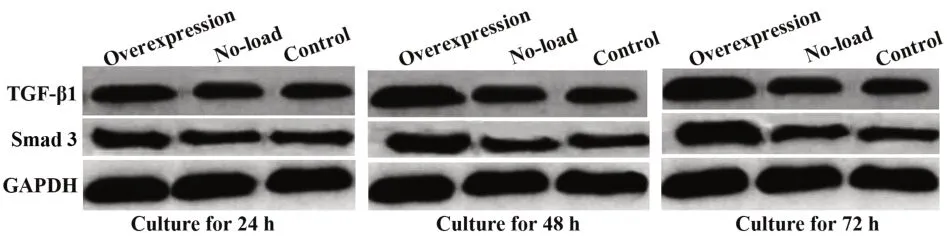
图4 各组细胞不同时刻Western blot图Fig.4 Western blot at different time points of each group of cells
2.5 各组细胞凋亡情况比较 对照组的凋亡率为(24.36±4.32)% ,空 载 组 的 凋 亡 率 为(23.25±4.32)%,过表达组的凋亡率为(10.33±3.19)%,3组的凋亡率比较,差异有统计学意义(F=21.481,P<0.001),与对照组和空载组比较,过表达组的凋亡率 更 低(t空白组vs干预组=6.602,P<0.001;t对照组vs干预组=6.145,P<0.001),对照组与空载组的凋亡率比较,差异无统计学意义(P>0.05)。见图5。

图5 各组细胞凋亡情况Fig.5 Apoptosis of each group
2.6 hADSCs 成软骨分化诱导结果 成软骨诱导分化2周后,甲苯胺蓝染色显示过表达组hADSCs胞浆及细胞核为蓝紫色,空载组和对照组为微弱淡蓝色,提示Sox9 过表达后的hADSCs 有蛋白多糖表达。Ⅱ型胶原免疫细胞化学染色结果显示过表达组为强阳性,Ⅱ型胶原含量显著升高,胞浆中有较多粗大黄棕色颗粒,空载组和对照组为弱阳性。见图6、图7。
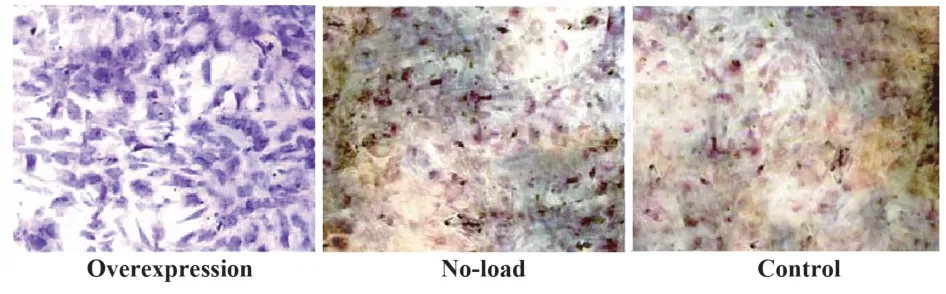
图6 甲苯胺蓝染色(×100)Fig.6 Toluidine blue staining(×100)
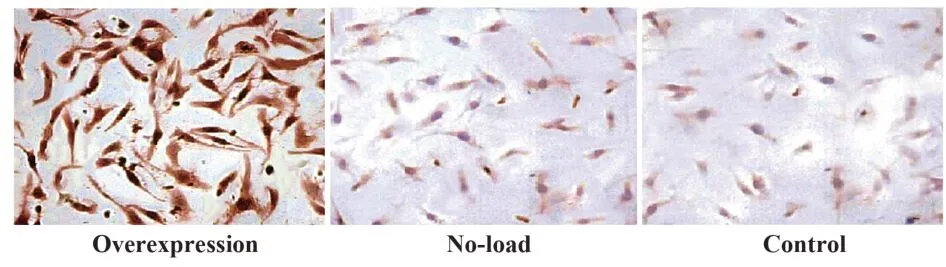
图7 Ⅱ型胶原免疫细胞化学染色(×100)Fig.7 Type Ⅱ collagen immunocytochemical staining(×100)
2.7 各组TGF-β1、Smad 3 蛋白相对表达量比较3 组的 TGF-β1、Smad 3 蛋白相对表达量比较,差异有统计学意义(P<0.001),与对照组和空载组比较,过表达组的TGF-β1、Smad 3 蛋白相对表达量较高,差异具有统计学意义(P<0.001),对照组与空载组蛋白相对表达量比较,差异无统计学意义(P>0.05)。见表4、图8。

图8 各组Western blot图Fig.8 Western blot of each group
表4 各组TGF-β1、Smad 3 蛋白相对表达量比较()Tab.4 Comparison of relative expression levels of TGF-β1 and Smad 3 proteins in each group()
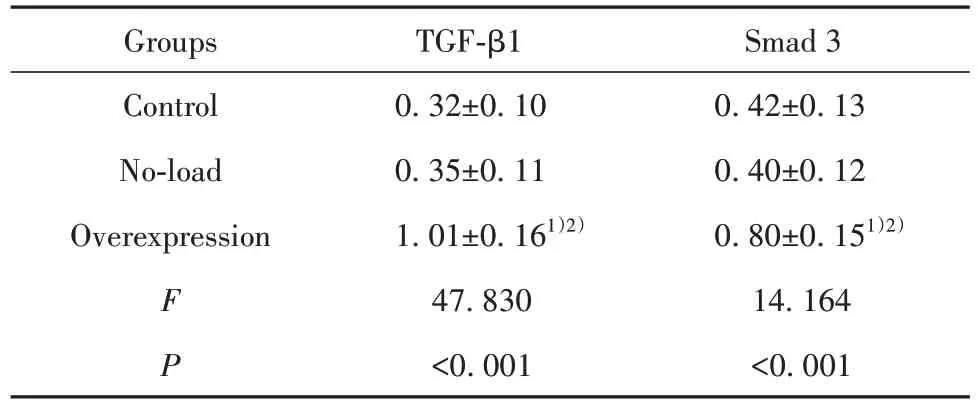
表4 各组TGF-β1、Smad 3 蛋白相对表达量比较()Tab.4 Comparison of relative expression levels of TGF-β1 and Smad 3 proteins in each group()
Note:Compared with control group,1)P<0.001;compared with no-load group,2)P<0.001.
Smad 3 0.42±0.13 0.40±0.12 0.80±0.151)2)14.164<0.001 Groups Control No-load Overexpression F P TGF-β1 0.32±0.10 0.35±0.11 1.01±0.161)2)47.830<0.001
3 讨论
关节软骨损伤是骨科的常见疾病,主要由外伤、疾病(风湿性关节炎、类风湿性关节炎、骨关节炎等)引起[8]。因关节软骨无血管、神经及淋巴结组织,自身的修复能力差,在出现关节软骨病变后,若未及时得到有效的治疗极易出现关节功能障碍,严重者可丧失运动功能[9]。目前软骨组织工程学是治疗关节软骨损伤的新方向,细胞介导的基因治疗是软骨组织工程学的重要途径之一[10]。目的基因的选择是影响种子细胞增殖、分化的重要条件,转化生长因子(TGF-β)、胰岛素样生长因子-1(IGF-1)等可溶性生长因子虽具有诱导成软骨细胞分化功能,但半衰期较短,效果并不满意[11]。因此,寻求合适的修饰基因对于软骨组织的修复有重要意义。
本研究结果显示,Lenti-Sox9-EGFP 感染hAD⁃SCs,过表达组的Sox9 蛋白相对表达量均高于空载组和对照组;与对照组和空载组比较,过表达组24 h、48 h、72 h 的 MTT 试验 A 值更高、凋亡率更低,提示过表达Sox9 能促进hADSCs 的增殖,抑制凋亡。Sox9 拥有位于羟基端HMG 框结构域及氨基端转录激活结构域,主要在软骨细胞中表达,在软骨的发育形成中有重要作用,可调节软骨细胞的分化增殖、间充质细胞的聚集、维持软骨细胞表型,抑制软骨细胞向肥大细胞的转化[12]。张军等[13]研究发现,Sox9 转染人脐干细胞能促进其向软骨细胞分化,证实Sox9 对于脐干细胞的软骨分化有较强的调控作用。赵辰等[14]研究认为,高表达的 Sox9 可抑制BMP2 诱导的凋亡,促进软骨细胞的增殖分化。以上研究说明,Sox9 基因具有调控软骨细胞增殖、凋亡的作用,结合本研究结果证实Sox9 可促进hAD⁃SCs的增殖,抑制凋亡。
本研究结果中过表达组24 h、48 h、72 h 的TGF-β1、Smad 3 蛋白相对表达量随时间延长而升高;成软骨诱导分化2 周后,甲苯胺蓝染色显示过表达组hADSCs 胞浆及细胞核为蓝紫色,空载组和对照组为微弱淡蓝色,Ⅱ型胶原免疫细胞化学染色结果显示过表达组为强阳性,过表达组的TGF-β1、Smad 3蛋白相对表达量较空载组和对照组更高,说明Sox9过表达可促进hADSCs 的增殖并可向成软骨细胞诱导分化,其机制可能与上调 TGF-β1、Smad 3 蛋白表达有关。Sox9 作为调控软骨发生的主要转录因子,可和软骨细胞特异基因Ⅱ型胶原共同表达,从而调控软骨的分化[15-16]。TGF-β1 是具有多功能的多肽类生长因子,不仅有调控细胞周期、早期发育分化、细胞外基质的形成、诱导细胞凋亡等作用,还有修复、促进基质沉积,增加胶原蛋白Ⅰ和Ⅲ水平,促进组织重塑的作用[17]。CHEN 等[18]研究发现,Sox9 基因表达水平的上调可促进TGF-β1 的表达,促进关节软骨再生。Smads 是TGF-β 下游的信号蛋白分子,直接参与TGF-β 超家族成员的信号转导过程[19]。研究表明,TGF-β1 在促成骨细胞分化过程中,其下游信号转导分子Smad 3 由细胞质向细胞核转导,介导TGF-β1 信号,促进成骨细胞的增殖与分化[20]。因此,Sox9 促进 hADSCs 增殖与向成软骨细胞诱导分化的机制与上调TGF-β1、Smad 3 的表达有关。
综上所述,Sox9 基因过表达可促进hADSCs 的增殖,抑制其凋亡,并促进其成软骨分化,其机制可能与上调TGF-β1、Smad 3蛋白的表达有关。在今后软骨组织工程细胞介导的基因治疗中,可将Sox9 作为参考修饰基因。

