基于分子对接和网络药理学的参附注射液干预深静脉血栓的机制探析
王晓栋 李强 滕腾 陆姿赢 严金 方宇
深静脉血栓形成(deep vein thrombosis,DVT)是由于血流滞缓、静脉壁损伤和血液高凝状态因素引起血液在深静脉腔中不正常凝结,并阻塞静脉腔引起的一种高发病率、高致残率和易反复发作的周围血管病[1-2]。其临床表现主要为肢体广泛性肿胀、疼痛、皮色暗红、浅静脉扩张等特点。早期DVT的血栓易脱落,会引发致命性肺栓塞。后期因静脉瓣膜破坏,患肢会出现肿胀、色素沉着、湿疹性皮炎、慢性溃疡等DVT后综合征[3]。祖国医学认为本病主要是因为创伤、骨折或长期卧床,导致肢体气血运行不畅、气滞血瘀,淤血阻于脉络,脉络滞塞不通,静脉血回流受阻,水津外溢,聚而为湿,发为本病。临床上多用辩证分型,内治法及外治法对其进行治疗[4]。
参附注射液源自《校注妇人良方·卷九》之参附汤,由红参、黑附片(附子)经过现代工艺加工制备而成,其主要活性成分为人参皂苷和乌头类生物碱。红参作为“大补元气之药”具有补元气、复脉固脱、益气摄血的作用。附子被称为“回阳救逆第一品药”,能够回阳救逆、补火助阳、散寒止痛。两者合用,具有益气温阳、振奋心阳、回阳救逆、益气固脱、温通心脉等多重功效。主要可用于治疗暴脱引起的厥脱症(感染性、失血性、失液性休克等),以及阳虚(气虚)导致的惊悸、喘咳、胃痛、泄泻、痹症等[5]。此外,参附注射液具有抑制血小板凝聚,降低血液黏稠度,单用或联用具有防治DVT的作用,但其作用机制尚不明确[6]。随着网络药理学概念的应运而生,基于化学、医学、生物数据等多学科整合,依托计算模拟建立药理学性质预测模型,为阐明中药复方制剂多成分、多靶点作用机制及其相应的药效物质基础提供了新的思路。本研究采用网络药理学技术,运用文献检索、分子在线模拟找靶、基因本体论分析、KEGG通路富集分析等手段,对参附注射液治疗的生物分子药理机制进行网络分析,为探寻其防治DVT的作用提供理论线索。
1 材料和方法
1.1 数据库和软件 所涉及数据库和软件如下:(1)CNKI 数 据 库 ,https://www.cnki.net/;(2)ChemicalBook数据库,http://www.chemicalbook.net;(3)SIB 分子结构活性相似性靶标预测服务器,http://www.swissparam.ch/;(4)GeneCards 基因数据库,https://www.genecards.org/;(5)DisGeNet疾病基因相关数据库,https://www.disgenet.org/;(6)STRING 数据库,https://string-db.org/;(7)RCSB PDB 蛋 白 质 数 据 库 ,http://www.rcsb.org;(8)DAVID 数 据 库 ,https://david.ncifcrf.gov/;(9)Cytoscape可视化网络处理软件,版本号 3.7.2;(10)Cluego,Cytoscape 软件平台插件,2.5.7;(11)ChemOffice,版本号19.0;(12)AutoDock Vina 分子对接平台,版本号 1.1.2。本研究在网络药理学理论的指导下,探讨参附注射液中有效成分治疗DVT的作用机制,通过构建“成分-靶点”的网络,旨在为DVT的临床治疗及拟开展的实验验证研究提供理论支持。
1.2 参附注射液主要成分选择及靶标集合构建 在CNKI数据库检索关键词为“参附”“成分”进行检索,归纳出与参附注射液成分相关的文献,再筛选出经高效液相色谱和超高效液质联用等检测手段的成分研究文献,汇总整理出参附注射液中主要的有效成分,最后通过ChemicalBook数据库逐一核对化合物成分的中英文名称、CAS号,并以mol格式结构文档然后保存。将mol格式文档输入SIB分子结构活性相似性靶标预测服务器中,对化合物潜在靶点进行预测,即钓靶。
1.3 中药成分-靶点网络的构建 整理归纳参附注射液中的有效成分及靶点基因,而后归类导入到Cytoscape3.7.2软件中进行可视化分析,构建成分-靶点网络图。利用软件自带的“Network Analyzer”插件对网络进行拓扑分析。“度值”“介数”“最短距离”是分析网络中心性的关键参数,度值、介数、最短路径越大,该节点就越重要。其中度值为关键信息,归类筛选出关键化合物。
1.4 DVT相关疾病基因构建 分别利用GeneCards和DisGeNet数据库,以“deep vein thrombosis”为检索词,获取与DVT相关的靶点。将两个数据的结果汇总、去重,建立两者之间的合集,从而获得DVT相关的疾病基因集合。
1.5 参附注射液-DVT潜在治疗靶点集合及其蛋白质互作网络构建 对参附注射液靶基因和DVT基因取交集,从而获取参附注射液治疗DVT的潜在治疗靶点集合,并绘制韦恩图。将潜在治疗靶点基因导入到STRING数据库平台,背景设置为“homo sapiens”(智人),其他参数为默认值,构建蛋白质互作网络(protein-protein interaction,PPI),将得到的结果导入Cytoscape3.7.2处理软件,利用“Network Analyzer”插件对该网络做拓扑分析,并且分析其中心的性靶标参数。
1.6 GO生物过程的分析 利用Cytoscape3.7.2软件中的ClueGo插件对参附注射液-DVT潜在治疗靶点靶基因的GO生物的过程进行分析,发现潜在的药理作用,用于解释药物靶点防治DVT的过程。参数设置为“homo sapiens”,P≤0.05,选择“use go term fusion”,设置interval min level=4,max level=7。
1.7 KEGG富集通路分析 利用DAVID 6.8v数据库对潜在治疗靶点基因进行KEGG信号通路富集分析,挑选出P<0.05的参附注射液发挥治疗作用可能的信号通路,并运用R语言进行可视化分析。
1.8 参附注射液主要活性成分与对应的靶点蛋白的分子对接验证 分子对接是通过受体的特征以及受体和药物分子之间的相互作用方式来进行药物设计的方法,主要研究分子间(如配体和受体)相互作用,按照几何互补和能量互补的原则来实时评价配体和受体的相互作用,寻找最佳结合模式理论模拟方法。
使用AutoDock Vina 1.1.2对参附注射液中主要成分化合物和度值排名靠前的核心靶点进行分子对接实验。将得到的主要成分化合物件导入到ChemDraw3D软件中调整化合物的空间构象,Minimize能量优化,再保存为mol2模式。然后利用AutoDock vina中的AutoDock Tools工具分配电荷、设置可旋转键后再保存成pdbqt格式的文件。从PDB下载靶蛋白的3D晶体的结构,去除靶蛋白水分子分离原始的配体和受体,得到的靶蛋白导入到AutoDock进行加氢、分配电荷、添加原子类型后保存成pdbqt格式的文件。最后利用AutoDock Vina 1.1.2进行分子对接,以及GraphPad Prism 8将化合物以及对应的靶蛋白对接得到的结合能构建热图。
2 结果
2.1 参附注射液的主要活性成分 通过文献检索,共得到参附注射液成分研究的文献50篇,其中通过高效液相色谱和超高效液质联用等检测手段共6篇文献,具体信息见表1、2。

表1 红参主要活性成分

表2 附子主要活性成分
本研究通过检索文献,发现经过高效液相色谱法和超高效液相色谱法检测过的参附注射液含有多种皂苷和生物碱成分,如人参皂苷 Rd、Rg1、Rb1、Ro、Rc、Rb2、Rf、Ra2、Rh1、Re、F1、Rb3,20-葡糖人参皂苷 R、三七皂苷R1、竹节参皂苷Ⅳa等15种皂苷成分,有新乌头碱、尼奥灵、塔拉乌头胺、苯甲酰乌头原碱、苯甲酰新乌头原碱、次乌头碱、乌头碱等7种生物碱。将其统一保存成mol2格式文件,并对其进行网络分析,主要的成分信息见表3。

表3 参附注射液主要活性成分
2.2 参附注射液的潜在靶标及药物成分-靶点网络构建 通过SIB服务器进行靶点预测后,共发现参附注射液中22种有效成分共对应的有114个潜在靶标,其中人参皂苷类成分所对应的靶标数目最多、药理作用也比较广,推测为参附注射液的主要活性成分。结果见表4。将有效成分和对应靶点导入到Cytoscape中后,得到成分-靶点网络图,见图1。

图1 参附注射液化合物-成分靶点相互作用网络

表4 SIB服务器靶点预测结果
根据度值从大到小排序,筛选出6个关键化合物,分别为人参皂苷Ra2,人参皂苷Rh1,次乌头碱,人参皂苷Rd,人参皂苷Rb1,人参皂苷Rb3,见表5。

表5 参附注射液的主要化合物信息
2.3 潜在治疗靶点和PPI网络构建 通过GeneCards数据库和DisGeNet数据库平台分别搜索与DVT相关的基因。汇总、去重后,共得到2 155个基因,再与114个参附注射液活性成分的基因建立交集,共得到43个潜在的治疗靶基因。
将潜在的治疗靶基因导入到STRING数据库平台,然后构建参附注射液的PPI网络,排除没有发生互相作用的基因,见图2(插页)。由图2可见,共有42个基因参与了网络的构建,整个网络共包括204条相互作用的线,平均度值(degree)为9.71,平均最短距离(closeness)为 4.9×10-1,平均介数(betweenness)为 2.85×10-2。网络中节点度值越大,说明其在PPI网络中就越重要,在生物学功能中起着更为重要的作用。度值排名前 5 的靶基因为 AKT1、VEGFA、HSP90AA1、MAPK1、PIK3CA,见表6。这些靶基因可能是参附注射液防治DVT的关键靶基因。

表6 参附注射液防治DVT的可能关键靶基因
2.4 GO生物过程分析 将42个抗DVT的靶基因进行GO生物过程分析,结果发现涉及了72个GO生物过程条目,总共322条相互作用关系的网络线,见图3(插页)。其中GO生物过程条目可以分为5类,肽酰苏氨酸磷酸化(60.38%),内皮细胞增殖的正调控(30.19%),磷脂酰肌醇介导的信号传导(3.77%),ERBB信号通路(3.77%),儿茶酚胺刺激的细胞反应(1.89%)。由此得出,肽酰苏氨酸磷酸化、内皮细胞增殖的正调控与DVT紧密相关。
2.5 KEGG富集通路分析 将42个抗DVT的靶基因导入到DAVID 6.8v数据库中,通过筛选P<0.05,得到85条富集通路,以基因的数量和P值为筛选条件,运用R语言选取前30条通路进行可视化分析,见图4。其中每条通路包含的基因数量越多且P值越小,该通路就与疾病越密切。其中42个基因中有27个基因参与了前30条相关通路的富集。可见,基因主要富集在癌症通路(pathways in cancer)、HIF-1信号通路(HIF-1 signaling pathway)、PI3K-Akt信号通路(PI3K-Akt signaling pathway)、Rap1 信号通路(Rap1 signaling pathway)、Ras信号通路(Ras signaling pathway)、ErbB 信号通路(ErbB signaling pathway)、VEGF 信号通路(VEGF signaling pathway)、雌激素信号通路(estrogen signaling pathway)、mTOR 信号通路(mTOR signaling pathway)、cAMP信号通路(cAMP signaling pathway)、T细胞受体信号通路(T cell receptor signaling pathway)、FcεRI信号通路(Fc epsilon RI signaling pathway)、B细胞受体信号通路(B cell receptor signaling pathway)。
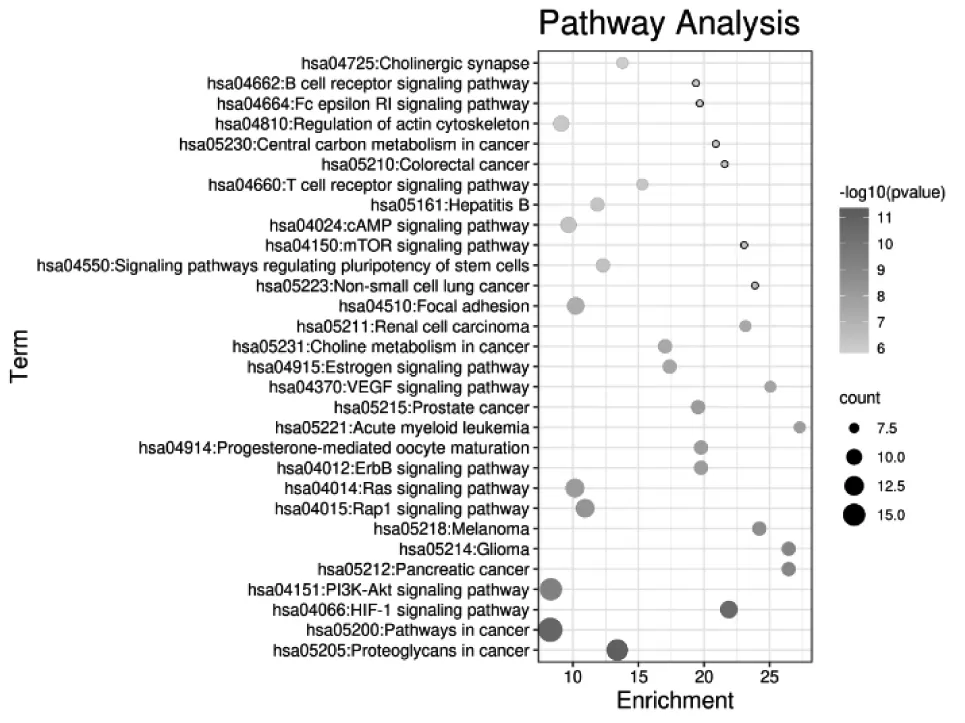
图4 KEGG通路分析
2.6 分子对接结果 一般认为受体和配体结合的构象稳定时的能量越低,发生的作用可能性就越大,根据文献记载,结合能<-5 kcal/mol表明配体小分子和受体蛋白之间有着较好的结合活性[15]。结合能<-8 kcal/mol表示配体小分子和受体蛋白之间存在强烈的结合活性[16]。如图5所示,核心化合物和AKT1、VEGFA、HSP90AA1、MAPK1、PIK3CA结合能均<-5 kcal/mol,提示化合物和靶蛋白的结合活性较高。HSP90AA1对接人参皂苷Ra2,MAPK1对接人参皂苷Ra2和人参皂苷Rh1,PIK3CA对接人参皂苷Rd、Rh1的结合能<-8 kcal/mol。分子对接的结果显示通过网络药理学进行筛选得到的核心化合物和核心靶点都具有比较好的结合活性。
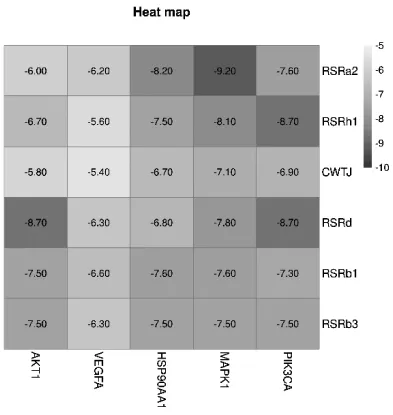
图5 参附注射液的核心化合物与关键靶点对接得分热图
3 讨论
本研究运用网络药理学的方法,通过PPI网络分析结果表明 AKT1、VEGFA、HSP90AA1、MAPK1、PIK3CA等可能是参附注射液治疗DVT的关键靶点。研究表明VEGFA具有促进血管内皮细胞的分裂和增殖、增加微静脉和小静脉的通透性、诱导血管生成、改善血液供应等功能[17]。Akt1通过磷酸化底物蛋白激活下游信号级联反应,参与调控多个相关基因家族转录,影响细胞生长、存活、增殖、基因转录、蛋白合成、细胞迁移运动等多种细胞活动[18]。抑制HSP90AA1的表达能够发生抗炎、抗氧化内激、调节内皮功能等作用[19]。PIK3CA的p110alpha催化亚基的作用对于内皮细胞迁移和血管的生成至关重要,研究表明体细胞激活AKT1和PIK3CA变体会引起特定血管内皮功能障碍,特别是内皮黏附分子,这是已知的血栓形成因素和获得性血栓形成前的危险因素[20]。
GO生物过程结果分析表明,参附注射液治疗DVT可能是通过肽酰苏氨酸磷酸化,内皮细胞增殖的正调控,磷脂酰肌醇介导的信号传导,ERBB信号通路,儿茶酚胺刺激的细胞反应等生物过程发挥恢复血管功能,改善血液循环和组织代谢,抑制炎症反应,抑制细胞凋亡等作用。KEGG富集通路结果分析表明了PPI网络的关键靶点主要富集了癌症通路、HIF-1信号通路、PI3K-Akt信号通路、Rap1信号通路、Ras信号通路等。研究表明HIF-1信号通路是由α和β亚基组成的异二聚核转录因子,缺氧和HIF-1α的稳定与自然中形成的血栓中血管生成性HIF-1靶标水平的升高有关,防止血栓中的HIF-1α降解可以增强静脉再通,血栓新血管形成和血栓消退。血栓的消融也通过与它所附着的静脉壁的相互作用来调节,并且壁内的血管生成反应可能是血栓内许多通道的来源[21]。PI3K-Akt信号通路被认为是血管内皮细胞凋亡信号通路之一,在这个过程中,PI3K-Akt信号通路可以进一步激活内皮一氧化氮合酶,并最终促进内皮细胞的迁移,这对调节血管稳态和血管生成至关重要[22]。Su等[23]指出,抑制PI3K信号通路可能是血栓性疾病的有希望的治疗靶标。严格控制RAP1信号通路中的CalDAG-GEFI和RASA3之间的拮抗作用平衡,对于预防循环中的血小板过早活化
以及在血管损伤部位形成止血栓都是至关重要的。在血小板循环的健康血管中,RASA3具有抑制不受控制的RAP1活化并保持静态,非黏附状态(无整联蛋白活化)的活性。在血管损伤的部位,血小板刺激导致细胞质Ca2+水平增加,致密颗粒释放ADP。Ca2+激活CalDAGGEFI,后者介导RAP1的GTP快速加载。ADP刺激P2Y12受体,从而导致RASA3功能下降和RAP1信号持续传递。快速和持续的RAP1整联蛋白活化导致在广泛的血流动力学剪切条件下形成稳定的三维血栓。P2Y12抑制剂(例如氯吡格雷)可防止RASA3失活,禁止持续的RAP1信号传导并破坏血栓的生长[24]。
分子对接结果显示,HSP90AA1对接人参皂苷Ra2、MAPK1对接人参皂苷Ra2和人参皂苷Rh1,PIK3CA对接人参皂苷Rd、Rh1具有很高的活性。人参皂苷Ra2、人参皂苷Rh1和人参皂苷Rd可能是治疗DVT的活性成分。
综上所述,通过网络药理学和分子对接验证提示,参附注射液中人参皂苷Ra2,人参皂苷Rh1和人参皂苷Rd具有防治DVT的机制,治疗DVT的机制可能通过HIF-1信号通路、抑制PI3K-AKt信号通路,抑制Rap1等信号通路有关,通过调控 AKT1、VEGFA、HSP90AA1、MAPK1、PIK3CA等基因的表达发挥抗炎、抗氧化内激、调节内皮功能、促进血管内皮细胞的分裂和增殖、增加微静脉和小静脉的通透性、诱导血管生成、改善血液供应、抑制细胞凋亡、调节血管稳态以及破坏血栓生成的作用。本研究揭示了中药制剂多成分-多靶点-多通路的特点,为参附注射液治疗DVT这一后续临床试验提供了一定的理论基础。

