不同眼压状态下实验性青光眼视网膜神经节细胞p53基因表达
李素美 王文奇
(1淮安市洪泽区人民医院,江苏 淮安 223100;2淮安市第一人民医院)
青光眼主要表现为眼红、夜盲、虹视、视物模糊、眼痛、头痛等,严重可导致失明〔1〕。因患者早期症状不明显或无症状常错过了最佳治疗时机,发现时病情已发展到中晚期,视觉功能损伤严重致失明〔2〕。晚期青光眼致盲是目前人类最主要的致盲原因,且这种致盲是不可逆的,如何有效地保护青光眼患者的视觉功能是当前眼科的难题之一〔3〕。近年来临床研究认为造成青光眼患者视觉功能损伤与视网膜神经节细胞(RGCs)死亡相关〔4〕。而RGCs的死亡则是通过细胞凋亡来完成的,目前已知的激发RGCs凋亡的因素较多,但这些因素都是利用信号传导影响细胞内控制凋亡的相关基因完成的〔5〕。p53基因在诱导RGCs凋亡中有重要的作用〔6〕。医学界针对青光眼的相关研究很多,但缺乏关于不同眼压状态下RGCs细胞内控制凋亡基因的研究。本研究通过检测不同眼压状态下p53基因的表达,探讨其对青光眼RGCs凋亡作用机制。
1 材料与方法
1.1材料 SD小鼠RGC-5细胞系,选购自中国科学院上海生科院细胞资源中心。DMEM培养基:北京索莱宝科技有限公司;胎牛血清:美国Corning公司;胰蛋白酶消化液:北京索莱宝科技有限公司;兔抗鼠单克隆体P53:美国Santa 公司;Annexin V-FITC/PI细胞凋亡检测试剂盒:南京森贝伽生物科技有限公司;Hoe33342染色液:美国MedChemExpress公司;聚合酶链反应(PCR)试剂盒:美国TaKa-Ra公司;Western印迹试剂盒:基尔顿生物科技(上海)有限公司;CO2恒温细胞培养箱:上海一恒科学仪器有限公司;IX70型倒置相差显微镜:徕卡显微系统(上海)贸易有限公司;流式细胞仪:美国Beckman Coulter公司;荧光显微镜:徕卡显微系统(上海)贸易有限公司;紫外投射仪:北京鼎国昌盛生物技术有限责任公司。
1.2方法
1.2.1细胞培养 在含有10%胎牛血清的DMEM培养基,温度为37℃,体积数为5% 的CO2恒温细胞培养箱中进行RGC-5细胞培养,3~4 d用0.25%的胰蛋白消化传代1次,传代比例为1∶4〔7〕。
1.2.2实验分组 RGC-5细胞(对数期生长的)以每孔8×103的密度在96孔培养板上进行接种,培养24 h后,分为4组:对照组、20 mmHg压力组、40 mmHg组、60 mmHg组。对照组仅进行密封处理,不加压,压力组分别用20、40和60 mmHg的密封加压装置处理,将经处理的细胞分别放入各自的培养箱中48 h,然后用倒置相差显微镜对各组的细胞状态进行观察记录〔8〕。
1.2.3流式细胞仪检测 使用Annexin V-FITC和PI细胞凋亡检测试剂盒来进行检测,按说明书操作。首先收集加压培养后的RGC-5细胞,用预冷处理过的磷酸盐缓冲液(PBS)洗涤2次;在结合缓冲液中悬浮置入洗涤的细胞〔9〕。然后分别添加Annexin V-FITC和PI,进行15 min避光孵育。最后添加结合缓冲液混合均匀,用流式细胞仪分析〔10〕。
1.2.4半定量RT-PCR检测 加压培养后,选取RGC-5细胞(1×105个)通过Trizol一步法进行RNA提取,再用Oligo(dT)进行逆转录反应获得cDNA。以Genbank上的基因序列为依据进行引物设计,分别用p53引物和内参GAPDH引物行PCR〔11〕。其反应体系为25 μl,反应条件为:5 min 95℃预变性,余下的34个循环50 s 95℃变性,50 s 55℃退火,50 s 72℃延伸,最后5 min 72℃延伸,共行35个循环〔12〕。利用琼脂糖凝胶(购自:武汉沃轩科技有限公司,内含1%花青素)电泳对PCR产物进行鉴定,同时通过紫外透射仪观察拍照,凝胶成像系统分析。
1.2.5Western印迹检测 加压培养后,收集RGC-5细胞并用细胞裂解液进行30 min裂解。然后在4℃的环境下,以12 000 r/min的速度进行5 min离心处理,提取上清液,加入上样缓冲液后在沸水中煮5 min,用浓度为10%的十二烷基硫代硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离〔13〕。电泳结束后,脱奶粉(5%)封闭1 h,加入比例为1∶1 000的一抗,4℃过夜〔14〕。进行30 min的TBST液漂洗后,加入比例为1∶2 000的辣根过氧化物酶(HRP)标记的二抗,室温下孵育30 min,用TBST液漂洗1 h,ECL染色〔15〕。扫描得出图像,需重复3次独立实验。
1.3统计学方法 采用SPSS21.0软件进行单因素方差分析、t检验。
2 结 果
2.1各组细胞形态及存活状况 对照组细胞形状为梭形且有较多树突,各压力组细胞轮廓不清,皱缩细胞变多,有些细胞树突变少、变短,有些细胞内出现空泡。而且压力越大,细胞异常表现越明显,见图1。

图1 倒置显微镜下细胞形态及存活状况(×100)
2.2各组细胞凋亡情况比较 随着压力数值的上升,凋亡和坏死细胞比例均显著高于对照组(均P<0.05)。见图2和表1。
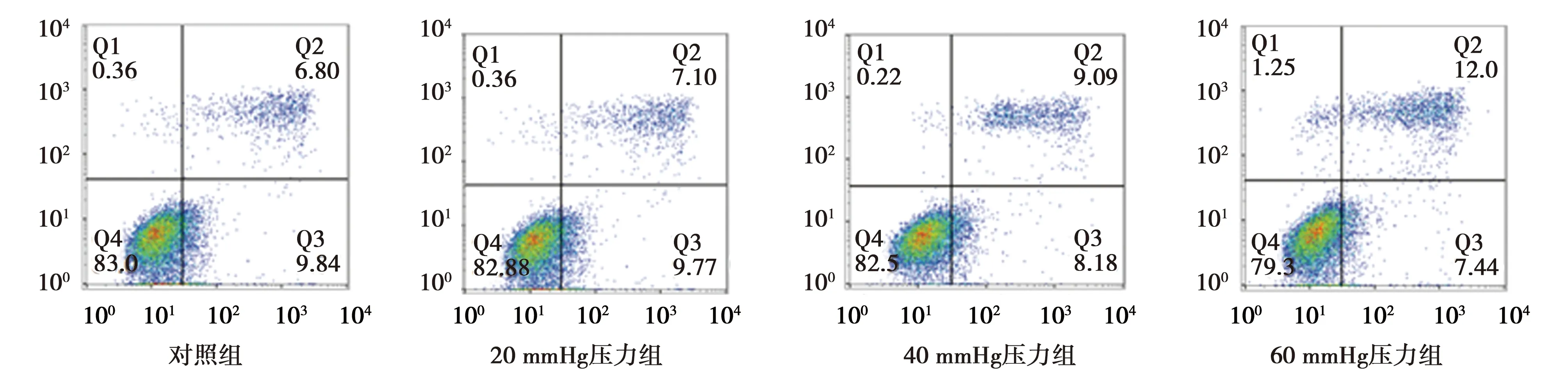
图2 各组细胞流式细胞仪检测下细胞凋亡
表1 各组凋亡和坏死细胞比例比较
2.3各组细胞p53 mRNA表达和蛋白表达 与对照组相比,各加压组细胞p53 mRNA和蛋白表达水平均显著增加,且与20 mmHg压力组相比,40 mmHg压力组和60 mmHg压力组p53 mRNA和蛋白表达水平上调更显著(P<0.05)。见图3,4,表2。

1~4:对照组,20 mmHg压力组,40 mmHg压力组,60 mmHg压力组图3 各组细胞在不同压力下P53的mRNA表达
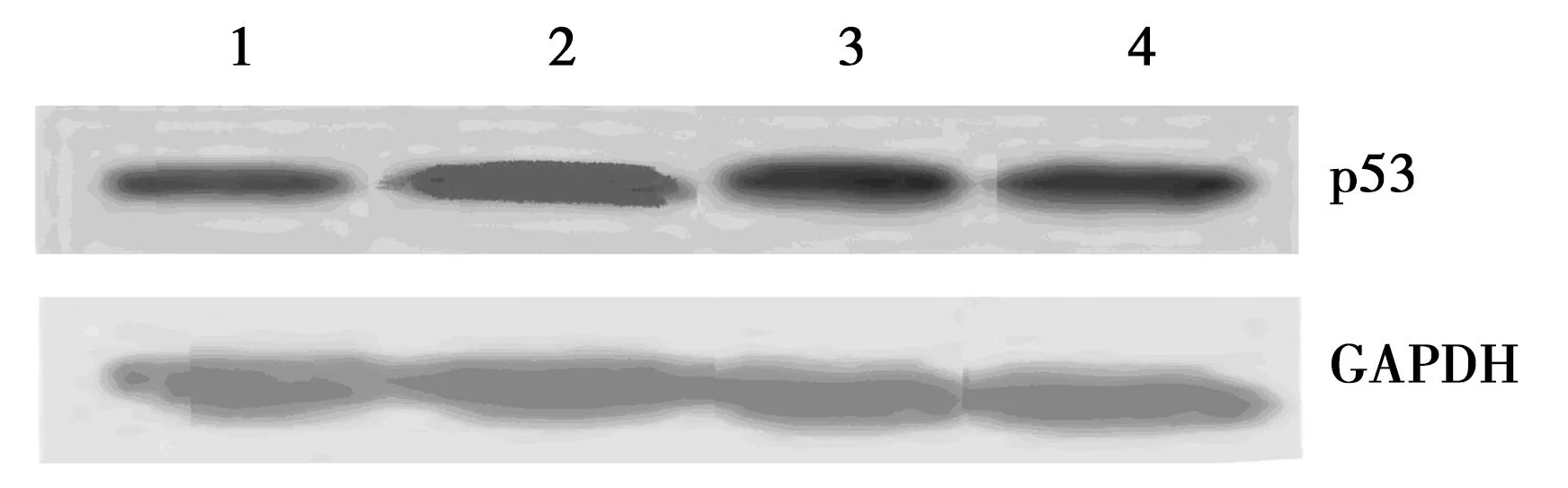
1~4:对照组,20 mmHg压力组,40 mmHg压力组,60 mmHg压力组图4 各组细胞在不同压力下p53的蛋白表达

表2 各组 p53 mRNA 和蛋白表达水平比较
3 讨 论
目前临床研究已证实,RGCs进行性死亡和视神经纤维丢失是青光眼患者眼压上升的主要因素之一〔16〕。本研究结果证明压力可导致RGCs出现死亡,且压力大小与细胞损伤程度成正比。张虹等〔17〕将经过纯化培养的SD系大鼠视网膜神经节细胞分别施加0、20、40、80 mmHg的气压,在培养箱中进行48 h培养后对细胞的凋亡状况进行检测,随着压力数值的上升,细胞凋亡指数增高,证明压力会导致RGCs凋亡,且压力越高细胞凋亡越严重,且高压力会增加细胞早期凋亡进程。
RGCs凋亡是一个极其复杂又涉及多层面、多因素的过程〔18〕。因为各层面各因素间是彼此联系又相互影响制约的,现在研究的尚不能对其发病机制进行明确阐述〔19〕。但在目前已知的能调节细胞凋亡的因素中,与RGCs凋亡相关性较强的就是p53基因。p53基因是促进细胞凋亡的抑癌基因,因其会产生一种名为53 kD的核蛋白而得名〔20〕。其基因分为野生型和突变型两种,野生型通过让细胞周期停留在G1期,来控制细胞的繁殖从而使其凋亡;突变型则为突变基因无诱导细胞凋亡的作用〔21〕。当细胞DNA出现损害时,为了使其有时间进行损伤修复,p53先会诱使细胞停留在G1期;但当DNA损伤过于严重不能修复时,p53则会诱使细胞凋亡,以此达到清除坏死细胞的目的。

