福建地区血清HER-2/neu蛋白参考值的建立及分析
余 鸿 吴贻晨 叶曦蔓 陈勇戎 杨 婧 徐 翔
(1 福建省立金山医院司法鉴定所,福建 福州 350001;2 福建医科大学基础医学院,福建 福州 350122;3 福建省心血管重点实验室,福建 福州 350001;4 福建中医药大学,福建 福州 350122;5 福建医科大学,福建 福州 350122)
乳腺癌是全世界女性恶性肿瘤发病率最高的疾病,2018年全年因为乳腺癌而死亡的人数就已经超过了60万[1]。男性乳腺癌(male breast cancer,MBC)比较少见,在全球所有男性癌症及乳腺癌患者中占比均不到1%[2-3]。但是随着近年来全世界乳腺癌发病率整体的提高,男性乳腺癌也呈现了上升的趋势,并且患病人群呈年轻化,40%左右的患者出现了肿瘤复发,而且将近一半以上的患者出现远处转移的现象。临床上通常应用人表皮生长因子受体-2(human epidermal growth factor receptor 2,HER2)、雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone,PR)、及Ki67将乳腺癌划分为HER2过表达、Luminal A、Luminal B、三阴性4个亚型来指导临床治疗[4]。本研究采用西门子公司的HER-2/neu蛋白测定试剂盒(化学发光法),当今国内使用的并不广泛,主要原因为缺乏国内临床应用数据和试剂的成本高。而且,国内目前没有针对男性乳腺癌的管理指南,大部分的诊疗是借鉴女性乳腺癌(female breast cancer,FBC),但在临床病理特征和预后方面,男性与女性患者都存在一定的差异。因此,本研究将同时收集男性及女性血清标本,探讨血清HER-2/neu蛋白在不同性别及年龄段的差异性,建立全面的血清HER-2/neu蛋白正常参考值,进一步为临床应用提供更有意义的指导。
1 资料与方法
1.1 一般资料 选取2019年12月至2021年6月来我院体检的成人323名,其中男122名,女201名,年龄18~81岁,平均年龄43岁。所有试验对象均不存在心、肝、肾病以及高血压和糖尿病等。此次研究经过医院伦理委员会审核同意,试验对象均知情同意。
1.2 方法 抽取空腹静脉血5 mL于一次性真空促凝管,3 000 r/min离心10 min,分离血清待测。采用全自动化学发光免疫分析仪(ADVIA Centaur CP,Siemens,德国)以化学发光法检测HER-2/neu蛋白,仪器和操作步骤都严格按照说明书进行,其说明书参考值上限(第95分位点)为15.2 ng/mL。
1.3 统计学方法 采用软件SPSS 26.0进行数据的整合及分析。Kolmogorov-Smimov 进行数据的正态性检验。对于正态分布的数据,采用均数±标准差表示;对于非正态分布的数据,采用中位数和百分位数表示;Mann-Whitney检验不同性别的血清HER-2/neu 蛋白水平之间的差异性,并且用Kruskal-Wallis检验分析不同年龄段与血清HER-2/neu 蛋白的相关性,P<0.05表示差异有统计学意义。根据 CLSI C28-A3标准文件制定医学参考值范围。
2 结果
2.1 HER-2/neu蛋白频率分布比较 共检测323名正常成人,Kolmogorov-Smirnov检验显示血清HER-2/neu蛋白数据呈偏态分布(P=0.008<0.05),因此采用中位数和百分位数表示,运用百分位数法确定单侧上限95%的医学参考值。见图1。
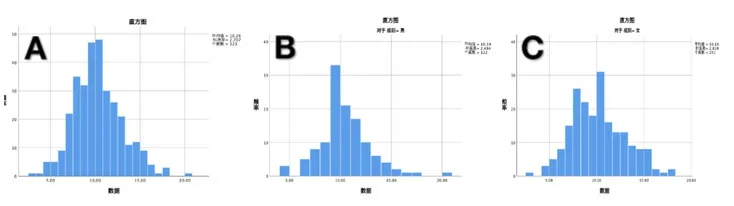
图1 HER-2/neu蛋白频率分布直方图
2.2 不同性别成人血清HER-2/neu 蛋白比较 323名正常成人中,男性122名,平均值为10.4 ng/mL,中位数为10.0 ng/mL,95%医学参考值为<14.9 ng/mL;女性201名,平均值为10.2 ng/mL,中位数为10.0 ng/mL,男性与女性成人血清HER-2/neu蛋白差异无统计学意义(P=0.408>0.05)。95%医学参考值为<15.3 ng/mL。见表1。

表1 血清HER-2/neu蛋白结果统计(ng/mL)
2.3 不同年龄段成人血清HER-2/neu蛋白比较 323名正常成人共分为30岁以下、31~40岁、41~50岁、51~60岁和60岁以上共5个年龄段,各年龄段的中位数和单侧上限95%参考值见表2。年龄段的血清HER-2/neu蛋白相关性用Kruskal-Wallis检验秩方差分析,P<0.05表示差异有统计学意义。30岁以下、31~40岁、41~50岁与51~60岁比较,差异有高度显著性。见表3。
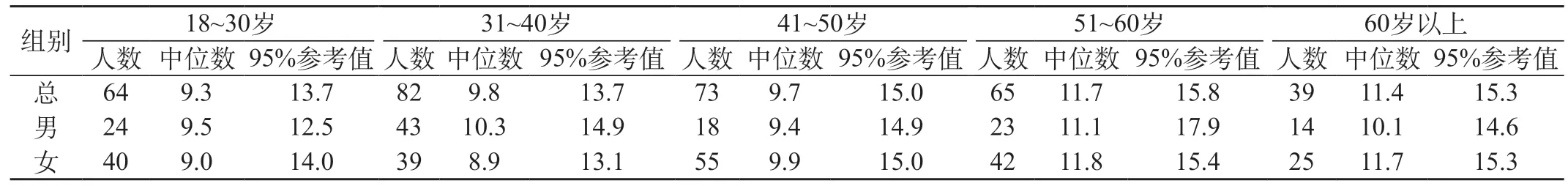
表2 不同性别年龄段血清HER-2/neu 蛋白中位数和参考值上限比较(ng/mL)
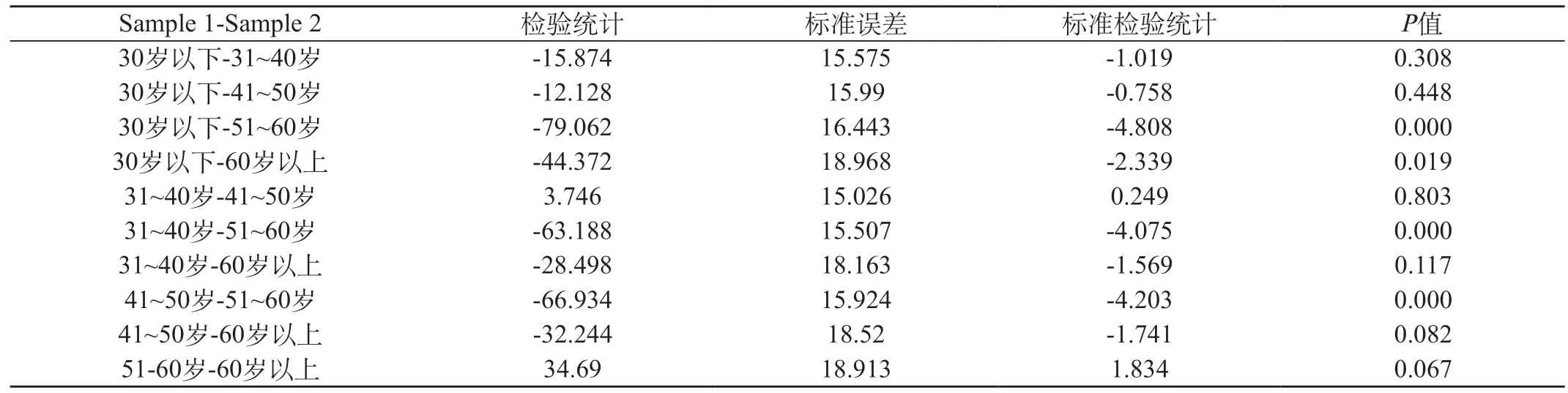
表3 年龄段的血清HER-2/neu蛋白成对比较
3 讨 论
乳腺癌是临床上比较常见的恶性肿瘤,患者的生活和生存受到了威胁。尤其是术后出现的复发和转移严重影响了患者的生存率,因此需要具有较高敏感性和准确性的指标对病程进行监测[5-8]。目前,HER-2是乳腺癌较为明确的治疗靶点。
人类表皮生长因子受体-2(HER-2/neu),是一个具有酪氨酸激酶活性的跨膜受体蛋白。HER-2/neu具有胞内区、跨膜区和胞外区三个部分。其中,胞外区即ECD(Extracellular Domain)为细胞外配体结合区,它可以由肿瘤细胞自体分泌或脱落进入血液循环并被检测到,称为HER-2 ECD。在基质金属蛋白酶的作用下,Her2-neu ECD可从乳腺癌细胞表面裂解并游离至血液循环中,因此HER-2/neu表达量可以通过血清学方法检测。检测血清HER-2/neu的浓度成为可兼具易于被患者接受与组织HER-2/neu水平有较强关联性和可连续检测,受主观影响小等优点的新乳腺癌评估方法。但由于发展时间较短和临床数据不足,血清HER-2/neu尚未成为主要诊断依据。HER-2目前既是乳腺癌患者重要的预后指标,也是抗HER-2药物治疗的主要监测指标[5]。虽然国内外主要以原位杂交(ISH)或免疫组织化学(ICH)作为检测HER-2蛋白或基因的方法[6],但是对于HER-2阳性乳腺癌的患者进行动态监测、辅助判断疾病进程或治疗效果上,能够研发出更经济、便捷、实时的血清检测HER-2方法是至关重要的。大量的研究发现乳腺癌患者血清中HER-2的水平与组织中HER-2的表达有一定的相关性[7-8]。而且,近代以来各项临床检测和治疗方法都逐渐向低创,微创甚至无创的方向发展,如果血清检查即能为组织检查提供关联性证据,那无疑将减轻患者的痛苦,提高患者的生活质量。这符合目前的研究趋势,也有望在临床进行运用。
HER-2/neu基因主要在人体的胚胎发育时期表达,参与了多种组织器官的生长和发育。成人正常的组织中,HER-2/neu基因通常是以单拷贝存在,表达水平较低,主要表达在在呼吸道、胃肠道、乳腺和泌尿生殖道上皮。但在肿瘤患者中,HER-2/neu基因被异常激活,拷贝数明显增加,细胞表面的HER-2/neu蛋白过度表达。这将促使细胞恶性增殖并表现出抗凋亡、诱导新生血管形成的特性。近年来,研究发现被确诊的乳腺癌患者中有20%~30%存在HER-2/neu基因扩增或蛋白过表达情况,在晚期乳腺癌中 HER-2/neu 基因高表达更加常见[9-10]。
检测外血清中HER-2/neu胞外端的浓度能够反映乳腺癌患者 HER-2/neu蛋白水平的实时状态,利于监测术后乳腺癌患者HER-2/neu的表达变化,也对早期发现乳腺癌的复发和转移有一定帮助。因此,作为内分泌治疗、化疗及分子靶向治疗的疗效观察指标,是具有潜在价值的乳腺癌标志物。
检验参考值的设定根据研究目的与数据类型有不同的方法,对于呈正态分布的数据,95%参考值可以用均数±1.96(双侧)或1.64(单侧)标准差的方法设定,非正态分布数据可以用百分位数法及曲线拟合法等。本文数据为非正态分布,因而采用了百分位数法。
本研究结果显示,按性别及年龄分组进行参考值比较,男性与女性成人血清HER-2/neu 蛋白差异无统计学意义;年龄段30岁以下、31~40岁、41~50岁与51~60岁比较,差异有高度显著性(P=0.000<0.05)。总人数的单侧上限95%参考值为<15.0 ng/mL,51~60岁年龄组的单侧上限95%参考值为<15.8 ng/mL,参考值结果相近,没有必要单独设定参考值。
综上所述,将福建地区正常成人血清HER-2/neu蛋白参考值设定为<15 ng/mL较为合适。

