基于硝基咪唑衍生物的Cu(Ⅱ)、Ag(Ⅰ)配合物的合成、晶体结构及生物活性
杨莉宁 刘春叶 成 昭 梁玲玲 张 剑
(西安医学院药学院,西安 710021)
咪唑作为许多酶的活性中心功能基团,参与了很多重要的生物化学反应,对生命活动起着十分重要的作用[1‑3]。硝基咪唑类化合物与生物体内许多大分子如DNA、酶和受体等发生超分子结合[4],产生广泛的医药活性如抗病毒、抗结核、抗肿瘤、抗感染、抗寄生虫等,因而备受人们的关注[5‑7]。就其抗感染方面来说,硝基咪唑具有潜在的抗革兰阳性菌和革兰阴性菌活性,其中甲硝唑和替硝唑已被用于治疗幽门螺旋杆菌引起的感染,显示出硝基咪唑类化合物在研发新型抗菌药领域的潜力。而甲硝唑作为最基本、最常见的硝基咪唑类药物,由于在临床上的长期使用,存在一定的耐药性和不良反应,所以对甲硝唑进行结构修饰,增强其抗菌作用,减少不良反应,是近年来药物化学领域的热门课题[8‑11]。
Cu是生命组织体内的微量元素。以有机酸和其它供体作为配体的Cu(Ⅱ)配合物广泛存在于生物体内,并在化学和生物化学催化系统中起着很重要的作用[12]。在多种金属蛋白(金属酶)中,咪唑环中的氮原子是1个常见且很重要的键合点,如在蓝色的铜蛋白中,都有一个或多个咪唑环键合到铜或其它金属离子上,并因此对其生物活性造成极强的影响[13]。银离子具有极强的广谱抗菌、抑菌作用,同时对人体细胞具有较低的毒副作用。Nomiya曾发现咪唑银配合物具有很强的抗菌能力[14]。
基于此,我们合成了硝基咪唑衍生物——N,N′‑二甲基‑5‑硝基‑2,2′‑联咪唑(L)(Scheme 1),并以它为配体,得到了2种含过渡金属Cu(Ⅱ)、Ag(Ⅰ)的配合物,对配体及其配合物与小牛胸腺DNA(ct‑DNA)的相互作用及其抗厌氧菌活性进行了初步研究。

Scheme 1 Structure of ligand L
1 实验部分
1.1 试剂与仪器
ct‑DNA、三羟甲基氨基甲烷((CH3OH)3CNH2,Tris)、BHI(脑心浸液)培养液或培养基、琼脂粉均为生化试剂,其余均为分析纯试剂,用前未做进一步处理。蒸馏水为二次蒸馏水。配体L按文献方法合成[15‑16]。
所用仪器有Vario EL‑ⅢG型元素分析仪(德国EA元素分析系统公司)、6460A型三重串联四极杆液质联用仪(美国 Agilent科技有限公司)、EQUI‑NOX55型红外光谱仪(德国Brucker公司)、STA449C型热分析仪(德国NETZCH公司)、1800紫外可见分光光度计(日本岛津公司)、Ubbeoldhe黏度计(上海申玻玻璃仪器厂)、DDS‑307型电导仪(上海大谱仪器有限公司)、F‑4500荧光分光光光度计(日本日立公司)、Bruker SMART CCD单晶衍射仪(德国Bruker公司)、YQX‑Ⅱ厌氧培养箱(上海博泰实验设备有限公司)、ELX 800TM酶标仪(美国Bio Tek公司)。
1.2 配合物的合成
[Cu(L)(Ac)2]2(1):将 0.5 mmol Cu(Ac)2·H2O 和 0.5 mmol配体L分别溶于15 mL甲醇中,混合并搅拌1 h,过滤,滤液在室温下放置,7 d以后有蓝色晶体析出。元素分析按C24H30Cu2N10O12的计算值(%):C 37.06,N 18.015,H 3.89;实验值 (%):C 37.05,N 17.81,H 3.65。
配合物[Ag(L)(NO3)]·H2O(2):将 0.5 mmol AgNO3和0.5 mmol配体L分别溶于15 mL甲醇中,混合并搅拌2 h,过滤,得淡黄色粉末,避光保存。元素分析按 AgC8H11N6O6的计算值(%):C 24.30,N 21.26,H 2.78;实验值(%):C 24.32,N 21.43,H 2.51。ESI‑MS(乙腈为溶剂):[Ag(L)]+m/z实测值(理论值):315.19(315.019)。
1.3 配体及配合物与DNA相互作用实验
采用文献已报道的经典方法,对实验所需试剂及缓冲溶液进行配制,并测定配体及配合物与DNA相互作用的紫外光谱、荧光光谱及黏度[17‑18]。
1.3.1 配体及其配合物与ct‑DNA相互作用的紫外光谱
室温条件下,以Tris‑HCl缓冲溶液作对照,测定时样品池和空白池分别装3 mL溶液(配体、配合物1和配合物2溶液浓度均为0.1 mmol·L-1),在200~600 nm波长范围扫描;依次加入浓度为80.7 μmol·L-1的DNA溶液0.02 mL(加5次),每次加入DNA溶液后充分混合并作用5 min后再进行扫描。
1.3.2 配体及其配合物与ct‑DNA相互作用的荧光光谱
室温条件下,在荧光光度计的比色皿中加入2 mL Tris‑HCl缓冲溶液和1 mL浓度为0.1 mmol·L-1的配体或配合物溶液,再依次加入0.02 mL浓度为80.7 μmol·L-1的 DNA 溶液(加 5 次),每次加入 DNA溶液后充分混匀并作用5 min,在一定激发波长激发下,分别扫描300~570 nm波长范围内的荧光发射光谱,激发狭缝和发射狭缝都设置为10 nm。
1.3.3 配体及其配合物与ct‑DNA相互作用的黏度
将待测溶液的温度恒定在(25±0.1)℃,固定DNA溶液的浓度为80.7 μmol·L-1,每次分别加入浓度为0.1 mmol·L-1的配体、配合物1和配合物2溶液0.02 mL(加4次),用乌氏黏度计测定含不同浓度配体、配合物1和配合物2的DNA溶液的相对黏度(η)。溶液的相对黏度按η=(t-t0)/t0计算,式中t0是缓冲溶液流经毛细管所需的时间,t是DNA溶液(含浓度不等的配体或配合物)流经毛细管所需的时间。η0是未加配体或配合物时DNA溶液的相对黏度。以(η/η0)1/3对结合比率(ccompound/cDNA)作图,可得到配体或配合物的浓度对DNA的黏度影响曲线。
1.4 配合物晶体结构的测定
挑选大小为0.64 mm×0.38 mm×0.19 mm的配合物1单晶样品,置于Bruker Smart APEX CCD单晶衍射仪上,采用经石墨单色化的MoKα射线(λ=0.071 073 nm)为辐射源,在296(2)K下以φ‑ω扫描方式收集配合物X射线单晶衍射强度数据。数据经SAINT程序还原并对所得数据进行Lp强度因子校正,并经SADBAS程序[19a]进行半经验法吸收校正。对氢原子采用各向同性热参数,并用理论加氢法得到氢原子位置。采用全矩阵最小二乘法修正所有非氢原子坐标及其各向异性热参数。晶体结构采用SHELXL‑97[19b]程序由直接法解出。有关晶体学数据见表1。

表1 配合物1的晶体结构参数Table 1 Crystal parameters of complex 1
CCDC:2036599,1。
1.5 配体及其配合物的体外抗厌氧菌活性实验[20]
采用经典的2倍稀释法药物敏感试验原理测定配体及其配合物的最小抑菌浓度(MIC)。所用菌株为变形链球菌(Streptococcus mutansUA159)、伴放线放线杆菌(Actinobacillus actinomycetemATCC 29523)(由第四军医大学口腔医院牙体实验室提供)。取冻存的变形链球菌(S.mutans)和伴放线放线杆菌(A.a)分别划线接种于培养基表面,进行厌氧培养。挑取培养36 h的S.mutans和培养48 h的A.a菌落各自接种于培养液,其中前者培养24 h,后者培养48 h,备用。用少量DMSO配制配体及其配合物的溶液作为待测抗菌剂,用无菌水对各种抗菌剂从1 280~0.625 mg·L-1进行2倍梯度稀释。96孔板的每孔中分别加入上述各种浓度的待测抗菌剂溶液、细菌培养液和BHI培养液,用酶标仪进行OD值测定。取对照组(每孔以磷酸盐缓冲盐溶液代替待测抗菌剂溶液,其余同前)100 μL,进行10倍梯度稀释,取100 μL稀释的菌液铺于BHI培养基表面,培养48 h,得到每孔中原细菌生存数(同时对3个复孔进行计数,取平均值)。再于厌氧箱中培养24 h。培养后,继续测定OD值,得到MIC值。所有的试样均平行测试3次,取平均值。
2 结果与讨论
2.1 配合物的性质表征
配合物2元素分析的实验值与理论值基本相符,初步可以确定其可能组成。25℃下,测得配合物2(1 mmol·L-1)在乙醇中的摩尔电导率Λm*为27.42 S·cm2·mol-1,结果表明配合物2属于非电解质[21],硝酸根参与了配位。
以KBr压片测定配体及其配合物的红外光谱。与配体L相比较,形成各配合物后特征吸收峰发生的偏移主要表现在咪唑环上的振动吸收,其中νC=N伸缩振动和配体相比由1 530 cm-1向低波数(1 518~1 528 cm-1)发生了红移且强度降低,这是N原子与金属配位引起C=N核间电子密度降低造成的,说明金属与咪唑环上的3位N发生了配位。配合物1中的醋酸根的Δν值(νas,COO-νs,COO)接近200 cm-1,与文献报道[22]的醋酸根对称桥联配位模式的红外吸收峰一致,说明醋酸根与2个Cu离子桥联配位,晶体结构解析(见后文)也证明了这一结论。配合物2存在含氧酸根NO3-,在谱图上表现为6条谱带,分别为1 630、1 375、1 290 cm-1处的 νas,NO-3,1 100 cm-1处的,及 897和 870 cm-1处的 δNO-振动吸收,指纹区3谱带增加,说明NO3-可能以单齿形式参与配位,配位后对称性降低,使谱带增多[23]。而位于指纹区的420 cm-1吸收峰可以归因为配位键 νAg—N。
用Tris‑HCl缓冲溶液配制配体L及其2种配合物(0.1 mmol·L-1)的溶液,测定它们的紫外可见吸收光谱(图1)。图1表明配体在200~400 nm范围内有2个主要吸收峰,分别位于240和336 nm处,可分别归属为有机配体咪唑环共轭体系的π→π*和n→π*跃迁。2种配合物和配体呈现有类似的双吸收峰,但吸收峰的强度发生了改变,同时配体的240 nm处的吸收峰在配合物中均发生了略微的蓝移,这是金属离子与配体发生配位的结果。
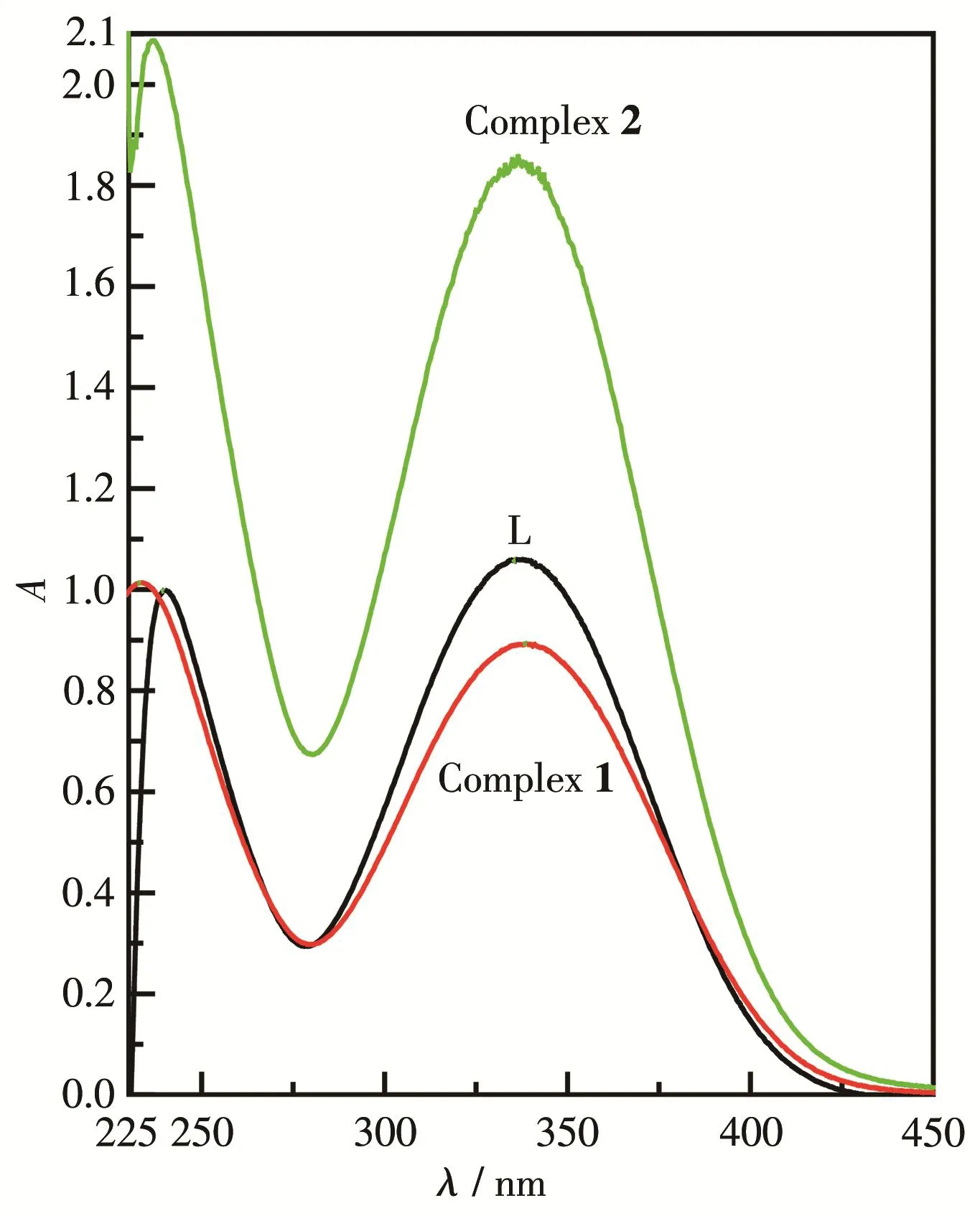
图1 配体L和配合物1、2的UV‑Vis光谱图Fig.1 UV‑Vis spectra of ligand L and complexes 1,2
在室温条件下,分别测定了配体L和配合物2的固体荧光光谱(图2)。在280 nm紫外光激发下,配体分别在471、485和493 nm处有弱的荧光发射峰,主要是配体内的π→π*跃迁所致。而配合物2在300 nm激发光激发下于421、452和468 nm处产生较强的蓝光荧光发射光谱,相较于配体,其荧光发射峰发生了蓝移,是由配体与金属配位后配体的共轭程度降低而引起的[24]。
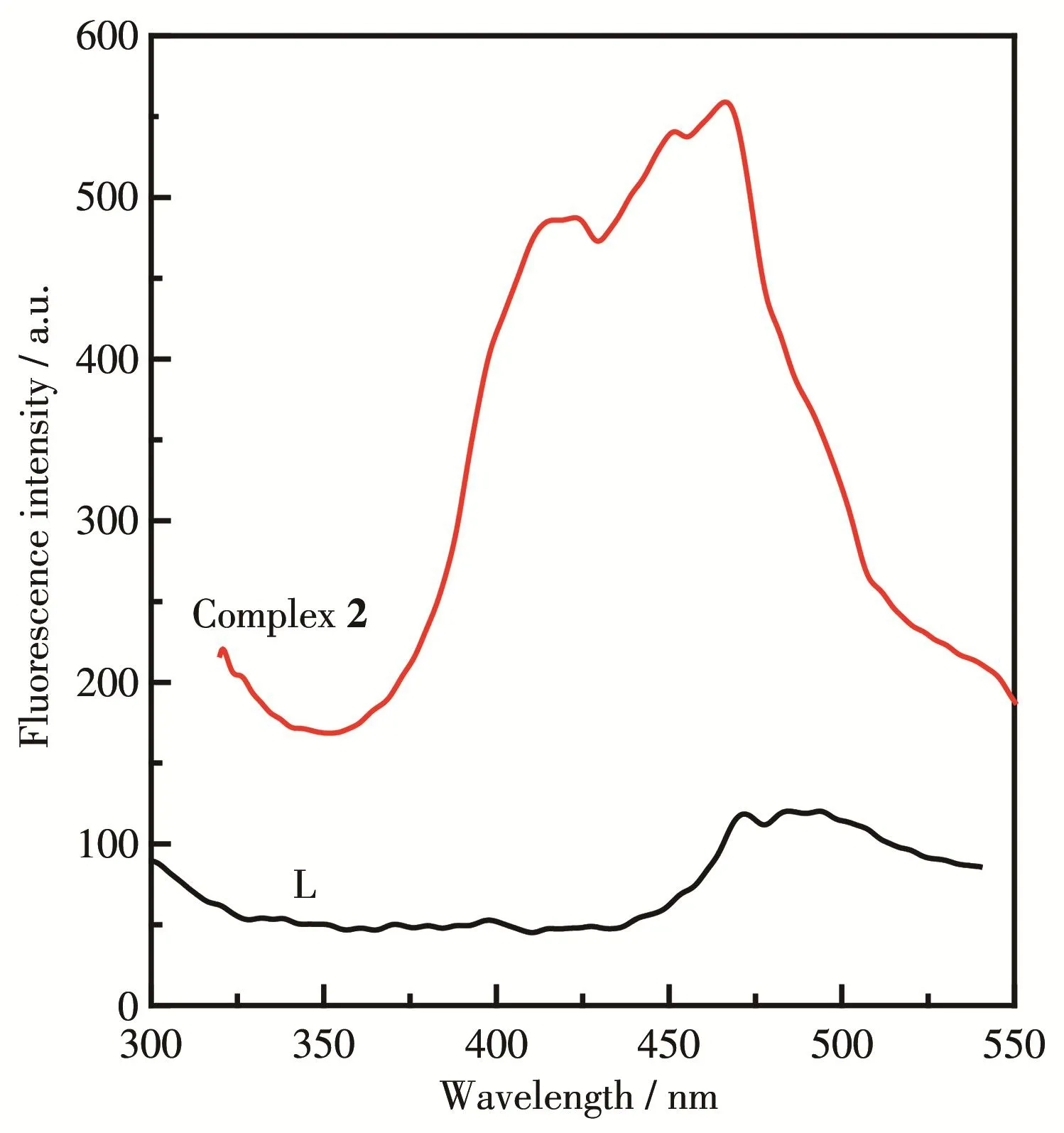
图2 配体L和配合物2的固体荧光光谱Fig.2 Solid fluorescence spectra of ligand L and complex 2
在氮气流速30 cm3·min-1、升温速率20 ℃·min-1的条件下进行热重分析,测得2种配合物从室温到800或1 000℃温度范围内的热重-示差扫描量热(TG‑DSC)曲线(图 3)。
从图3的TG曲线可以看出,配合物1的结构在200℃开始快速坍塌,失重率为41.35%,对应于配合物熔化并分解失去2个醋酸根及配体咪唑环上的硝基(理论值:42.21%),同时DSC曲线上在226℃出现一个尖锐的吸热峰,这与配合物的熔点一致。随后直至接近1 000℃,配合物1缓慢失去剩余的二甲基联咪唑残片,最终的残余物可能为Cu单质,残余量15.67%,与理论值16.34%基本相符。
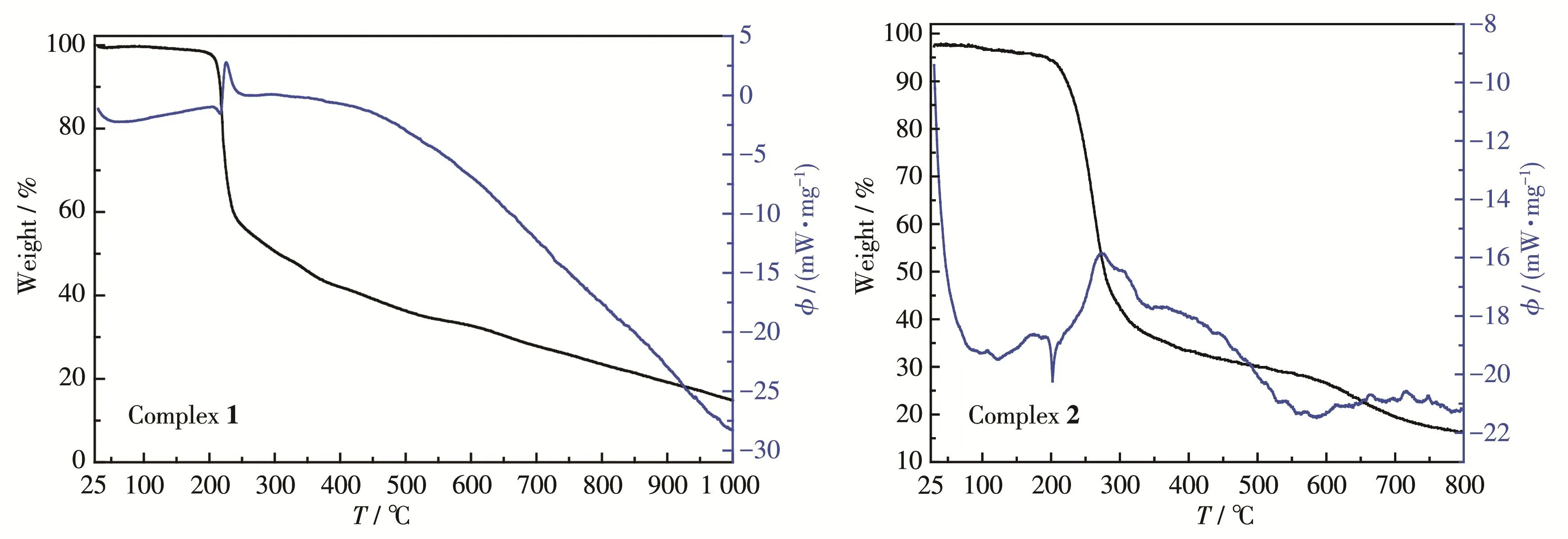
图3 配合物1和2的TG‑DSC曲线图Fig.3 TG‑DSC curves of complexes 1 and 2
配合物2的热分解可以分为3步。在100~180℃为第一步的缓慢失去结晶水的过程,TG曲线平缓下降,失重率为4.66%(理论值:4.56%),同时DSC曲线上对应在121℃出现一个很小的吸热峰。DSC曲线在202℃有一尖锐的吸热峰,可能是配合物熔化吸热,同时TG曲线开始迅速下降,对应于配合物第2步分解,失去有机配体L,直到300℃左右,此时总失重实验值为57.46%,与理论值56.96%相吻合。其后为第3步,残余的AgNO3缓慢分解,失重趋势变慢,从300~800℃残余物含量一直在减小,可能为AgNO3分解所得的单质银在高温N2气氛下不断挥发所致。
综合元素分析、UV‑Vis光谱、红外光谱、固体荧光光谱、质谱、摩尔电导率及TG‑DSC等分析数据,根据硝基咪唑衍生物配合物的文献[25],初步确定配合物2的可能结构为二配位直线型的配合物,如Scheme 2所示。

Scheme 2 Structure of complex 2
2.2 配合物1的晶体结构
配合物1晶体属于单斜晶系的C2/c空间群。单晶衍射结果表明,配合物1为一个对称的双核结构,含有4个配位的醋酸根,每一个醋酸根都是与2个铜离子二齿桥联配位,Cu—O键长为0.195 5~0.198 9 nm(表2),构成了桨轮笼型结构,其轴向分别被咪唑环上的N占据,Cu—N键长为0.219 1 nm。在双核铜笼型结构中,2个铜离子间的距离(0.265 7 nm)比2个铜原子的范德华距离(0.286 nm)短,比2个铜离子的金属半径之和(0.255 nm)稍长,证明配合物中存在Cu与Cu之间的弱相互作用[26]。配合物中每个五配位的铜离子具有四方锥几何构型,与Cu配位的4个氧原子是共面的,构成了四边形的锥底,锥顶被轴向的咪唑环上N占据(图4)。由于硝基及甲基的位阻效应,配体的2个咪唑环发生了很大程度的扭曲,环平面几乎呈90°角。在相邻分子之间,含硝基的咪唑环上的H6—C6与醋酸根的O6形成分子间氢键C6—H6…O6(C6…O6 0.246 4 nm,∠C6—H6…O6=138.13°)。醋酸根的甲基的H11—C11与配体咪唑环上未配位的3位N4也存在氢键C11—H11…N4(C11…N4 0.265 2 nm,∠C11—H11…N4=142.05°)。通过这些分子间氢键把各配合物分子连接成一维链,链与链之间又通过咪唑环的π‑π堆积(咪唑环之间距离为0.334 9 nm)构筑为二维的层状超分子结构(图 5)。
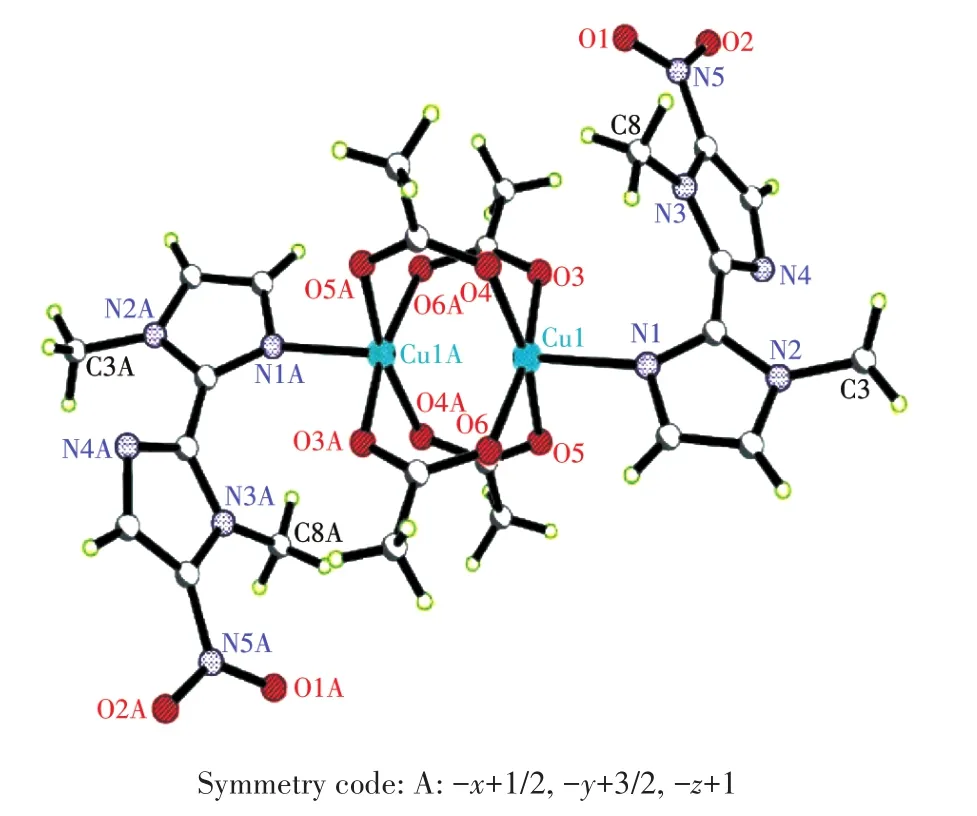
图4 配合物1的椭球概率30%的分子结构图Fig.4 Molecular structure of complex 1 with thermal ellipsoids at 30% probability level

表2 配合物1的部分键长和键角Table 2 Selected bond lengths(nm)and bond angles(°)of complex 1
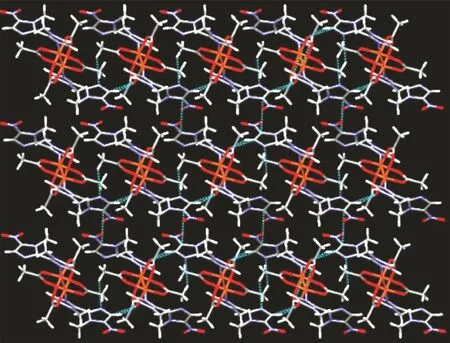
图5 配合物1的二维结构Fig.5 Two‑dimensional structure of complex 1
2.3 配合物2溶液的稳定性
室温下测定了配合物2在Tris‑HCl缓冲液(pH=7.1)中0、24、48 h的UV‑Vis吸收光谱。图6表明,在Tris‑HCl缓冲液中,配合物2的UV‑Vis光谱随时间变化基本保持不变,表明配合物2在溶液中是基本稳定的[27]。

图6 配合物2在Tris‑HCl缓冲液(pH=7.1)中的UV‑Vis光谱Fig.6 UV‑Vis spectra of complex 2 in Tris‑HCl buffer(pH=7.1)
2.4 配体及配合物与ct⁃DNA相互作用
首先用紫外吸收光谱对配体L及其配合物与ct‑DNA的相互作用进行了表征。从DNA浓度对配体及配合物1、2的紫外吸收光谱的影响可以看出(图7),随着向配合物中滴加ct‑DNA量的增加,配体L的紫外吸收表现为略微的减色效应,最大吸收峰几乎没有发生位移。而配合物1和2在240和340 nm附近的紫外双吸收峰发生了扰动,尤其是240 nm附近电子吸收峰的位移和强度都发生了改变,其最大吸收峰发生了红移(≥2 nm),且有一定程度的增色效应。出现这种现象可能是配合物与DNA结合,导致了溶液中配合物聚集以及配合物分子之间氢键的破坏[28‑30]。

图7 不同浓度的DNA存在时配体L及其配合物1、2的紫外吸收光谱Fig.7 UV absorption spectra of ligand L and its complexes 1,2 in the presence of DNA with different concentrations
采用荧光光谱对配体L及其配合物与ct‑DNA的相互作用进一步进行研究。DNA浓度对配体及配合物1、2的荧光光谱的影响如图8所示。随着DNA浓度的增大,配合物1的荧光光谱强度明显增加,这说明配合物1与DNA有较强的相互作用。而配体L及配合物2的荧光强度随着DNA浓度的增加逐渐减小,发生明显的减色效应。配体L的荧光发射峰发生了较大的红移,配合物2的峰则未观察到偏移。当小分子与DNA以静电结合模式作用后,二者在水溶液中互相碰撞发生能量交换,可导致小分子的荧光光谱发生猝灭[31]。由此推测,配体及配合物2可能与DNA以静电结合或沟渠结合模式相互作用。
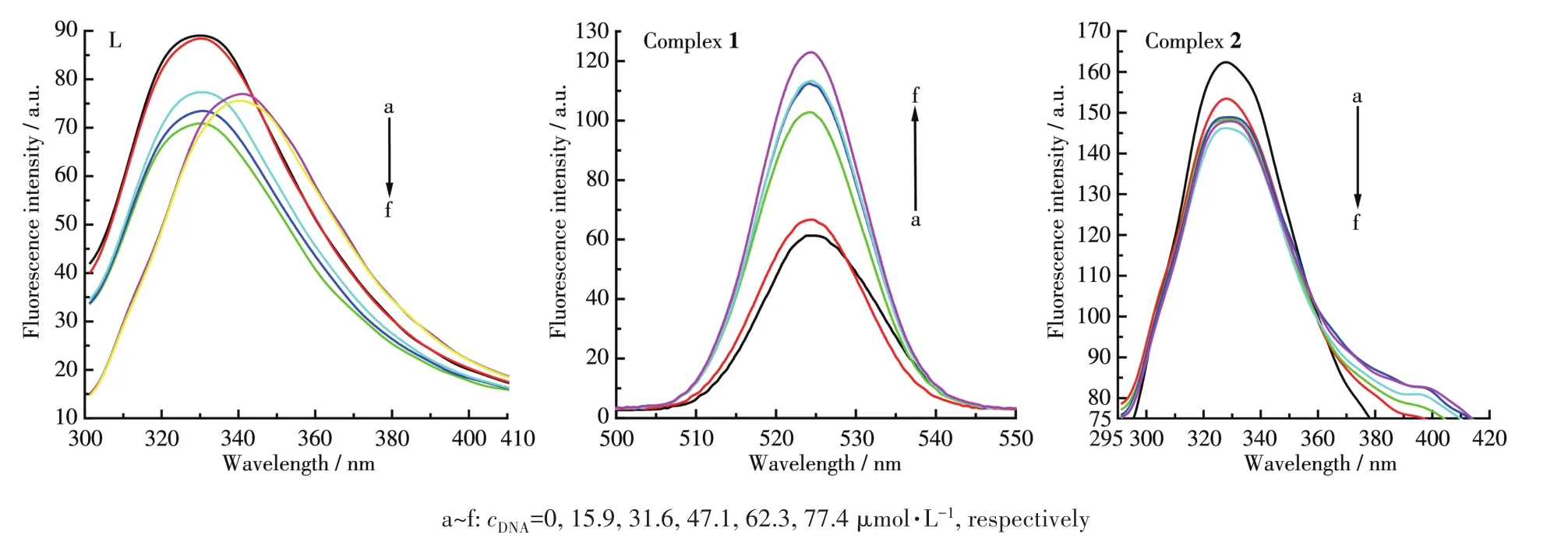
图8 不同浓度的DNA存在时配体L及其配合物1、2的荧光光谱Fig.8 Fluorescence spectra of ligand L and its complexes 1,2 in the presence of DNA with different concentrations
从配体L及配合物浓度对DNA黏度的影响曲线(图9)可以看出,随配体L及配合物2浓度的增加,DNA的相对黏度几乎不变,可能是由于它们以静电结合或沟渠结合模式与DNA相互作用,因为二者相互作用较弱,DNA双螺旋结构未发生变化,因而黏度变化不大。这与光谱实验结果一致。而DNA的相对黏度随配合物1浓度的增加显著降低,这说明配合物1可能以部分插入方式使DNA双螺旋发生扭曲,导致其黏度减小[32]。
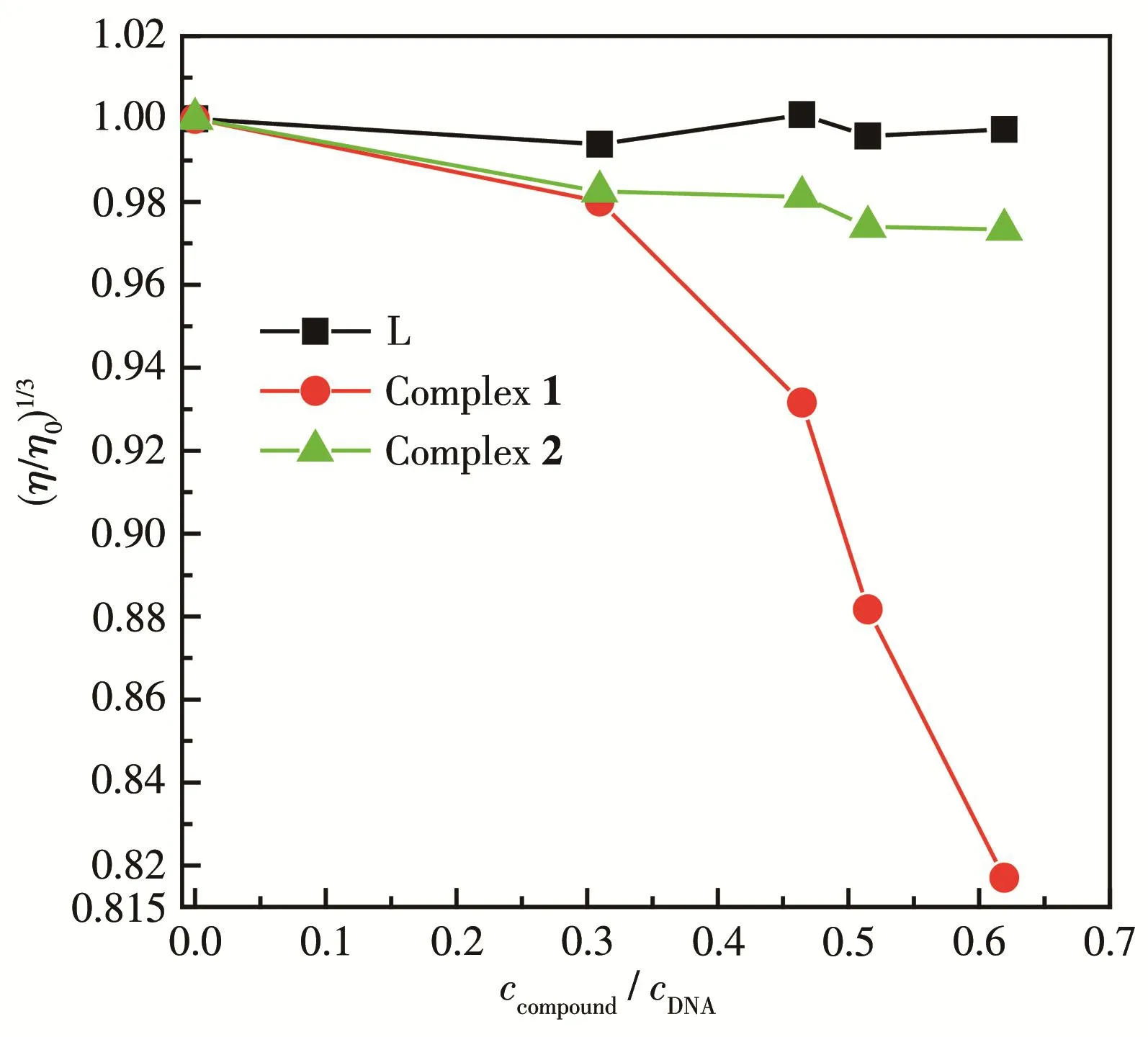
图9 配体及其配合物1、2浓度增大对DNA黏度的影响Fig.9 Effects of increasing concentrations of ligand L and its complexes 1,2 on viscosity of DNA
2.5 配体及其配合物抗厌氧菌活性研究
对配体L及其配合物1、2进行抗厌氧菌活性试验,并以经典的抗厌氧菌药物甲硝唑(Metronidazole)作为对照,测试结果如表3所示。结果表明,参与抑菌实验的所有药物对A.a的抑菌效果更强,而配体L对A.a的抑菌效果还要强于甲硝唑,其MIC值最小,但其2种配合物的抗A.a菌活性与甲硝唑相当,说明金属离子并未起协同作用。而对于S.mutans的抑菌活性高低顺序为配合物2>配体>配合物1,甲硝唑对变异链球菌几乎无抗菌活性,说明这些药物对不同厌氧菌菌株的抗菌性有一定的选择性。

表3 配体L和配合物1、2及其他化合物对S.mutans和A.a的MICTable 3 MIC of ligand L,its complexes 1,2 and other compounds on S.mutans and A.a
硝基咪唑类化合物抑菌的作用机制研究结果表明,硝基咪唑类化合物能有效地渗透细菌的细胞膜,与细菌的DNA螯合形成复合物,抑制DNA复制,进而达到杀灭致病菌之功效[33]。虽然化合物与DNA相互作用的结果表明,配合物1与DNA相互作用较强,但其抗菌活性却并非最高,说明金属配合物抗厌氧菌机制不完全是靶向于细菌的DNA。金属配合物抗厌氧菌机制较为复杂,还需要进一步研究。
3 结 论
设计、合成了N,N′‑二甲基‑5‑硝基‑2,2′‑联咪唑(L)的铜、银配合物[Cu2(L)(Ac)2]2(1)和[Ag(L)(NO3)]·H2O(2),测定了配合物1的单晶结构,通过元素分析、UV‑Vis、FT‑IR、固体荧光光谱、质谱、摩尔电导率及热重分析等测试方法对配合物2进行了表征。结果表明有机配体L分别与醋酸铜、硝酸银作用形成了结构不同的配合物,配合物1是一个由醋酸根桥联的双核对称桨轮笼型结构的配合物,而配合物2可能是一个直线型的单核配合物。紫外吸收光谱、荧光光谱及黏度分析法的结果表明配合物1与ct‑DNA相互作用模式可能为部分插入,而配体及配合物2则为静电或沟渠作用模式。配体L对伴放线放线杆菌(A.a)表现出优于甲硝唑的抗厌氧菌活性,有望成为一种有效的抗厌氧菌药物。

