荧光/MRI双模态靶向成像诊疗试剂的制备
陈庆涛 石向东 梁娓娓 姜利英 方少明 陈凤华*,
(1郑州轻工业大学材料与化学工程学院,郑州 450002)
(2郑州轻工业大学电气信息工程学院,郑州 450002)
肿瘤的“诊疗一体化”是在肿瘤细胞的早期筛查和早期诊断的基础上进行同步治疗,可以大幅度提高肿瘤患者的治愈率、生活质量、生存期及生存率。因此,研发新型多功能诊疗制剂(theranostic agent)具有重要的意义[1]。纳米技术的出现为癌症诊疗一体化的实现带来了新的希望。其中,分子成像技术是癌症诊疗一体化的核心和重要基础。
磁共振成像(magnetic resonance imaging,MRI)作为一种先进的分子影像技术,具有无损伤性、高分辨率等优点,已经广泛用于临床疾病诊断,而30%以上的MRI诊断需要使用造影剂[2‑3]。以钠盐或者葡甲胺盐的离子形式用于临床的Gd‑DTPA(Magnevist,二乙三胺五乙酸钆)是应用广泛的小分子离子型T1造影剂,但它产生的渗透压较高,并且易经肾脏代谢后迅速排出,在体内存留时间较短;同时不具有组织及器官的选择性和靶向性[4‑5],往往需要对其进行修饰。对于多胺多羧酸配合物而言,其弛豫效率主要由旋转相关时间决定[6],所以增大配合物分子的体积一方面可以提高弛豫效率,另一方面由于大分子本身的特点,向大分子中引入特定的对人体某一组织器官具有亲和性的基团,还能增强选择性或者靶向性。因此,对Gd‑DTPA进行的大分子修饰近年来研究得比较多,现在已报道的有将小分子Gd‑DTPA造影剂共价或者非共价的与血红细胞[7]、蛋白质[8‑9]、多糖[10‑11]、聚氨基酸[12]、树枝状大分子[13]及人工合成的其他生物相容性高分子[14]相结合,用于提高弛豫效率,增强成像的对比度和清晰度。
石墨烯量子点(graphene quantum dots,GODs)因其显著的量子限域和边缘效应呈现出多种独特的物理化学性能,此外GODs表现出的低细胞毒性、良好溶解性、稳定的光致发光等优点,使其成为极好的生物成像探针,已被人们广泛用于细胞及组织成像的研究[15‑17]。若将 Gd‑DTPA 修饰负载在 GODs上,一方面可以增大Gd‑DTPA造影剂的分子体积,增强T1阳性造影效果,提高肿瘤检测的准确性;另一方面利用GODs的荧光成像,可以改善MRI成像存在的灵敏度低和信号采集耗时长等缺点,同时还可利用GODs表面较好的接枝性能及大的比表面积,偶联针对不同肿瘤的靶分子和通过π‑π堆垛吸附具有芳环结构的抗癌药物,实现肿瘤细胞的诊疗一体化。
故我们在聚乙二醇二胺(NH2‑PEG‑NH2)修饰的GODs表面以酰胺键偶联二乙基三胺五乙酸(DTPA)分子,之后将Gd3+离子与其进行配合,得到GODs‑Gd(DTPA)复合纳米粒子,然后再通过酰胺键在GODs‑Gd(DTPA)的表面修饰叶酸(FA)靶分子,最后将阿霉素(DOX)进一步通过π‑π堆垛吸附在该造影剂的表面,制备GODs‑Gd(DTPA)荧光/MRI双模态靶向肺癌细胞成像诊疗试剂FA/GODs‑Gd(DTPA)/DOX,具体制备流程如图1所示。
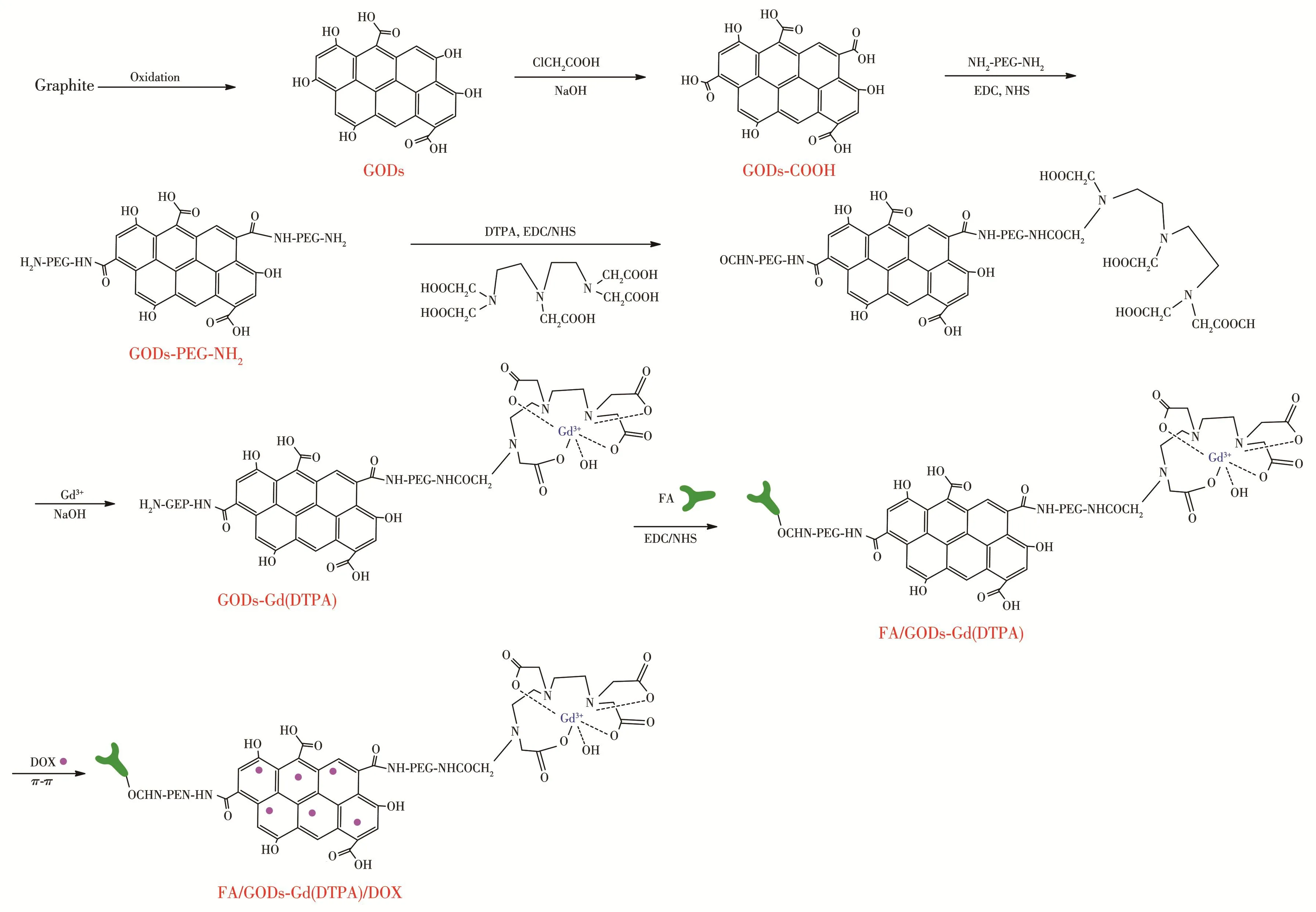
图1 荧光/MRI双模态成像诊疗试剂(FA/GODs‑Gd(DTPA)/DOX)的制备过程Fig.1 Preparation process of double‑fluorescence/MRI dual targeted imaging diagnostic reagents(FA/GODs‑Gd(DTPA)/DOX)
1 实验部分
1.1 试剂
1‑乙基‑(3‑二甲基氨基丙基)碳酰二亚胺盐酸盐(EDC·HCl,纯度大于 98.5%)、DTPA、氯乙酸钠购于Sigma‑Aldrich公司;天然石墨、氯化钆(Ⅲ)六水合物购于上海阿拉丁生化科技股份有限公司;(NH2‑PEG‑NH2,MW=10 000)购于 Jenkem Techonology;浓硫酸、浓盐酸、发烟硝酸、醋酸钠、无水碳酸钠、氢氧化钠、三乙胺、二甲基亚砜、碳酸氢钠等其他所用试剂均为分析纯,购于国药集团化学试剂有限公司;磷酸盐缓冲盐溶液(PBS)和DOX购于BBI公司;H460和HLF细胞为肿瘤医院赠送,细胞培养基、MTT购于上海普飞生物科技公司;实验所用水均为三次水和电阻为18.2 MΩ以上的超纯水。
1.2 实验过程
1.2.1 GODs的制备及修饰
根据文献制备GODs[18],具体步骤如下:将0.2 g的天然石墨加入到15 mL浓硫酸和5 mL发烟硝酸的混合浓酸中,超声10 min后于120℃搅拌反应30 min。反应结束后,冷至室温,加入100 mL去离子水稀释反应物,并用NaHCO3溶液调节pH值为7~8,然后将反应溶液转移到透析袋(截留分子量为14 kDa)中透析48 h除去多余的盐,最后得到浓度为1.47 mg·L-1的焦黄色的GODs分散液。向此40 mL的GODs分散液中依次加入2.9 g NaOH和6.16 g ClCH2COONa,超声反应2 h后用稀HCl调节pH值到中性,然后超滤去除未反应的小分子,得到羧基化的GODs分散液(GODs‑COOH,浓度为0.3 mg·mL-1)。
取30 mL GODs‑COOH溶液,依次向内加入1 mL NH2‑PEG‑NH2溶液(50 mg·mL-1)和 0.3 mL EDC·HCl水溶液(80 mg·mL-1),用三乙胺调节pH值到8后室温搅拌反应24 h。反应结束后转移到截留分子量为14 kDa的透析袋中,透析2 d除去未反应完的小分子和 NH2‑PEG‑NH2,得到末端带有—NH2的聚乙二醇链修饰的GODs液(GODs‑PEG‑NH2)。
1.2.2 FA/GODs‑Gd(DTPA)的制备
向含有0.1 g DTPA的5 mL DMSO溶液中加入5 mL所制备的GODs‑PEG‑NH2分散液、1 mL EDC的DMSO溶液(50 mg·mL-1)和50 μL的三乙胺,搅拌反应24 h后将产物转移到透析袋内透析2~3 d,得到GODs‑DTPA溶液,然后向此溶液中加入10 mL GdCl3溶液(20 mmol·L-1),搅拌反应 4 h,最后透析除去未反应的GdCl3得到GODs‑Gd(DTPA)纳米粒子。
取10 mL GODs‑Gd(DTPA)纳米粒子的分散液,超声30 min后用三乙胺调pH值为8左右,然后依次向内加入10 mL FA溶液(0.1 mg·mL-1)和1 mL EDC·HCl水溶液(80 mg·mL-1),室温搅拌反应48 h。反应结束后,超滤去除未反应的FA,得到修饰有FA的GODs‑Gd(DTPA)纳 米 粒 子 (FA/GODs‑Gd(DTPA))。ICP‑MS测试结果表明样品中Gd3+的浓度为12.3 μg·mL-1。FA/GODs‑Gd(DTPA)中 FA 的负载率(loading efficiency,LEFA)通过下列公式进行计算:LEFA=(mt,FA-md,FA)/mt,FA×100%,其中,mt,FA为实验投入的FA质量(1 mg);md,FA为未偶联上的FA质量(mg),即收集的所有透析液中的FA含量,根据FA的标准曲线c/(μg·mL-1)=0.306+8.877A进行计算(A为吸光度,R2=0.998 5)。由此可得出FA的负载率为79.8%。
1.2.3 FA/GODs‑Gd(DTPA)/DOX的制备
向 2 mL FA/GODs‑Gd(DTPA)的分散液中加入0.5 mL DOX溶液(1 mg·mL-1),在摇床中过夜,反应结束后,超滤、水洗,将未吸附的DOX去除干净(所有滤液收集于容量瓶中,便于根据紫外吸收光谱测得载药量),得到载有 DOX 的 FA/GODs‑Gd(DTPA)纳米诊疗试剂(FA/GODs‑Gd(DTPA)/DOX)。FA/GODs‑Gd(DTPA)/DOX的载药率(LEDOX),即π‑π堆垛吸附在FA/GODs‑Gd(DTPA)表面的DOX质量占实验投入的DOX质量(0.5 mg)的百分比含量,通过下列公式进行计算:LEDOX=(mt,DOX-md,DOX)/mt,DOX×100%,其中,mt,DOX为实验投入的DOX质量(0.5 mg);md,DOX为未吸附在材料表面的DOX质量,即收集的所有透析液中的DOX含量,根据DOX的标准曲线 c/(μg·mL-1)=0.500 5+0.061 1A进行计算(A为吸光度,R2=0.999 3)。由此可算出FA/GODs‑Gd(DTPA)/DOX的载药率为83.8%。
1.2.4 细胞成像实验
荧光成像实验:在含有10%的胎牛血清和1%的青霉素、链霉素的DMEM培养基中,人肺纤维HLF细胞和肺癌细胞H460细胞分别接种在底部厚度为0.17 mm的细胞培养皿中,置于37℃、CO2体积分数5%的细胞培养箱中培养24 h后,弃去原培养基,分别加入浓度为 50 μg·mL-1的 FA/GODs‑Gd(DTPA)纳米粒子的DMEM培养基,继续培养1 h后,弃去培养基,培养皿用PBS清洗细胞3次除去未进入细胞的纳米粒子,随后用甲醇固定20 min,再次用PBS清洗细胞3次,最后加入1 mL PBS保持细胞形貌,然后置于激光共聚焦扫描显微镜下观察细胞内的荧光。
MRI成像实验:将含有不同浓度Gd3+(15、30、45、60 和 75 μmol·L-1)的 FA/GODs‑Gd(DTPA)纳米粒子与H460细胞孵育24 h后,上清液用PBS清洗3遍,收集细胞加入核磁管,进行细胞MRI成像。所用MRI成像设备为11.7 T Bruker micro‑MRI system,测试参数:TR=300 ms,TE=5.9 ms,matrix=128×96,slicethickness=1mm,FOV=1.60cm×1.80cm,NEX=2。1.2.5 DOX体外释放曲线的测定
分别取2 mL FA/GODs‑Gd(DTPA)/DOX的水分散液置于截留分子量为14 kDa的透析袋中,紧密封口,然后分别置于10 mL 37℃、pH为7.4和5.5的PBS中,定时取0.5 mL释放介质测定其紫外吸收光谱,同时补充等量的释放液,根据DOX工作曲线计算其浓度,并绘制累计释药率-时间曲线。
1.2.6 细胞毒性试验
采用 MTT法检测了 FA/GODs‑Gd(DTPA)纳米粒子负载DOX前后对H460细胞的毒性。把100 μL密度为1×104的H460细胞接种在96孔板中,先在37℃、CO2体积分数5%的细胞培养箱中培养24 h,然后培养基分别被100 μL含有不同浓度的FA/GODs‑Gd(DTPA)纳米粒子和 FA/GODs‑Gd(DTPA)/DOX的培养基替换,细胞在37℃、CO2体积分数5%的细胞培养箱中继续培养24 h后,每个孔中加入15 μL的MTT溶液(5 mg·mL-1),在37 ℃、CO2体积分数5%的培养箱中再孵育4 h,小心倒出培养基后,每孔中加入150 μL的DMSO,震荡10 min。用酶标仪在490 nm处测定其光吸收值(OD值),将没有加入纳米粒子孵育的细胞作为对照组,实验结果由4组平行实验数据求平均值得到:Cell viability=(ODexp/ODcon)×100%,其中ODexp为实验组OD值,ODcon为对照组OD值。
1.3 测试与表征
样品的形貌采用日本JEOL公司JEM‑2100型透射电子显微镜(TEM)进行表征(在200 kV下操作)。采用德国Bruker TENSOR27红外光谱仪对样品进行FTIR光谱分析。采用LabRam HR 800型共聚焦显微镜拉曼光谱仪进行拉曼光谱测试,激发光波长为638 nm。在日本Hitachi U‑3900H型紫外可见光谱仪和F‑4600型荧光光谱仪进行紫外光谱和荧光光谱的测试,采用硫酸奎宁在激发波长360 nm的荧光量子产率0.54为标准,测量计算样品的荧光量子产率。采用英国Malwen公司的Zetasizer Nano ZS型纳米粒度及ζ电位分析仪测试纳米粒子的表面电位。在美国Perkin Elmer Victor X4型酶标仪上测定光吸收值。细胞成像在德国Leica TCS SP5Ⅱ型激光共聚焦扫描显微镜上测试。Gd2+的浓度利用ICP‑AES(Perkin Elmer Optima 8000)进行测定。
2 结果与讨论
2.1 TEM表征
图2为所制备的GODs和FA/GODs‑Gd(DTPA)/DOX分散液的照片及其对应的TEM图片。从图2a中可以看出所制备的GODs溶液呈现焦黄色,分散性较好,经过进一步修饰Gd(DTPA)、FA及DOX后,FA/GODs‑Gd(DTPA)/DOX的分散液呈现红色(图2b)。GODs的TEM照片(图2c)显示所制备的GODs为粒径为1~2 nm的小粒子,尺寸分布较均一,FA/GODs‑Gd(DTPA)/DOX的形貌没有发生变化(图2d),但是粒径增大到了5~6 nm。

图2 所制备的GODs和FA/GODs‑Gd(DTPA)/DOX分散液的照片(a、b)及其对应的TEM图片(c、d)Fig.2 Photographs(a,b)and corresponding TEM images(c,d)of as‑prepared GODs and FA/GODs‑Gd(DTPA)/DOX dispersion
2.2 Raman光谱表征
图3为所制备的GODs(a)和FA/GODs‑Gd(DTPA)/DOX分散液(b)的Raman光谱。图3a中出现了GODs很明显的D带(A1g)和G带(E2g)峰,分别位于1 348和1 602 cm-1处。当GODs修饰上生物功能分子后,除了保留GODs的特征Raman峰外,在FA/GODs‑Gd(DTPA)/DOX的Raman光谱中(图3b)还出现了明显的DOX和FA分子的Raman特征峰,分别位于450 cm-1(δC=O)、991 cm-1(苯环的伸缩振动)、1 083 cm-1(苯环的伸缩振动)、1 244 cm-1(δO—H、δC—H和 δC—OH)、1 575 cm-1(苯环振动和 νC=C)和 1 631 cm-1(νC=O)处。此外,在597 cm-1处可以明显看到归属为Gd—O的Raman峰,以上分析均证明了FA/GODs‑Gd(DTPA)/DOX的成功制备。
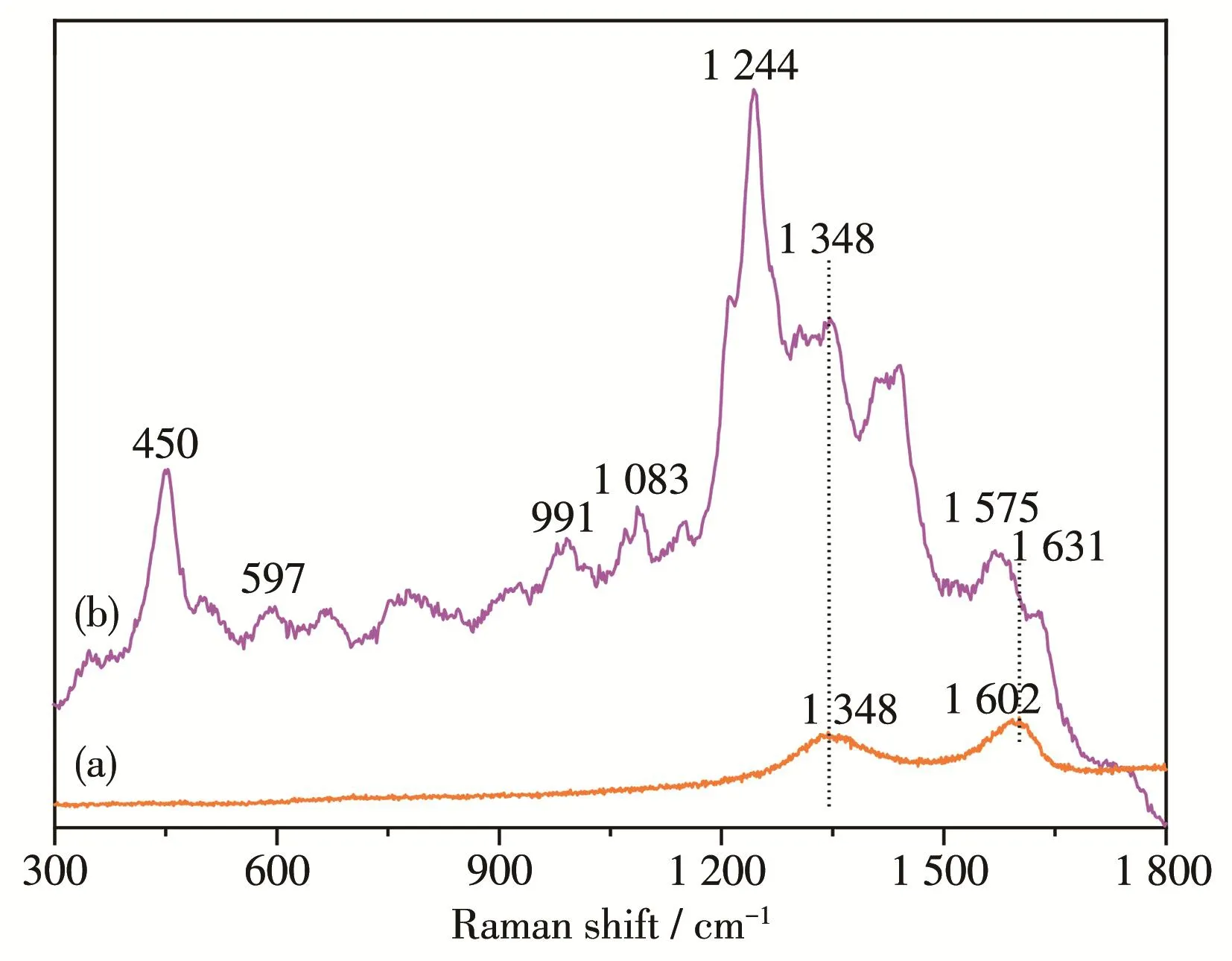
图3 制备的GODs(a)和FA/GODs‑Gd(DTPA)/DOX(b)的拉曼光谱Fig.3 Raman spectra of as‑prepared GODs(a)and FA/GODs‑Gd(DTPA)/DOX(b)
2.3 红外光谱和ζ电位分析
图4为所制备的GODs、GODs‑PEG‑NH2、GODs‑Gd(DTPA)和 FA/GODs‑Gd(DTPA)的FT‑IR谱图。在GODs的红外光谱中(图 4a),3 500~3 100 cm-1范围内的宽吸收峰是由于GODs和GODs吸附水中的羟基产生的O—H伸缩振动,1 727 cm-1处的吸收峰是GODs表面的羰基伸缩振动峰,1 583 cm-1处的吸收峰是GODs中C=C的伸缩振动产生的,在1 005 cm-1处可以观察到C—O的吸收峰。GODs表面共价修饰‑PEG‑NH2后,图4b谱线中出现了明显的N—H的振动峰(3 440 cm-1)、C—N的振动峰(1 238 cm-1)和比较强的—CH2—的C—H振动峰(2 870 cm-1),而且在1 632 cm-1处出现了—CONH—键的吸收峰,这均表明在GODs的表面成功地修饰上了含有氨基的PEG链,便于进一步共价修饰DTPA分子。我们对该过程中的每步产物也进行了ζ电位值的测定,GODs的ζ电位值为-18.3 mV,在其表面修饰羧基官能团后,GODs‑COOH的ζ电位值变为-23.4 mV,经进一步与NH2‑PEG‑NH2反应后,GODs‑PEG‑NH2的ζ电位值升高到了-10.3 mV,充分说明了氨基被成功地修饰在了GODs表面。
图4c为GODs‑Gd(DTPA)的红外谱图,其峰位基本与图4b相同,但是位于1 632 cm-1处的—CONH—键的吸收峰强度明显增强,同时在1 400 cm-1处出现了明显的羧酸盐的特征峰,间接证明了在GODs‑PEG‑NH2纳米粒子表面成功地通过酰胺键接枝上了DTPA分子,并且Gd与配体形成了配合物。由于谱峰重叠,FA/GODs‑Gd(DTPA)的红外谱图(图 4d)与GODs‑Gd(DTPA)的谱峰差别不大,但是可以通过紫外吸收光谱证实FA分子的成功偶联(见后文)。

图4 制备的GODs(a)、GODs‑PEG‑NH2(b)、GODs‑Gd(DTPA)(c)和 FA/GODs‑Gd(DTPA)(d)的红外谱图Fig.4 FT‑IR spectra of as‑prepared GODs(a),GODs‑PEG‑NH2(b),GODs‑Gd(DTPA)(c)and FA/GODs‑Gd(DTPA)/DOX(d)
2.4 荧光光谱和紫外吸收光谱分析
GODs的荧光谱图如图5a所示。结果表明所制备的GQDs的荧光光谱呈现明显的激发波长依赖型的荧光特性[19],当激发光波长分别为300、400和500 nm时,分别在432、512和610 nm处出现了GQDs的荧光发射峰。当GQDs表面修饰Gd(DTPA)和FA后,虽然 FA/GODs‑Gd(DTPA)的荧光光谱(图 5b)强度下降,同时发生了蓝移[20],但是仍然呈现激发波长依赖型的荧光特性,很好地保留了GODs的荧光性能,有利于对细胞的荧光成像检测。根据0.1 mol·L-1稀硫酸溶解的硫酸奎宁溶液和样品稀溶液在360 nm激发波长下的荧光积分强度比值和吸光度比值,以硫酸奎宁在激发波长360 nm的荧光量子产率0.54为标准,计算可得GODs及FA/GODs‑Gd(DTPA)/DOX的荧光量子产率分别为0.028和0.017。
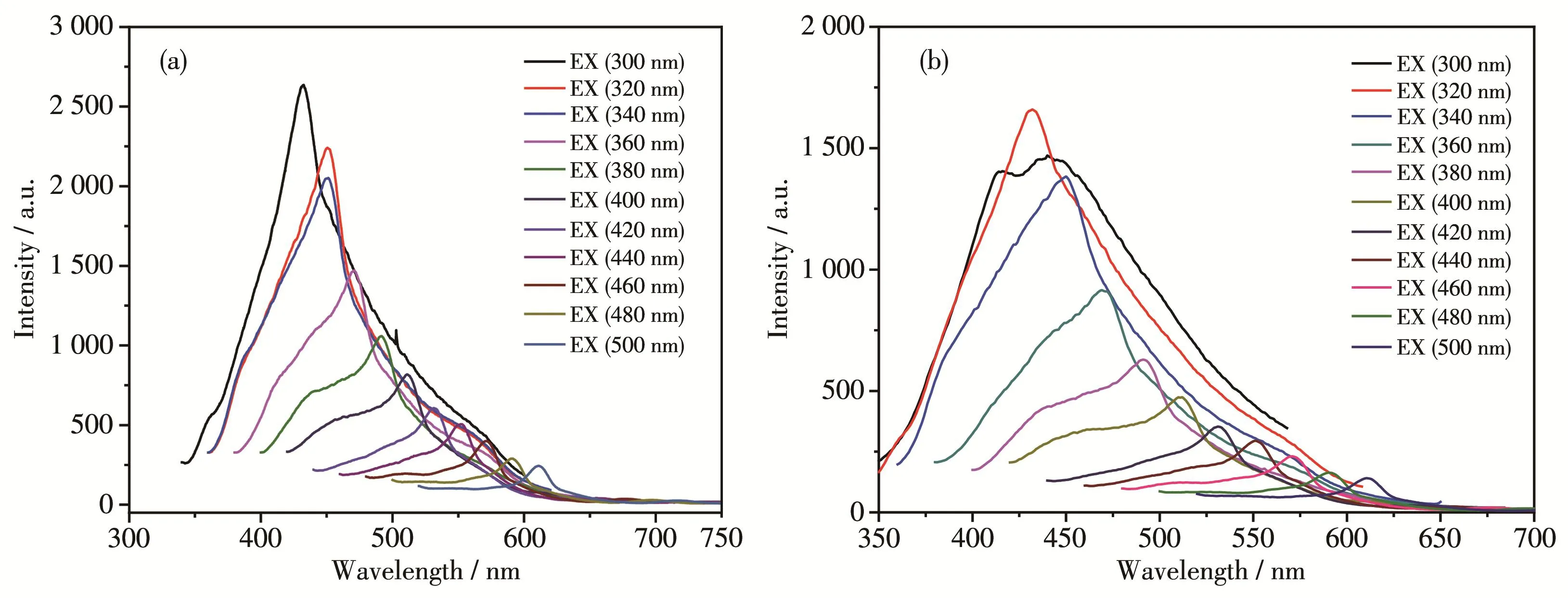
图5 制备的(a)GODs和(b)FA/GODs‑Gd(DTPA)的荧光光谱图Fig.5 Fluorescence spectra of as‑prepared(a)GODs and(b)FA/GODs‑Gd(DTPA)
图6是GODs、FA、DOX、FA/GODs‑Gd(DTPA)和FA/GODs‑Gd(DTPA)/DOX的UV‑Vis吸收光谱。在GODs的光谱图中,由于GODs中碳碳共轭双键π→π*的跃迁而在231 nm处出现了GODs的特征紫外吸收峰[21];FA在254、284和365 nm处有明显的紫外吸收峰,当FA通过成键偶联到GODs‑Gd(DTPA)的表面后,在 FA/GODs‑Gd(DTPA)的 UV‑Vis谱图中同时出现了FA位于250~280 nm范围处的紫外吸收峰和GODs在231 nm处的紫外吸收,证明FA分子成功地通过酰胺键修饰到了GODs‑Gd(DTPA)的表面,制备了具有靶向功能的荧光成像纳米制剂。当FA/GODs‑Gd(DTPA)进一步通过π‑π堆垛作用吸附DOX后,FA/GODs‑Gd(DTPA)/DOX的UV‑Vis谱图中又出现了DOX位于233和480 nm处的明显特征吸收峰,表明DOX成功地担载在所制备的具有靶向功能的石墨烯量子点上,可实现肿瘤细胞的诊疗一体化。
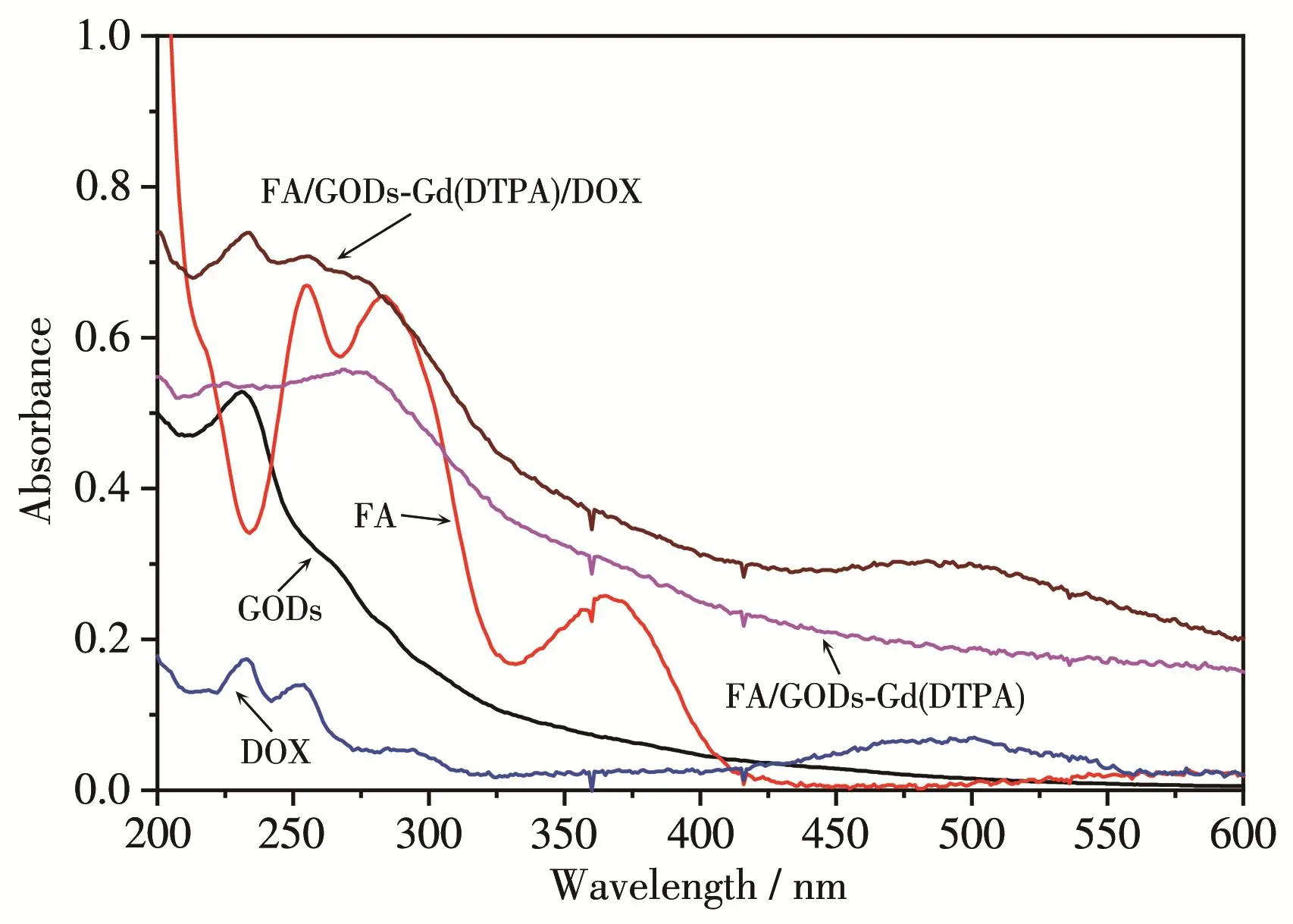
图6 GODs、FA、DOX、FA/GODs‑Gd(DTPA)和FA/GODs‑Gd(DTPA)/DOX的UV‑Vis谱图Fig.6 UV‑Vis spectra of GODs,FA,DOX,FA/GODs‑Gd(DTPA)and FA/GODs‑Gd(DTPA)/DOX
2.5 细胞的荧光成像
图7是所制备的FA/GODs‑Gd(DTPA)纳米试剂分别与肺癌细胞H460(a)和人肺纤维HLF正常细胞(b)共孵育1 h后的激光共聚焦显微照片。从图7a可以看出,在H460细胞中能够检测到GODs的绿色荧光,而在对比实验中,HLF正常细胞中的绿色荧光非常弱(图 7b),说明 HLF 对 FA/GODs‑Gd(DTPA)的吞噬很少。这是因为HLF为FA受体低表达的正常细胞,从而导致细胞内绿色荧光较弱,而H460为FA受体高表达的实体肿瘤细胞,通过FA受体的介导作用,修饰有FA分子的纳米粒子优先被H460所吞噬,显示了FA/GODs‑Gd(DTPA)在肿瘤早期的荧光成像检测中的应用前景。
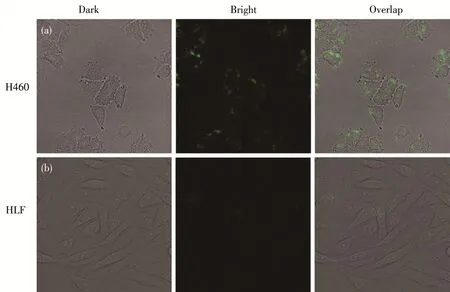
图7 FA/GODs‑Gd(DTPA)分别与肺癌细胞H460(a)和人肺纤维HLF正常细胞(b)共孵育1 h后的激光共聚焦显微镜明场、暗场和重叠照片Fig.7 Bright field,dark field and overlap laser confocal microscopy images of H460 lung cancer cells(a)and HLF human lung fiber normal cells(b)incubated with FA/GODs‑Gd(DTPA)for 1 h,respectively
2.6 MRI成像实验
ICP‑AES检测所制备的FA/GODs‑Gd(DTPA)样品 中 Gd3+的 浓 度 为 12.3 μg·mL-1。 FA/GODs‑Gd(DTPA)的体外MRI的T1增强性能见图8a。随着FA/GODs‑Gd(DTPA)分散液中 Gd3+浓度的增大,T1加权像依次变亮,对比增强效果逐渐显著,证明FA/GODs‑Gd(DTPA)可实现 MRI的 T1造影成像检测肿瘤细胞的目的。图8b是FA/GODs‑Gd(DTPA)样品的弛豫率(r1)拟合图,从纵向弛豫时间T1的倒数随Gd3+的浓度变化图斜率可计算出FA/GODs‑Gd(DTPA)的r1值为9.92 L·mmol-1·s-1。
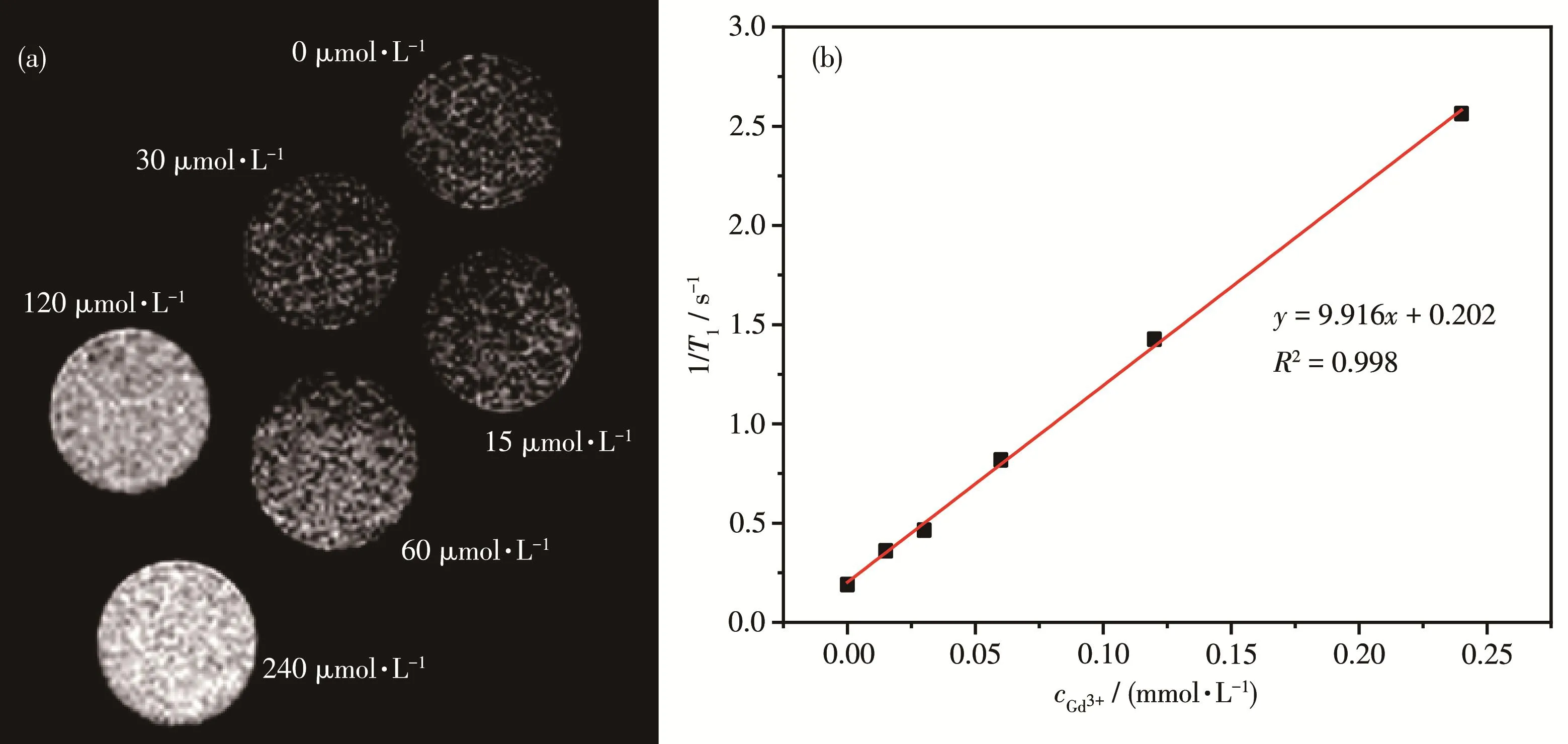
图8 (a)含有不同Gd3+浓度的FA/GODs‑Gd(DTPA)与H460细胞孵育24 h后T1加权的MRI;(b)FA/GODs‑Gd(DTPA)样品的1/T1vscGd3+线性拟合图Fig.8 (a)T1weighted MRI of FA/GODs‑Gd(DTPA)incubated with H460 cells for 24 h with different concentrations of Gd3+;(b)Linear fitting for plot of 1/T1vscGd3+of FA/GODs‑Gd(DTPA)sample
2.7 DOX的载药量及释放曲线
根据DOX的标准曲线计算,1 mL FA/GODs‑Gd(DTPA)/DOX诊疗试剂的分散液中含有209 μg DOX。图9为该诊疗试剂分别在pH值为5.5和7.5条件下的DOX释放曲线。从图中可以看出,在pH=5.5时的DOX释放速率明显高于pH=7.5条件下的释放速率,这是由于DOX分子与GODs之间的π‑π堆垛作用在酸性质子化的环境下降低,有利于药物分子的脱附[22]。以上结果说明在接近中性的血液中(pH=7.4),FA/GODs‑Gd(DTPA)/DOX诊疗试剂的传输相对比较稳定,而在弱酸性的肿瘤细胞内能够很好地释放,从而进一步增强了诊疗试剂的靶向性。

图9 在PBS中、37℃下FA/GODs‑Gd(DTPA)/DOX在pH值分别为7.5和5.5条件下DOX的释放曲线Fig.9 Release profiles of DOX from FA/GODs‑Gd(DTPA)/DOX at pH=7.5 and 5.5,respectively,in PBS at 37 ℃
2.8 细胞毒性试验
采用 MTT法检测了 FA/GODs‑Gd(DTPA)纳米粒子负载DOX前后对H460细胞的毒性。图10为同浓度的 FA/GODs‑Gd(DTPA)纳米颗粒(50~200 μg·mL-1)与肺癌细胞H460在37℃孵育48 h后的细胞活性,与对照组相比,细胞存活率稍微低了一些,但没有明显的差异。结果说明FA/GODs‑Gd(DTPA)纳米颗粒对H460细胞的毒性非常低,可以作为潜在的探针用于肿瘤靶向检测。负载DOX后,FA/GODs‑Gd(DTPA)/DOX对H460细胞的杀伤力明显增强,并且与单独的DOX(按照DOX的质量浓度进行计算,分别为40、80、120、160 μg·mL-1)相比,更好地提高了DOX的抗肿瘤活性。

图10 H460细胞与不同浓度的FA/GODs‑Gd(DTPA)、DOX和FA/GODs‑Gd(DTPA)/DOX孵育48 h后的细胞存活率Fig.10 Cell viability of H460 cells incubated with different concentrations of FA/GODs‑Gd(DTPA),DOX and FA/GODs‑Gd(DTPA)/DOX for 48 h,respectively
3 结 论
通过化学键作用依次将MRI造影剂Gd(DTPA)和叶酸(FA)分子修饰在了石墨烯荧光量子点(GOGs)的表面,并将阿霉素(DOX)进一步通过π‑π堆垛作用吸附在其表面,成功制备了FA/GODs‑Gd(DTPA)/DOX荧光/MRI双模态靶向肺癌细胞成像诊疗试剂。MRI和共聚焦激光扫描显微镜结果表明,相对于正常的HLF细胞,所制备的纳米试剂可以有效地靶向检测FA受体高表达的肺癌H460细胞,在接近中性的血液中,FA/GODs‑Gd(DTPA)/DOX诊疗试剂的传输相对比较稳定,而在弱酸性的肿瘤细胞内能够很好地释放,显示了其在肿瘤细胞的检测和治疗中潜在的应用前景。

