Cu/MoS2的熔盐电解法制备及其在碱性条件下析氢反应性能的提高
王子鸣 卢雅宁 唐 梦 张 爽 王英财 张志宾 刘云海 柳玉辉
(东华理工大学核资源与环境国家重点实验室,南昌 330013)
0 引言
如今随着时代的发展,人类对于能源的依赖性日益增加。煤炭、石油、天然气等传统化石燃料能源在地球中的含量有限,并且属于非再生能源,所以寻找一种储备含量丰富的可再生新能源就成了重中之重[1]。与其他化石燃料相比,氢气在燃烧过程中不会产生有毒气体[2‑3],而不同于传统方法的电解水析氢反应(HER)成为了首选的制氢方法。但是由于其反应动力学过程缓慢,通常在HER过程中需要添加高活性的催化剂来提高催化效率并增加催化产物。目前而言,一些贵金属(如Pt[4])由于吸附氢的吉布斯自由能小以及自身优越的选择性和稳定性等原因,是目前性能较好的催化剂,但由于其价格昂贵、储备量稀少,很难实现商业和工业化应用。
近几十年来,非贵金属二维材料由于其独特的电学、光学以及廉价的特性,已经被广泛应用于HER中,其中被研究较多的是过渡金属硫族化合物(TMDs)。而二硫化钼(MoS2)作为二维TMDs中的典型代表,已被科学家广泛研究。Hinnemann等[5]通过密度泛函理论(DFT)计算发现,Mo原子吸附氢的吉布斯自由能与贵金属Pt相接近,因此推测其可能具有优异的析氢催化活性;Raybaud等[6]使用ab initio算法发现MoS2的二维平面面内是惰性的,活性位点在其边缘上;而 Bonde和 Jaramillo等[7‑8]先计算MoS2中Mo和S原子边缘吸附氢的吉布斯自由能并测试其电化学性能,再通过扫描电子显微镜(SEM)观察MoS2纳米粒子边缘的长度,进一步证实MoS2的反应活性位点确实是边缘。尽管如此,大量的理论研究和实验结果也表明MoS2存在着一些问题[9‑12]:首先,MoS2的基底面是催化惰性的;其次,MoS2的电子迁移率和导电性较差;最后,由于在合成MoS2材料过程中很容易发生聚集现象,这会覆盖有用活性位点,而且想要同时得到具备较高的导电性和较多的活性位点是比较困难的。这些问题也进一步限制了MoS2作为HER催化剂的应用。
但是随着研究的不断深入,研究者们发现通过一些手段可以提高MoS2在HER过程中的催化性能:Wu等[13]通过球磨法合成了一种新的MoS2纳米结构,经高温处理后在电流密度4.56 mA·cm-2时过电位可达150 mV,Tafel斜率可达68 mV·dec-1,证明可以通过提高比表面积获得更多的活性位点从而提高其催化活性;Li等[14]通过DFT理论计算表明MoS2在其惰性表面上的硫空位是新的活性位点,通过硫缺陷可以使其具有更高的HER催化活性;而Hai等[15]通过往2H构型MoS2中掺杂Co元素并形成晶体缺陷,使其惰性表面HER催化性能有了大幅度的提升。
以上方法本质上都是通过增加MoS2活性位点的数目和改变MoS2的电子结构从而改善MoS2的HER催化活性。而掺杂作为一种最普遍的使用方法,对提高MoS2的HER催化活性具有研究和指导性意义。因此,我们选用过渡金属Cu掺杂2H构型MoS2制备Cu/MoS2复合材料,以提高其催化活性。
MoS2可分为1T、2H、3R三种晶体构型。结合图1可知,在单层结构下,1T构型为八面体配位,而2H构型和3R构型为三棱柱配位。但是,2H构型和3R构型中同一个Mo原子连接6个S原子,S原子组成的三角形上下互为镜像,这有别于1T构型。而多层MoS2是由八面体或三棱柱配位单层所组成,每一层都可以具有这2种状态中的任意一种。最常见的2H构型MoS2有着类似却又不同于石墨烯的二维层状结构,其单层MoS2是一种独特的三明治夹层结构,即S—Mo—S,层内原子之间通过共价键/离子键[16‑17]连接;而多层MoS2的层与层之间通过微弱的范德华作用力连接,层间距约为0.65 nm[18]。范德华作用力的影响会造成层与层之间的堆积,从而进一步限制MoS2在HER中的电子迁移过程[19]。

图1 MoS2不同晶体构型的金属配位方式、俯视视角和堆垛排序图Fig.1 Metal coordination,top view and stacking sequence diagrams of different crystal types of MoS2
传统MoS2制备方法主要可分为物理法和化学法,其中化学法中最常见的主要是水热法[20]、气相沉积法[21]、电化学沉积法[22]等。水热法的优势在于其操纵手段的可控性强,获得的产物更接近于理想特性,比如结晶度高、杂质少,但对反应所用的高压反应釜要求过高;而气相沉积法所合成的产物质量高、尺寸大,但其工艺流程比较复杂;电化学法是利用含硫源和钼源的电解质溶液中的离子发生氧化还原反应,将目标产物沉积到电极上的一种方法。该法工艺流程简便且可控性强,可以使用不同的电沉积手段(如恒电流、恒电位等)并改变不同的参数(时间、温度等)从而得到不同形貌的产物。我们使用熔盐电解法来制备2H型MoS2,并在此基础上掺杂过渡金属Cu以改善MoS2的HER催化活性。
1 实验部分
主要试剂LiCl、KCl、Na2MoO4、KSCN、CuCl2等均为分析纯,购自上海阿拉丁生化科技股份有限公司;玻碳电极直径为5 mm,钼丝直径为1 mm,纯度99.99%。
1.1 Cu/MoS2的制备
首先使用电子分析天平(CPA225D,北京赛多利斯仪器系统有限公司)分别称取LiCl(42.0 g)、KCl(51.3 g)、KSCN(6.0 g)、Na2MoO4(4.0 g)、CuCl2(1.5 g),混合均匀后放入坩埚中,将坩埚置于真空干燥箱(573 K,6 h)中烘干,之后将坩埚放入马弗炉中加热至1 073 K使其熔化。以钼丝为阴极,玻碳电极为阳极,电解2 h后得到黑色沉淀物。之后将黑色沉淀物洗涤、抽滤、干燥,得到最终产物Cu/MoS2。在低温(550℃)、低电流(0.5 A)电解下制备的材料命名为Cu/MoS2‑nanoflowers,在高温(750 ℃)、高电流(2.0 A)电解下制备的材料下命名为Cu/MoS2‑nanosheets。
1.2 表征与测试
分别称取上述样品0.1 g、蒸馏水5 mL、无水乙醇5 mL、质量浓度5% Nafion溶液0.32 mL混合放入离心管中并将其在超声清洗机里放置1 h使其均匀分散开,然后将混合溶液均匀滴在面积为1 cm2的碳布上并烘干(电热鼓风干燥箱,WGL‑65B,天津市泰斯特仪器有限公司)。之后在三电极工作体系下(直流电源EPS‑1530MD,深圳市兆信电子仪器设备有限公司;电化学工作站Interface 5000E,广州市刚瑞普凡科学仪器有限公司),以Ag/AgCl为参比电极,玻碳电极为对电极,夹杂在钛框里的碳布为工作电极,电解质为1 mol·L-1的KOH溶液。使用X射线衍射(XRD,Bruker D8‑A25,德国Bruker公司进行物相分析,Cu靶Kα辐射,波长0.154 06 nm,管电压40 kV,管电流40 mA,扫描范围0°~140°);使用扫描电子显微镜(SEM,Nova Nano 450,荷兰有限公司,工作电压15 kV)和能量色散X射线光谱仪(EDS)观察样品微观形貌和微观化学结构;使用X射线光电子能谱(XPS,Axis Nova,英国自雷尼绍公司)分析元素成分和价态;使用高分辨率透射电子显微镜(HRTEM,LS‑780,北京赛多利科学仪器有限公司)和电子选区衍射(SAED)分析微观晶体结构。通过线性扫描伏安法(LSV)测量HER过电势范围,之后通过LSV曲线得出Tafel曲线;使用循环伏安法(CV)通过改变扫速测得双电层电容(Cdl)大小;通过加速耐久性实验(ADT)和计时电位分析(CP)法来测试电化学耐久性能;通过交流阻抗法测量特定电势下的电化学阻抗。
2 结果与讨论
2.1 XRD分析
Cu/MoS2‑nanoflowers 和 Cu/MoS2‑nanosheets 的XRD图如图2所示。由图2可知,在14.378°、29.026°、32.676°、33.508°、44.151°、58.334°、60.144°处均出现衍射峰,对应于六方晶系MoS2(PDF No.37‑1492)的(002)、(004)、(100)、(101)、(006)、(110)、(008)晶面,可以证明掺杂后MoS2的晶型未改变;二者的衍射峰强度不同且(002)晶面峰强均较高,说明其暴露出更多的边缘结构。Cu/MoS2‑nanosheets明显在43.297°、50.433°、74.130°处出现了新的衍射峰(蓝色菱形处),分别与 Cu(PDF No.04‑0836)的(111)、(200)、(220)晶面相对应,说明Cu成功掺杂进MoS2中。
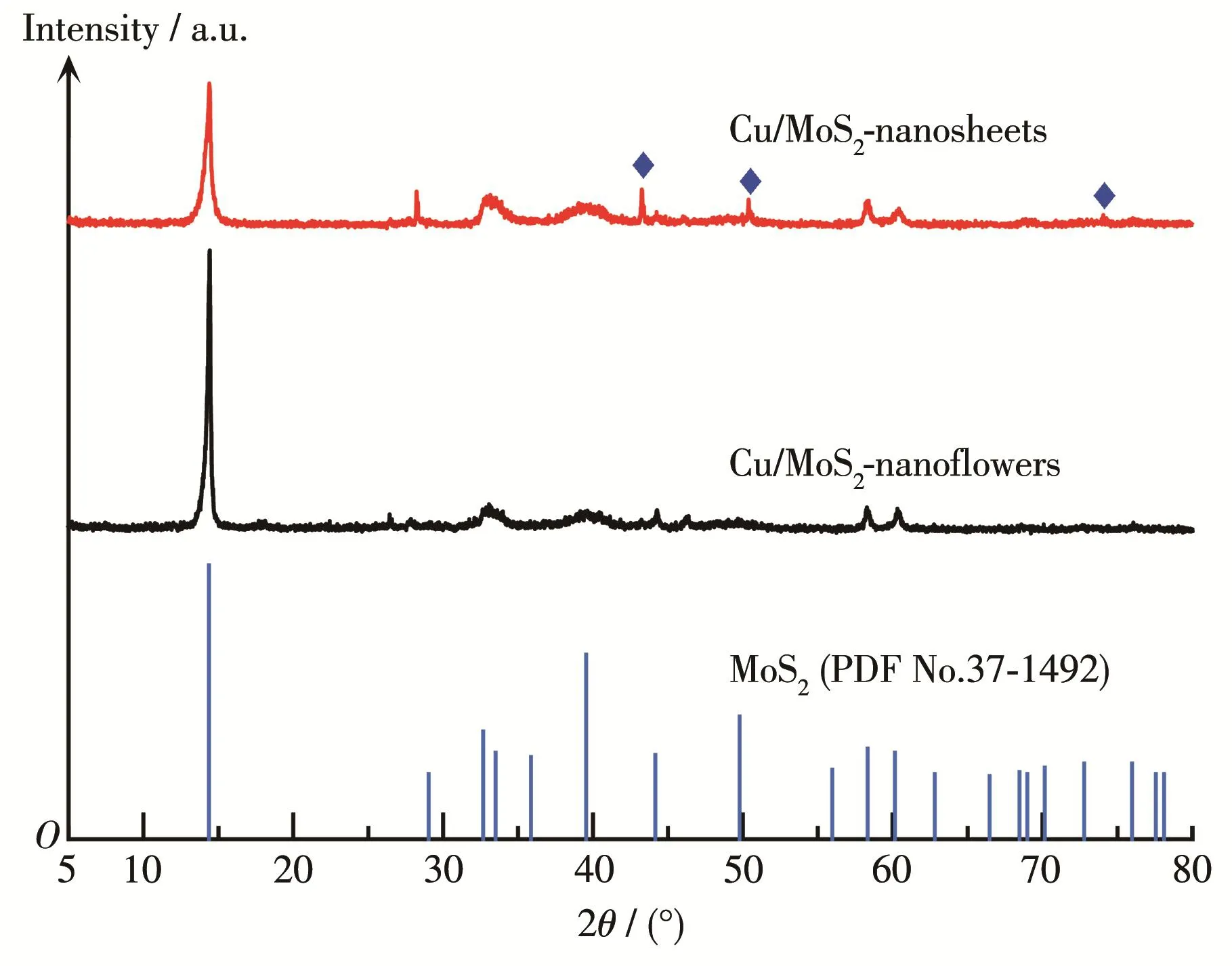
图2 Cu/MoS2‑nanoflowers和Cu/MoS2‑nanosheets的XRD图Fig.2 XRD patterns of Cu/MoS2‑nanoflowers and Cu/MoS2‑nanosheets
2.2 SEM⁃EDS分析
Cu/MoS2‑nanoflowers 和 Cu/MoS2‑nanosheets 的SEM和EDS分析如图3所示。由图3a可知,纳米花状样品的微观形貌表明其层与层之间的堆垛现象较为密集,平均直径约1 μm且有明显的花瓣状结构;而由图3c可知,纳米片状样品平均直径约为2 μm且有明显的片状结构。对比可知,纳米片状和纳米花状样品都是由小且薄的纳米片组成,而前者相较于后者尺寸更大、更厚一些;两者的微观形貌都较为良好。而由EDS分析可知,样品中含有S、Cu、Mo三种元素,其中Cu的质量分数分别为1.519%和0.598%,证明Cu已掺杂成功,与XRD结果相符。
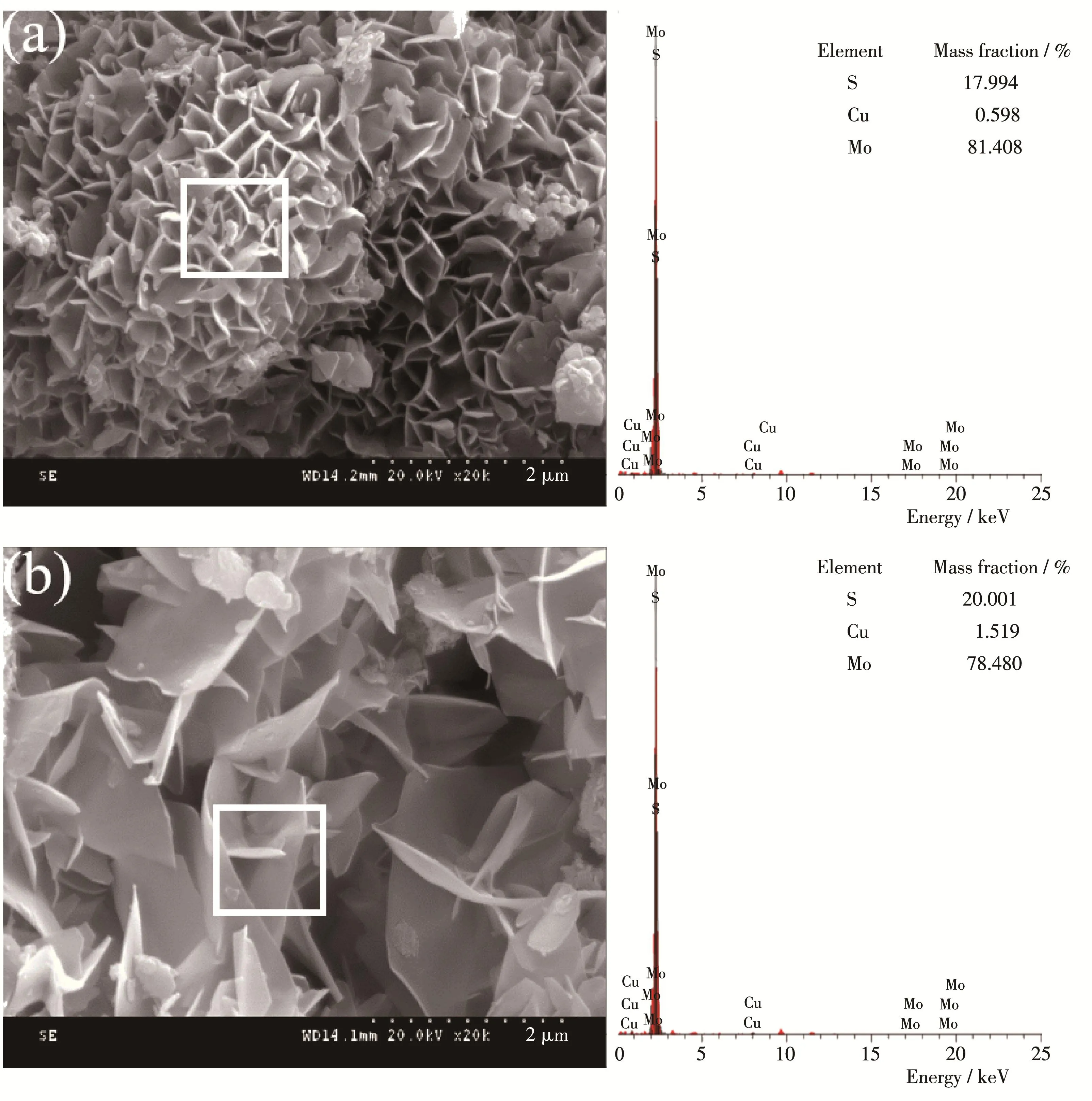
图3 (a)Cu/MoS2‑nanoflowers和(b)Cu/MoS2‑nanosheets的SEM图及EDS谱图Fig.3 SEM images and EDS spectra of(a)Cu/MoS2‑nanoflowers and(b)Cu/MoS2‑nanosheets
2.3 HRTEM与SAED分析
Cu/MoS2‑nanoflowers和 Cu/MoS2‑nanosheets的HRTEM和SAED分析如图4所示。通过标定可知Cu/MoS2‑nanoflowers的晶格间距为0.273和0.268 nm(图 4a、4d),分别对应 MoS2的(100)和(101)晶面。而Cu/MoS2‑nanosheets的晶格间距为0.274和0.228 nm(图 4d、4f),分别对应 MoS2的(100)和(103)晶面。经傅里叶变换(FT)处理后(图 4b、4e)可以看到 Cu/MoS2‑nanoflowers和Cu/MoS2‑nanosheets具有2种类型不同且规则的网格状条纹排布,同时在Cu/MoS2‑nanosheets的部分地方清晰地观察到了晶格缺陷(图4e中圆圈)。而晶格缺陷可以提高样品的电催化活性,这正是Cu掺杂所致。除此之外二者都没有明显地出现大面积的纳米簇现象,说明晶型都较好。而图4c、4f表明二者的SAED图均为衍射斑点和衍射环共存,由此可以判断二者均为多晶,图中3个衍射环分别对应六方晶系MoS2的(100)、(102)、(106)晶面。

图4 Cu/MoS2‑nanoflowers的HRTEM图、FFT变换图和SAED图;Cu/MoS2‑nanosheets的(d)HRTEM图、(e)FFT图和(f)SAED图Fig.4 (a)HRTEM image,(b)FFT image and(c)SAED pattern of Cu/MoS2‑nanoflowers;(d)HRTEM image,(e)FFT image and(f)SAED pattern of Cu/MoS2‑nanosheets
2.4 XPS分析
Cu/MoS2‑nanoflowers和 Cu/MoS2‑nanosheets的XPS分析如图5所示。图5a为使用外来污染碳C1s作为基准峰进行荷电校正的XPS全谱图,该图表明2种材料都含有Cu、Mo、S元素且Mo3d特征峰最为强烈,这进一步说明Cu元素掺杂成功。图5b为Mo3d的XPS谱图,二者在结合能229.9和233.2 eV处的2个特征峰分别对应Mo4+的Mo3d5/2和Mo3d3/2氧化态。然而,Mo3d中不仅出现了S2s的特征峰,还在236 eV附近检测到了较弱的特征峰,对应于Mo6+氧化态。Mo6+特征峰的出现可能是由于在合成样品的过程中不可避免地形成了少量的MoO3。在掺杂Cu后 Cu/MoS2‑nanosheets的 Mo6+含量也随之增加,而且结合能向高场方向偏移,这说明掺杂的Cu与2种材料之间发生了电子转移过程。由图5c可知,S2p中结合能162.8和164.1 eV处分别对应S2-中的2p3/2和2p1/2轨道能级,表明其主要氧化态是S2-。Cu2p谱图中结合能933.3和953.1 eV处分别对应Cu+的2p3/2和2p1/2轨道能级,证明其是以Cu2S的形式存在,而且无伴峰存在(图 5d)。
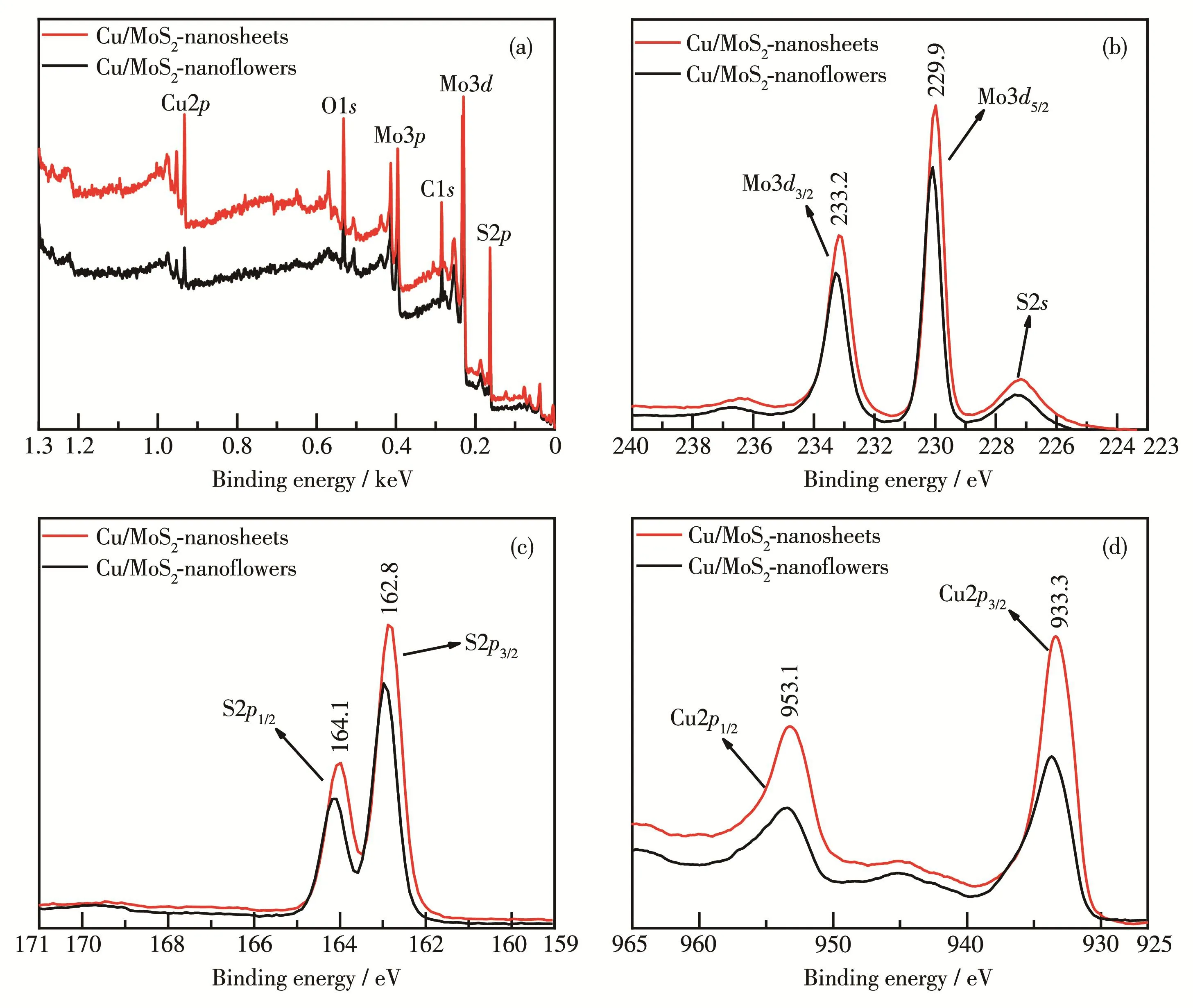
图5 Cu/MoS2‑nanoflowers和Cu/MoS2‑nanosheets的(a)XPS全谱图、(b)Mo3d、(c)S2p和(d)Cu2p XPS谱图Fig.5 (a)Survey,(b)Mo3d,(c)S2p,and(d)Cu2p XPS spectra of Cu/MoS2nanoflowers and Cu/MoS2nanosheets
2.5 电催化析氢性能
Cu/MoS2‑nanoflowers和 Cu/MoS2‑nanosheets的析氢性能分析如图6所示。图6a为相应的LSV曲线,由图可知,当对应电流密度为10 mA·cm-2时,二者的过电位分别为259.6和199.6 mV。图6b表明Cu/MoS2‑nanoflowers的Tafel斜率为 62 mV·dec-1,而Cu/MoS2‑nanosheets的 Tafel斜率仅为 59 mV·dec-1。以上结果说明Cu/MoS2‑nanosheets的电催化性能最佳。同时根据在碱性条件下的HER机理可以推断出二者的催化机理为Volmer‑Heyrovsky机理,而Heyrovsky步为基元反应的决速步。而对比图6c和7a可以发现,经过1 000圈循环之后,Cu/MoS2‑nanoflowers和Cu/MoS2‑nanosheets在电流密度为10 mA·cm-2时对应过电位分别为239.6和214.5 mV,相较于初始LSV曲线的过电位而言,变化不大,稳定性较好。图7b和7c说明了二者在不同扫速下通过的非法拉第电流不同。扫速越大,通过电极的非法拉第电流越大,曲线图更接近矩形,表现出Cdl的行为。由图 8a可以看出,Cu/MoS2‑nanoflowers的Cdl=15.6 mF·cm-2,而 Cu/MoS2‑nanosheets的Cdl=26.1 mF·cm-2。以上结果证明 Cu/MoS2‑nanosheets相较于Cu/MoS2‑nanoflowers表现出更大的有效电化学活性表面积,暗示其存在更多的催化活性位点,电催化性能也更优异。图8b为样品的Nyquist图及等效电路图,其中包括欧姆阻抗(Rs)、电荷传递阻抗(Rct)和Cdl。Cu/MoS2‑nanosheets拥有较小的Rct(12.4 Ω),这意味着纳米片状样品中电子可以更容易、更快地参与电荷转移过程,同时也可以进一步证明掺杂Cu可以促进电子转移动力学过程,这可能是因为Cu/MoS2‑nanosheets独特的晶体结构导致电子可以更好地与基底面接触。图8c为二者的ADT和CP图,可用于评估其耐久性和稳定性。分别在-20和-100 mA·cm-2恒定电流密度下每10 h进行一次稳定性测试,电位范围为0~-0.6 V,循环1 000圈。由图可知,在经历长时间的催化过程后2种材料仍能保持较好的催化活性。
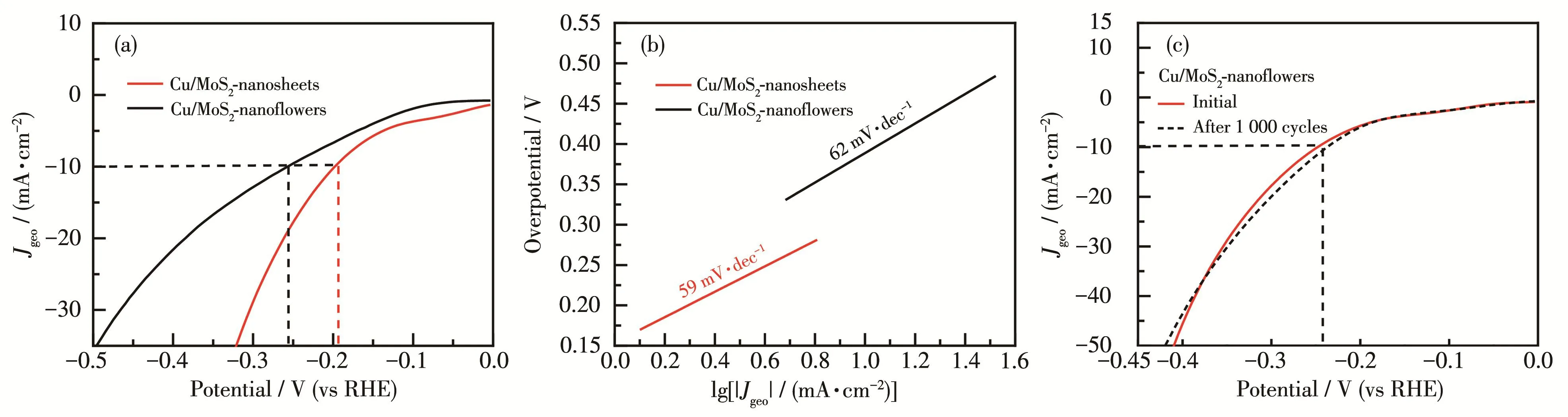
图6 Cu/MoS2‑nanoflowers和Cu/MoS2‑nanosheets的(a)LSV曲线和(b)Tafel斜率;(c)Cu/MoS2‑nanoflowers的初始和1 000圈循环后的LSV曲线Fig.6 (a)LSV curves and(b)Tafel slopes of Cu/MoS2‑nanoflowers and Cu/MoS2‑nanosheets;(c)LSV curves of Cu/MoS2‑nanoflowers for the initial and 1 000th cycles
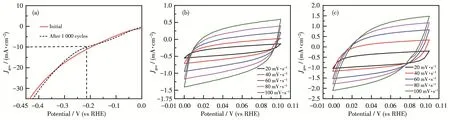
图7 (a)Cu/MoS2‑nanosheets初始和1 000圈循环后的LSV曲线;(b)Cu/MoS2‑nanoflowers和(c)Cu/MoS2‑nanosheets的非法拉第电容曲线Fig.7 (a)LSV curves of Cu/MoS2nanosheets for the initial and 1 000th cycles;Non‑Faraday capacitor curves of(b)Cu/MoS2‑nanoflowers and(c)Cu/MoS2‑nanoflowers
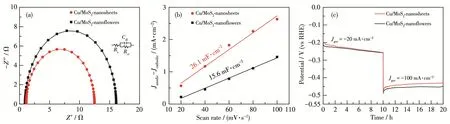
图8 Cu/MoS2‑nanosheets和Cu/MoS2‑nanoflowers(a)在不同电流密度与扫描速率下的双电层电容、(b)交流阻抗图和(c)在-20和-100 mA·cm-2下每10 h对应的恒电位曲线Fig.8 (a)Electrochemical impedance spectroscopy curves,(b)double‑layer capacitance at different current densities and scan rates,and(c)chronopotentiostatic curves at-20 and-100 mA·cm-2for every 10 h of Cu/MoS2‑nanosheets and Cu/MoS2‑nanoflowers
2.6 电化学性能
目前HER催化剂主要的类型可以分为非贵金属催化剂和以Pt为代表的贵金属催化剂。考虑到实际运用,有必要将贵金属催化剂和目前性能比较好的非贵金属催化剂的电化学性能进行比较,为工业和商业运用提供一定的参考价值。表1列举了一些催化剂在不同电解质溶液下的电化学性能参数。由表1可知,大部分非贵金属催化剂仍无法和Pt基催化剂的催化性能相比拟,但其价格低廉等优点仍值得进一步研究。
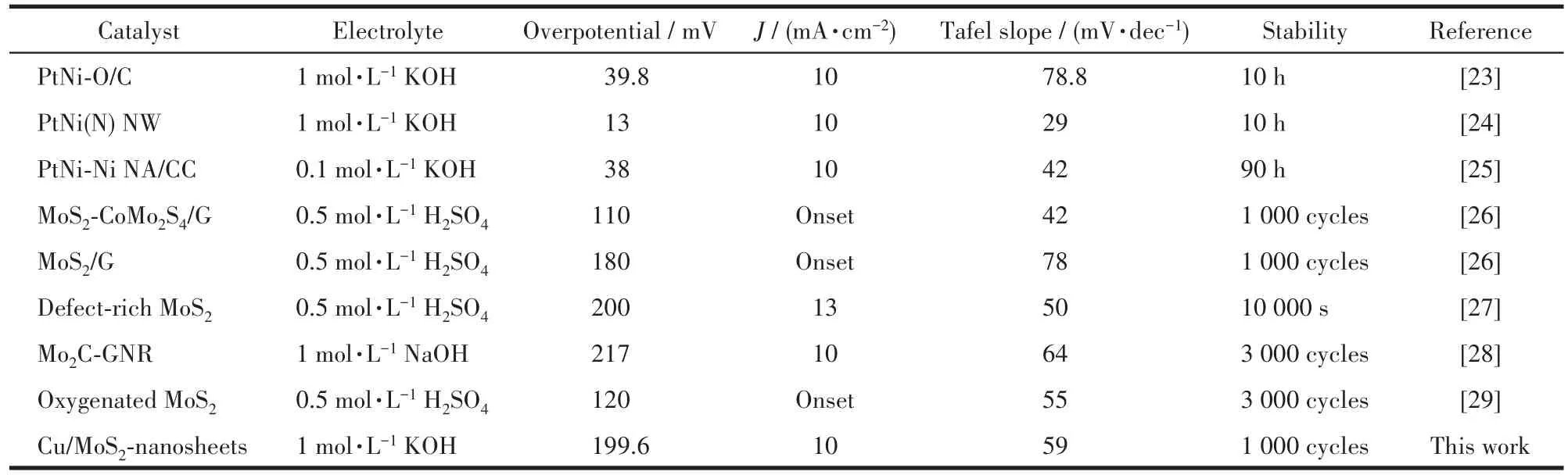
表1 部分贵金属和非贵金属催化剂的电化学性能参数Table 1 Electrochemical performance parameters of some noble metal and non⁃noble metal catalysts
3 结论
2H构型MoS2的析氢性能受限于活性位点的数目和导电性能的制约,通过掺杂Cu可以使MoS2晶格结构发生畸变从而影响电子结构特性,减少吸附氢的吉布斯自由能,从而提高HER催化活性;另一方面在碱性条件下,由Volmer‑Heyrovsky机理可知中间态吸附产物的产生速率与水解离有关,而水解离又受限于H在金属表面的吸附能。过渡金属有着更大的吸附能,因此掺杂Cu可以加快水的解离从而提高催化剂析氢活性。
综上所述,通过使用熔盐法制备MoS2并加入CuCl2成功制备出纳米花和纳米片状Cu/MoS2样品,纳米片状Cu/MoS2表现出更优越的电催化析氢性能,为非贵金属在电催化析氢方面的有关应用提供了参考。
——庆祝中国共产党成立一百周年贵金属纪念币展

