Ru@Pt/CNTs纳米粒子的制备及催化乙醇氧化电化学活性的研究
张玉杰,肖凤艳,赵 斌
(1.烟台职业学院机械工程系,烟台 264670; 2.中国兵器工业集团第五二研究所,烟台 264003)
0 引 言
燃料电池被认为是一种领先的、可持续的、环境友好的可替代化石燃料的绿色能源技术。其中,直接乙醇燃料电池(direct ethanol fuel cells, DEFCs),特别是在碱性条件下运行的DEFCs,具有无毒、来源丰富、结构简单、燃料便于携带与储存等优点,在可移动电源方面具有广阔的应用前景[1-8]。目前,商品化的直接乙醇燃料电池,普遍采用铂碳(Pt/C)纳米粒子作为阳极催化剂,而Pt/C在催化过程中易一氧化碳(CO)中毒,催化活性以及耐久性相对较差。因此,开发具有长期稳定性和高催化活性的阳极催化剂是目前DEFCs应用中亟待解决的问题。
乙醇在铂(Pt)的催化作用下发生电化学氧化反应,其过程复杂,涉及多种化学吸附态、碳碳键的断裂以及多种中间产物。要降低Pt催化剂中毒的关键在于减少或避免反应中间产物的形成和吸附,其中Pt合金化可以有效降低催化剂表面吸附CO的能力,避免催化剂中毒,进而改善催化剂性能。例如二元铂铑合金比纯铂作为乙醇氧化反应(EOR)的催化剂更高效[9-16]。与其他金属相比,金属钌可以有效降低燃料电池的成本,另一方面,钌(Ru)在d轨道未充满,可与Pt共享提高Pt的吸附氧化物的能力,有利于氧化反应,提高催化剂的催化活性。因此钌铂(Ru@Pt)二元催化剂被广泛认为是对甲醇氧化反应(MOR)和乙醇氧化反应(EOR)具有较高催化性能、最有发展前途的催化剂之一[17]。催化剂的形状、大小和组成是影响其电催化性能的重要因素,精细地控制Pt基催化剂的形态和组成,可以实现催化性能的增强及Pt利用率的提高[18]。到目前为止,各种形态如纳米颗粒、纳米枝晶、核壳结构等催化剂的合成使得催化性能得以提高,由于纳米枝晶独特的表面结构性质,其高度分枝的形态已经引起了相当的关注。然而,大多数的方法通常需要苛刻的条件,如种子、硬模板、复杂的程序以及表面活性剂,来控制最终产品的尺寸和形状,或者使用有机金属化合物的热分解(如乙酰丙酮和羰基)获得铂基催化剂,其中大多数是非常昂贵且有毒的。因此,开发一种简易的方法——避免使用有机金属化合物为前驱体,合成具有优越的纳米结构以及良好催化性能的铂基合金催化剂,具有重要意义[19]。
本研究通过构建以碳纳米管(CNTs)为载体的Ru@Pt纳米颗粒,作为阳极催化剂实现对乙醇氧化反应的催化。首先,通过催化剂的形态控制,实现了具有核壳结构(核是钌、壳是铂)的纳米合金在碳纳米管上的稳定分布。通过调控工艺条件,实现合金中组成调控。进而研究了不同结构组成的合金碳纳米管催化剂对乙醇氧化反应的催化效果。本实验致力于开发一种简单高效的碳载合金纳米颗粒制备方法,为直接乙醇燃料电池的长期稳定性和高催化活性的阳极催化剂设计和制备提供一种新的思路。
1 实 验
1.1 试剂及仪器
实验所用主要试剂和仪器如表1、表2所示。

表1 实验试剂Table 1 Experimental chemicals
表2 实验主要仪器Table 2 Experimental instruments
1.2 Ru@Pt/CNTs纳米催化剂的制备
通过乙醇还原法,首先合成负载在CNTs材料上的钌核,然后再将铂壳附着在钌/碳材料上,进而获得以钌为核,以铂为壳的碳载核-壳结构的纳米颗粒,记为Ru@Pt/CNTs。具体如下。
1.2.1 钌核的合成
将135 mg的CNTs加入乙醇中超声1 h;在烧瓶中加入100 mL含有0.4 mmol RuCl3乙醇溶液,然后加入分散好的CNTs,之后在110 ℃的条件下回流加热1 h;当反应稳定在110 ℃后,将3 mol 0.2 mol/L的NaOH注射到反应器中;反应2 h后,在反应器中额外注入0.5 mol的NaOH,以确保反应前驱体RuCl3完全被还原。之后,在回流的条件下,继续反应20~30 min,得到Ru/CNTs准成品;在450 ℃的条件下,将Ru/CNTs准成品置于Ar/H2混合气中灼烧退火1 h,完成Ru/CNTs纳米颗粒合成。
1.2.2 Ru@Pt/CNTs金属纳米颗粒的合成
将已合成的Ru/CNTs纳米颗粒分散到100 mL的无水乙醇中,在110 ℃的条件下加热回流1 h;在室温中,将8 mL含有0.3 mmol氯铂酸(H2PtCl6)的乙醇溶液转移到上述混合溶液中,加入的同时需要伴有强烈的搅拌;将该混合液在110 ℃的条件下回流反应2 h。可在反应溶液中加入少量0.2 mol/L的NaOH溶液(不超过3 mL),以确保Pt离子完全被还原;最后,将纳米颗粒离心分离,用乙醇清洗纳米颗粒2~3次,得到Ru@Pt0.75/CNTs纳米颗粒。该纳米颗粒Pt和Ru的原子比为0.75∶1,附着在碳基质上的铂的质量分数为25%。改变铂前驱物质和碳纳米管的使用量,但不改变铂在碳纳米管的负载量以及钌前驱物质的用量,合成Pt、Ru原子比分别为0.5∶1、0.75∶1、1∶1、1.25∶1的Ru@Pt0.5/CNTs、Ru@Pt0.75/CNTs、Ru@Pt1.0/CNTs、Ru@Pt1.25/CNTs纳米颗粒。
1.3 材料的表征及电化学性能测试
1.3.1 Ru@Pt1.25/CNTs的表征
采用日本电子光学公司生产的JEOL TEM-2010型透射电子显微镜对纳米颗粒进行形貌表征,并计算纳米颗粒的直径。将以碳基质为负载的纳米颗粒分散在乙醇中形成悬浮液,然后沉积在碳包铜网(230目,62 μm)上,制备了TEM样品;采用德国布鲁克公司GADDS X射线衍射仪进行XRD的测试,以铜靶作Kα源(λ=0.154 18 nm),操作电压为40 kV,电流为40 mA;采用日本产的Phi X-tool型X射线光电子能谱仪(X-ray photoelectron spectroscopy, XPS)来分析样品的元素信息。
1.3.2 电化学性能测试
采用三电极体系,在碱性条件下进行乙醇的电化学氧化实验。将所制备的碳载纳米颗粒配成1 mg/mL的乙醇溶液,并将其超声1 h以形成均匀分散的催化剂墨水。取10 μL该墨水均匀地滴在直径为5 mm的玻碳电极上,使该电极作为工作电极。当滴在玻碳上的墨水在空气中自然干燥后,在该电极上再均匀地滴5 μL质量分数为5%的全氟磺酸型聚合物(Nafion)溶液,使之将已干燥的催化剂墨水完全覆盖,然后在空气中自然干燥。对比实验所用的商业Pt/C工作电极也用上述相同方法制得。该实验采用汞/氧化汞电极(Hg/HgO)和铂丝电极分别作为参比电极和对电极,浓度为0.5 mol/L的氢氧化钾溶液作为电解液。采用CHI-650E型电化学工作站与三电极电解池连接对所制备的纳米材料进行电化学测量。首先在浓度为0.5 mol/L的氢氧化钾溶液中测定循环伏安曲线(CV)以达到对工作电极进行活化的目的;然后在浓度为0.5 mol/L的乙醇和0.5 mol/L的氢氧化钾的混合溶液中进行乙醇的电化学催化氧化实验,电压扫描范围设置为-0.8~0.4 V,扫描速率为50 mV/s,得到乙醇氧化反应(EOR)的CV图;最后,将该CV测量进行250个循环,取最后几个循环,从中得到峰值电流密度值,以该值为纵坐标,相应的循环数为横坐标得到电流的衰减曲线。以上所有电化学的测试都是在室温(25 ℃)的条件下进行的。
2 结果与讨论
2.1 Ru@Pt/CNTs金属纳米颗粒的表征分析
2.1.1 Ru@Pt/CNTs的TEM检测
如图1所示,Ru@Pt1.25纳米颗粒均匀地负载在碳纳米管的表面上。其平均直径和分布如图1(d)所示,Ru@Pt1.25纳米颗粒的平均直径约为(5.39±0.48) nm。Ru金属前驱体的用量不变时,随着铂金属前驱体数量的增加,纳米颗粒的尺寸会增大(其粒径分布如表3所示),说明Ru@Pt核壳纳米颗粒具有不同层数金属铂的覆盖层,根据施密德的壳模型,包括一至三层的原子层(其中核尺寸与壳尺寸基本符合原子比)。
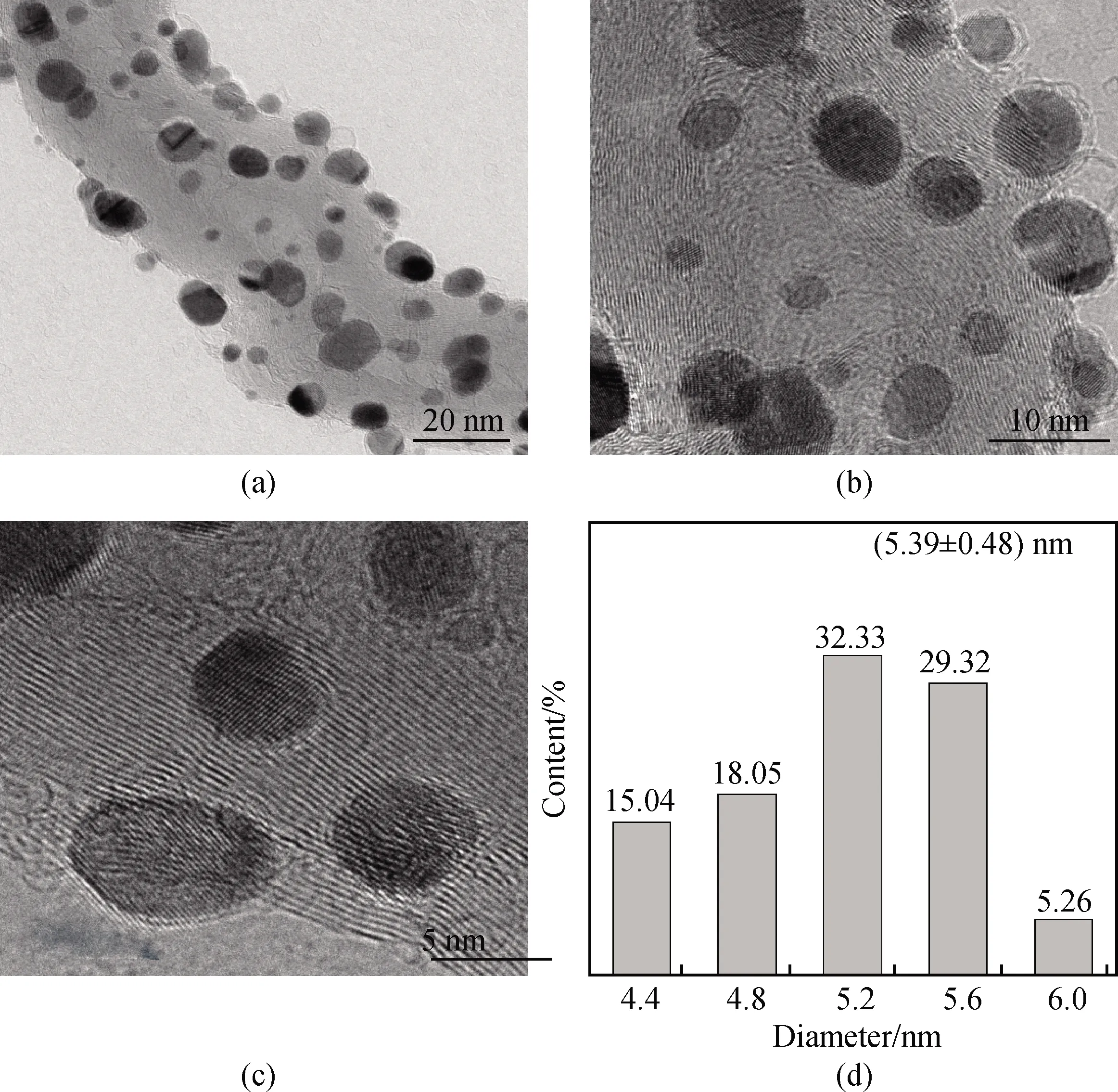
图1 (a), (b), (c)Ru@Pt1.25/CNTs的TEM照片及(d)Ru@Pt粒径尺寸分布Fig.1 (a), (b), (c) TEM images and (d) size distribution of the Ru@Pt1.25/CNTs

表3 钌@铂/碳纳米管核-壳纳米颗粒的尺寸分布Table 3 Size distribution of the Ru@Pt core-shell NPs
2.1.2 Ru@Pt/CNT的XRD分析
钌-铂核壳纳米颗粒制备过程中会在其颗粒界面形成部分合金,将对电化学催化活性产生负面影响[20]。在本实验中,利用低温反应制备结构良好的核壳结构(见图2)。通过XRD分析,制备的颗粒具有不同晶体相结构的钌(hcp)和铂(fcc)。从图2中可以看出,Pt(111)晶面特征峰的衍射强度随着Pt/Ru摩尔比的增加而逐渐增强,并且Ru(101)晶面的衍射峰明显。这是由于在所有的样品中,钌前驱物质的用量是一定的。这就可以证明,所合成的Ru@Pt核壳纳米颗粒具有明确定义的边界。此外,Pt(111)晶面衍射峰的位置发生了略微的偏移,并且钌(002)晶面的衍射峰随着Pt壳数量的增加而逐渐被掩盖。这是由于该纳米颗粒形成了有序的铂晶体[21]。
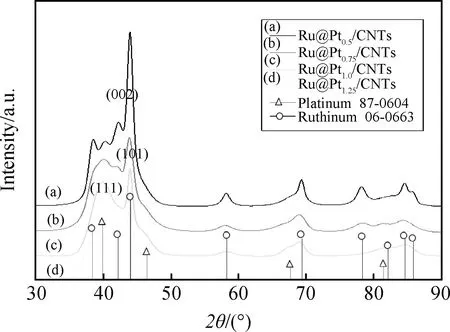
图2 Ru@Pt/CNTs的XRD图谱Fig.2 XRD patterns of Ru@Pt/CNTs
2.1.3 Ru@Pt/CNT的XPS分析
X射线光电子能谱(XPS)被用作探针来探测样品的元素组成(见图3)。图3(a)显示出Ru 3d和C 1s轨道的特征峰并且得到很好的拟合;在284.16 eV和280.17 eV两个位置处的双重峰归因于Ru(0) 3d轨道的特征。C 1s轨道的结合能在284.4 eV的峰值(C-C),285.2 eV的峰值(C-H)和288.9 eV的峰值(C=O)这三个位置处。图3(b)中,Pt 4f轨道有两个峰,分别在71.41 eV和74.76 eV这两个位置处,这就对应到Pt(0)的位置[22-23]。因此,XPS分析表明,Ru@Pt1.0/CNTs催化剂颗粒中包含有钌和铂这两种金属。此外,也对使用不同比例金属前驱体而合成的Ru@Pt/CNTs纳米颗粒进行了XPS的测量,其XPS图谱也显示出其具有明显的Ru(0)峰和Pt(0)峰。另外,从其XPS图谱中看出,Ru(0) 3d轨道的峰的强度随着Pt前驱体含量的增加而降低。
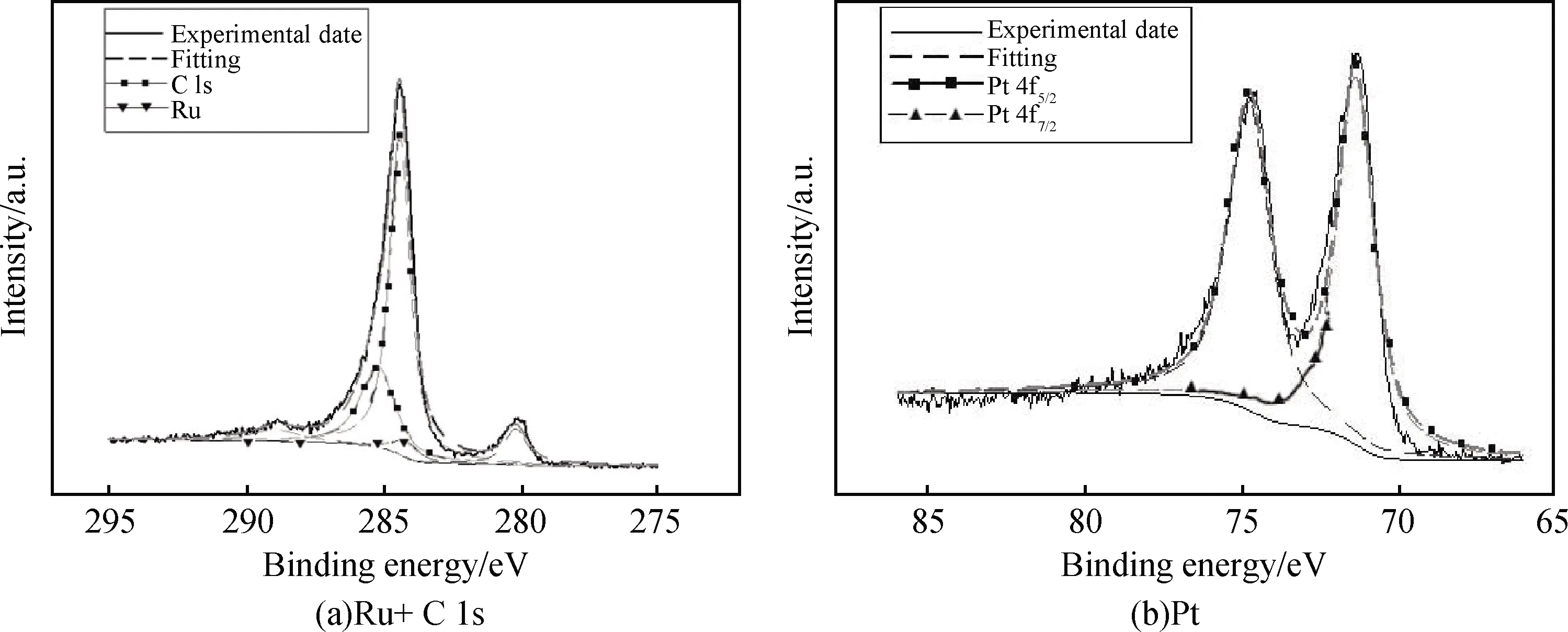
图3 Ru@Pt1.0/CNTs纳米颗粒的XPS图谱及其拟合峰Fig.3 XPS spectra of Ru@Pt1.0/CNTs and simulated peak
2.2 乙醇在Ru@Pt/CNTs上的电催化分析
2.2.1 循环伏安法(CV)测试
对所有的催化剂进行循环伏安法(CV)测试,如图4(a)所示,CV曲线显示出了典型的氧和氢的吸附/脱附区。在-600~-900 mV的电势范围内出现氢气的形成/剥离峰,在该电势范围内一系列的析氢峰代表了氢的电化学吸附和脱附发生在铂的不同晶面。
乙醇电氧化是在0.5 mol/L氢氧化钾和0.5 mol/L乙醇中进行,以50 mV/s的扫描速度对其进行循环伏安法的测试。一般而言,正扫时出现的峰(阳极峰)归因于乙醇被电氧化为乙醛、乙酸和极少量的CO2的过程,而反扫时出现的峰(阴极峰)被认为是在乙醇电氧化过程中形成的吸附物种的脱附过程,如图4(b)所示。从图中可以看出,Ru@Pt0.5/CNTs,Ru@Pt0.75/CNTs,Ru@Pt1.0/CNTs,Ru@Pt1.25/CNTs 催化剂显示出了较高的催化活性,并且将其催化乙醇氧化所获得的电流密度标准到单位质量Pt上,分别为1 172.28 mA/mg Pt、1 767.77 mA/mg Pt、1 580.24 mA/mg Pt、1 482.13 mA/mg Pt,这大约分别是商业Pt/C催化活性的2.16倍、3.25倍、2.91倍以及 2.73倍(543.89 mA /mg Pt),详细数据如表4所示。
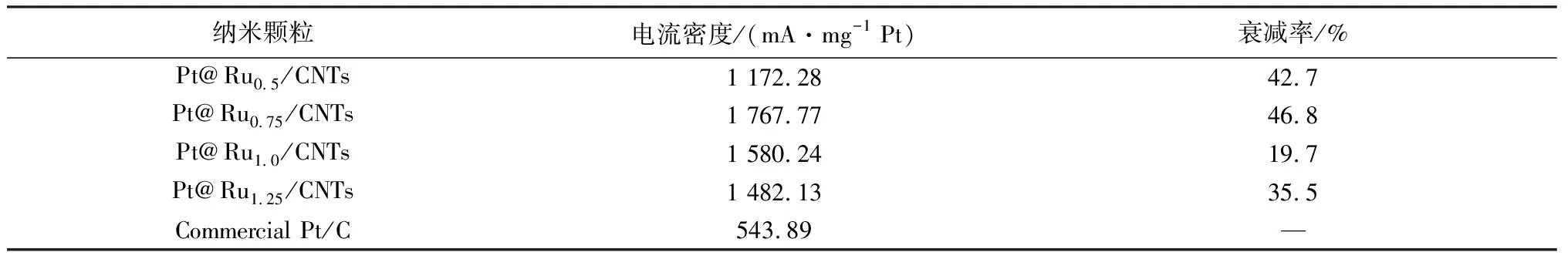
表4 Pt@Ru/CNTs 纳米颗粒催化乙醇电氧化的性能Table 4 Mass activity Pt@Ru/CNTs NPs for ethanol eletro-oxidation reaction
所制备的催化剂活性的性能依次为:Ru@Pt0.75/CNTs>Ru@Pt1.0/CNTs>Ru@Pt1.25/CNTs>Ru@Pt0.5/CNTs>商业Pt/C,可以看出Ru@Pt/CNTs催化剂的催化性能与铂∶钌摩尔比相关,而催化性能最好的铂∶钌摩尔比是0.75。如图4所示,铂∶钌摩尔比在一定的范围内,催化性能首先随着其比值的增大而增大;当铂∶钌摩尔比为0.75时,催化性能达到最优;当铂∶钌摩尔比继续增大时,催化性能反而随着其增大而降低。此外,在相同的电流密度下,Ru@Pt/CNTs催化剂催化氧化的起始电位低于商业Pt/C,如图4(c)所示。这表明Ru@Pt/CNTs对EOR(ethanol oxidation reaction)具有更高的电催化性能。然而,相比于商业Pt/C,Ru@Pt/CNTs催化反应时,阳极峰向正电位方向发生了略微的偏移,这是因为乙醇在催化剂上吸附的量越大,其在电位下发生氧化反应就需要更多的能量。

图4 所制备的Ru@Pt/CNTs纳米颗粒的电催化性能。(a)0.5 mol/L KOH溶液100 mV/s扫速下循环伏安曲线; (b)0.5 mol/L KOH+0.5 mol/L CH3CH2OH溶液50 mV/s扫速下乙醇氧化CV曲线;(c)正极扫描过程 -0.8~-0.2 V放大曲线;(d)-0.1 V下循环电流密度Fig.4 Electrocatalytic properties for as-synthesized Ru@Pt/CNTs NPs. (a) Cyclic voltammetry (CV) obtained in 0.5 mol/L KOH with a sweep rate of 100 mV/s; (b) CV for ethanol oxidation measured in 0.5 mol/L KOH+0.5 mol/L CH3CH2OH with a sweep rate of 50 mV/s; (c) enlarged image(-0.8 V to -0.2 V) during the positive scan; (d) change of current density in the peak at -0.1 V as function of the number of potential cycles
2.2.2 峰值电流密度值
为了探讨该系列催化剂的耐久性,研究了乙醇氧化反应的CV曲线中的峰值电流密度值(-0.15 V)随循环次数的变化。在CV测试开始到循环60圈时,催化剂逐渐被活化,其催化性能增加增强,使其电流密度值随着循环次数的增加而不断增加;当循环60圈后,催化剂的活性已达到稳定状态,其电流密度值不随着循环次数的增加而变化;从循环70圈开始,电流密度值开始随着循环次数的增加而降低,从这段曲线就可以判断催化剂的稳定性,如图4(d)所示。从图4(d)中可以看出,在循环70圈开始的时候,Ru@Pt0.75/CNTs具有最高的电流密度值。循环250圈后,Ru@Pt1.0/CNTs的电流密度值是0.77 A/mg Pt,大约降低了19.7%;Ru@Pt0.75/CNTs的电流密度值约为0.58 A/mg Pt,该值稍低于Ru@Pt1.25/CNTs的电流密度值(0.6 A/mg Pt),而它们相对于稳定时的初始值分别衰减了46.8%和35.5%;Ru@Pt0.5/CNTs催化剂的催化活性即峰值电流密度值从0.75 A/mg Pt下降到0.43 A/mg Pt,约衰减了42.7%,见表4。另外,从图5中也可以看出,在循环250圈后,Ru@Pt/CNTs催化剂催化乙醇氧化的电流密度值仍然比商业Pt/C高。

图5 质量电流密度与Pt/Ru摩尔比的关系Fig.5 Relationship between catalytic activity and Pt/Ru mole ratio
3 结 论
不使用PVP等稳定剂的条件下使用乙醇还原法合成了以碳纳米管为负载基质的不同数量Pt壳的Ru@Pt0.5/CNTs、Ru@Pt0.75/CNTs、Ru@Pt1.0/CNTs、Ru@Pt1.25/CNTs 四种核-壳结构的纳米颗粒。根据物相分析技术(XPS、TEM、XRD)所得到的数据,可以判断出该系列催化剂是典型的以钌金属为核,铂金属为壳的核-壳结构的纳米颗粒。根据电化学测量的数据看出,该系列核-壳结构的纳米颗粒催化乙醇氧化具有很高的电催化性能,电流密度值分别达到1 172.28 mA/mg Pt、1 767.77 mA/mg Pt、1 580.24 mA/mg Pt、1 482.13 mA/mg Pt,分别是商业Pt/C电流密度的2.16倍、3.25倍、2.91倍以及2.73倍。并且其催化稳定性较高,在CV测试循环了250圈后,电流密度值仍然很高,在相同的测试条件下,Ru@Pt1.0/CNTs仅仅衰减了19.7%。通过进一步优化合成条件有望实现铂壳厚度及催化活性、稳定性以及耐久性的调控方法。另外,可以寻求更加低廉经济并且环境友好的材料,使直接乙醇燃料电池可以得到实际的应用。

