门冬氨酸鸟氨酸对非酒精性脂肪性肝炎合并肌少症性肥胖小鼠的保护作用*
王子璇,王梦雨, 李经纬, 杨蕊旭, 曾静, 潘勤, 范建高
近年来,全球非肥胖和瘦人非酒精性脂肪性肝病(NAFLD)患病率增长迅速,这些患者非酒精性脂肪性肝炎(NASH)以及代谢和心血管疾病发病风险与肥胖的NAFLD患者相似[1,2],部分原因是体质量诊断肥胖的敏感性因存在肌少症而降低,合并肌少症的隐性肥胖群体不容忽视。以骨骼肌质量和功能减退为特征的肌少症在非肥胖NAFLD群体中常见且与NASH互为因果[3-5],提示防治NAFLD需兼顾干预肌少症和NASH。鉴于高氨血症可能是诱发和加剧NAFLD患者肌少症和肝损伤的重要因素[6-8],本研究采取高脂饮食饲养小鼠制备NASH合并肌少症性肥胖模型,探讨了降血氨药物门冬氨酸鸟氨酸颗粒对造模形成的影响。
1 材料与方法
1.1 一般资料 28只8周龄SPF级雄性C57BL/6小鼠,体质量20~22 g,购于杭州子源实验动物科技有限公司【SCXK(浙)2019-0004】,分笼饲养于上海睿太莫斯生物科技有限公司【SYXK (沪) 2016-0004】SPF级动物房,恒温(24℃±2℃)、恒湿(50%±5%),昼夜明暗交替(12 h/12 h)。
1.2 动物模型的制备 随机将动物分为普通饲料饲养的对照组(n=11)及普通饲料加10%猪油和2%胆固醇饲养的模型组(n=17)。在实验第12 w,随机处死对照组和模型组动物5只,其后将模型组小鼠随机分为干预组和模型对照组,分别给予门冬氨酸鸟氨酸颗粒(武汉启瑞药业有限公司惠赠)2 g.kg-1.d-1或等量生理盐水灌胃共8 w。在实验第20 w,隔夜禁食12 h,腹腔注射水合氯醛麻醉小鼠,常规收集血液及肝脏和股四头肌组织,将标本置于4%多聚甲醛溶液中固定12 h,石蜡包埋制片行HE染色。采用NAFLD活动度积分(NAFLD activity score,NAS)评估肝脏病理学变化。应用ImageJ 1.52a软件(美国国立卫生研究院)在200倍视野下测量30个以上肌细胞的肌纤维直径,取均值。
1.3 小鼠体成分和抓力测试 在处死动物前1天,在透明动物仓内插入Minispec LF50小动物MRI体成分分析仪(德国Bruker公司),检测小鼠全身脂肪和肌肉质量(瘦体质量)。根据脂肪质量与体质量的百分比计算体脂率。然后,使用BIO-GS3握力计(法国Bioseb公司)测量小鼠前肢抓力(g),测量3次,取均值。
1.4 工作定义 依据2018年欧洲肌少症共识[9]和有关文献[10],规定模型组小鼠体质量或体脂质量显著高于对照组为肥胖,瘦体质量和抓力显著低于对照组为肌少症,两者并存为肌少症性肥胖。规定肝组织5%以上肝细胞脂肪变伴小叶内炎症细胞浸润(≥1分)和肝细胞气球样变(≥1分)为NASH,干预组小鼠肝脏炎症评分0~1分和气球样变评分0分,无或仅轻度肝脂肪变为NASH缓解[11]。

2 结果
2.1 各组体质量、体脂质量、瘦体质量和抓力比较 在实验12 w,模型组动物抓力显著低于对照组(P<0.05);在第20 w,模型组体脂质量和体脂率显著高于对照组,而瘦体质量和抓力则显著低于对照组(P<0.05,表1)。
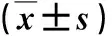
表1 各组小鼠体质量、体成分和抓力比较
2.2 各组肌纤维变化比较 在20 w,模型组肌纤维排列疏松,肌纤维间隙增加,肌纤维直径显著低于对照组(P<0.05,图1)。
图1 对照组和模型组小鼠肌肉病理学表现(HE,200×)A:对照组;B:模型组;C: 模型对照组
2.3 各组肝组织学变化比较 在第12 w,模型组5只小鼠都出现了5%以上大泡性肝脂肪变,伴小叶内不同程度的炎性细胞浸润和肝细胞气球样变(达到NASH诊断标准);在第20 w时,肝细胞脂肪变、小叶内炎症和气球样变程度加重,NAS积分进一步升高(图2,表2)。
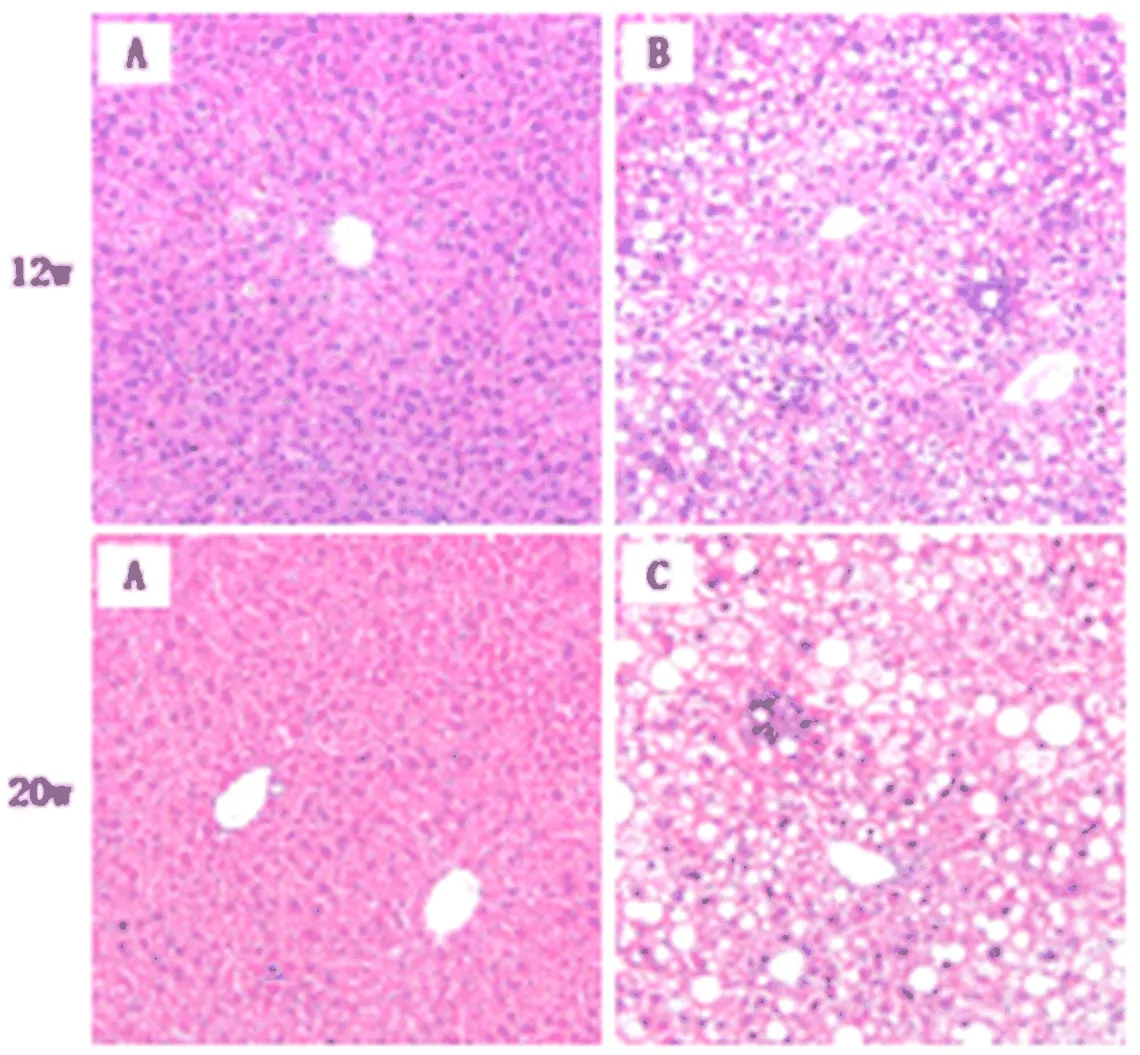
图2 对照组和模型组小鼠肝组织病理学表现(HE,100×)A:对照组;B:模型组;C: 模型对照组
表2 各组小鼠肝组织NAS积分比较
2.4 各组小鼠股四头肌和肝组织病理学表现比较 在第20 w,干预组小鼠肌细胞形态饱满,肌纤维直径显著增加,肝组织NAS积分显著下降,所有小鼠都达到了NASH缓解标准(图3、图4)。
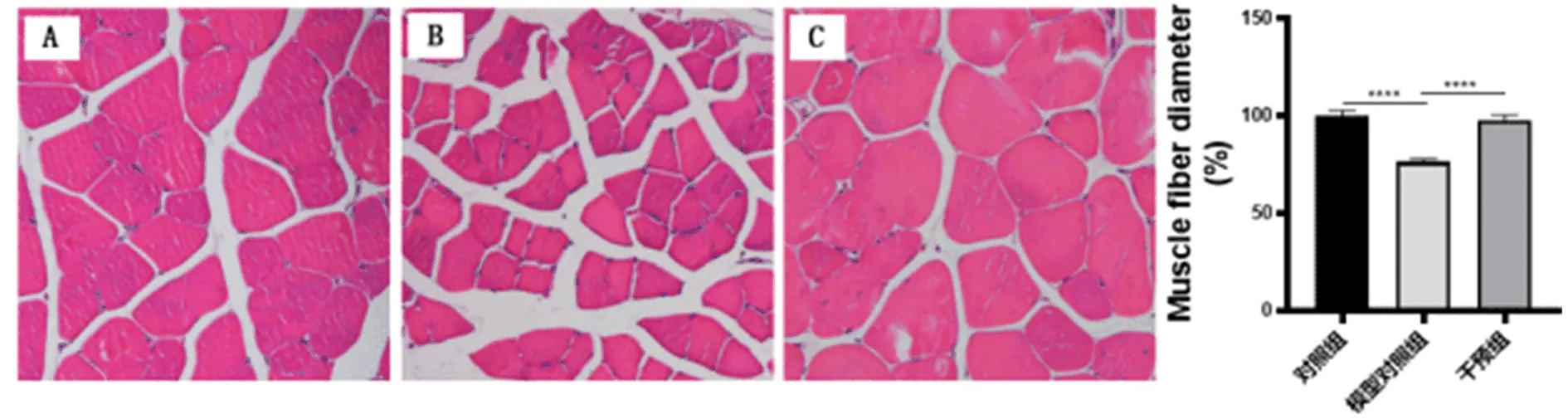
图3 各组小鼠股四头肌病理学表现(HE,200×)A:对照组;B: 模型对照组;C: 干预组
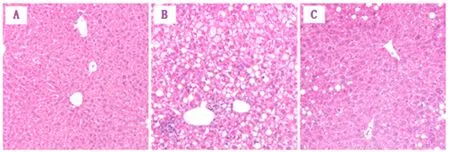
图4 各组小鼠肝组织病理学表现(HE,100×)A:对照组;B: 模型对照组;C: 干预组
3 讨论
肌少症和NAFLD及其严重类型NASH与肝纤维化关系密切[12],两者有许多共同的危险因素[13]。然而,至今大多数研究是横断面调查,难以阐明两者的因果关系。本研究动态观察了高脂饮食饲养8周龄雄性C57BL/6小鼠的体成分、肝脏和肌四头肌病理学改变,结果发现在实验12周时模型组小鼠肝组织病理学改变已满足NASH诊断标准,并且前肢抓力显著下降,但其体质量、体脂含量和瘦体质量与普通饲料喂养的对照组并无显著性差异;继续造模8周小鼠肝脂肪变、炎症、气球样变加重,伴体脂质量、体脂率增高,而瘦体质量和前肢抓力减少,提示20周的高脂饮食饲养野生型小鼠可建立NASH合并肌少症性肥胖模型。长期高脂肪高热量饮食及缺乏运动可能通过胰岛素抵抗、代谢性炎症、细胞因子失衡、维生素D缺乏、肠道菌群失衡等引起机体脂肪-肌肉-肝轴细胞和分子协调机制受损,从而导致NAFLD和肌少症性肥胖的发生和发展。
本研究高脂饮食模型小鼠体质量与对照组比并无显著性增加,这与非肥胖NAFLD和瘦人NAFLD表型相似。通常,非肥胖NAFLD患者体脂质量、体脂率和内脏脂肪含量显著增加[14],而其骨骼肌质量则比健康成人和肥胖的NAFLD患者减少[15]。为此,基于体质量的NAFLD分型标准需要被精准的人体成分分析和代谢心血管危险因素分层所取代[2]。本模型造模方法简便,成功率高达100%,似可用于非肥胖或瘦人NASH发病机制及新药研发的研究。
NASH与肌少症之间可能互相影响并形成恶性循环。高脂饮食及其相关肠菌紊乱和脂肪肝既可引起肠道产氨增多又影响肝脏尿素合成,导致肠源性高血氨,后者可能是NASH和肌少症的重要发生机制[8]。NAFLD患者肝脏尿素循环关键酶氨基甲酰磷酸合成酶1和鸟氨酸氨基甲酰转移酶活性降低,导致肝脏尿素循环紊乱和高血氨,进而引起肝脏和肌肉损伤[7]。12周的门冬氨酸鸟氨酸颗粒干预可使超声诊断的NASH患者肝酶水平降低和脂肪肝程度减轻[16]。然而,该研究未行肝活检评估NASH,亦未关注肌少症。本研究发现,在高脂饮食造模的同时,8周的门冬氨酸鸟氨酸干预可显著使模型小鼠NASH缓解,以小叶内炎症和气球样变改善最为明显。此外,门冬氨酸鸟氨酸干预小鼠体脂质量和体脂率降低,而瘦体质量、抓力和肌纤维直径增加。这些结果提示门冬氨酸鸟氨酸颗粒可以改善NASH小鼠肝损伤,并可预防肌少症性肥胖的发生。门冬氨酸鸟氨酸对肝脏和肌肉保护作用的机制可能与降血氨有关,因其促进尿素循环并通过谷氨酰胺合成酶增加谷氨酰胺合成而促进氨的解毒[17]。本研究的缺点是未检测实验小鼠肠道菌群、血氨等重要指标,未观察到肌少症性肥胖小鼠肌肉组织脂肪浸润现象,未探讨门冬氨酸鸟氨酸对NASH相关肝纤维化的影响,这些都有待进一步的实验和临床研究探讨。
总之,本研究成功制备了NASH合并肌少症性肥胖小鼠模型,可能是探讨肌少症与NASH内在联系及新药研发的理想工具。门冬氨酸鸟氨酸颗粒对高脂饮食小鼠脂肪性肝炎及肌少症的保护作用值得进一步的体内外试验以及设计严谨的临床试验来验证其疗效,并探讨其作用机制。

