HIF-1α对非酒精性脂肪性肝病小鼠肝组织的影响*
李 妍,陆伦根,蔡晓波
非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)是除外酒精和其它明确肝损因素所致的、以弥漫性肝细胞大泡性脂肪变为主要特征的一组临床病理综合症,包括单纯性脂肪肝、非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH)以及进展而来的肝纤维化、肝硬化和肝细胞癌(hepatocellular caicinoma,HCC)等一系列疾病谱[1-4]。肠道微生态失衡导致肠粘膜屏障功能减弱、通透性增加,肠源性细菌及细菌产物经门静脉入肝,激活肝脏炎症反应[5-8]。动物实验证实长期高脂饮食影响肝脏线粒体能量代谢,导致缺氧应激[9]。缺氧是脂肪组织功能障碍的关键影响因素,可能导致脂肪纤维化和炎症、IR、肝脏脂肪代谢异常等病理情况[10]。慢性阻塞性肺疾病(chronic obstructive pulmonary disease ,COPD)患者往往长期处于缺氧状态,因此COPD患者合并单纯性脂肪肝和非酒精性脂肪性肝炎(NASH)的发病率分别高达41.4%和36.9%,显著高于未罹患COPD者[11]。此外,有研究显示阻塞性睡眠呼吸暂停低通气综合征引起的间歇性缺氧可导致氧化应激、线粒体功能障碍、炎症和交感神经系统过度激活,是NAFLD发病和进展[12-14]的风险因素之一。上述发现提示我们,缺氧状态是NAFLD发病的风险因素之一。缺氧诱导因子1 (hypoxia-inducible factor 1,HIF-1)属于碱性螺旋-环-螺旋转录因子中的PER-ARNT-SIM(PAS)亚家族,是细胞和组织对缺氧应激反应的主要调节因子[15]。HIF-1的靶基因包括血管内皮生长因子(vascular endothelial growth factor,VEGF)和促红细胞生成素等。HIF-1通过与靶基因启动子内的缺氧应答元件结合调节转录,增加组织供氧、减少氧耗,以便机体和组织适应缺氧状态[16]。HIF-1是由缺氧诱导因子1α(hypoxia-inducible factor 1α,HIF-1α)和缺氧诱导因子1β(hypoxia-inducible factor 1β,HIF-1β)两个亚基组成的异源二聚体,其中HIF-1α亚基的稳定性受到细胞内氧浓度的调节,HIF-1β则不受氧浓度调节能够恒定表达。在常氧条件下,HIF-1α在脯氨酰羟化酶作用下特定脯氨酸残基位点发生羟基化反应。羟基化的HIF-1α能够被von hippel-lindau(VHL)肿瘤抑制基因识别,作为泛素连接酶E3复合体的底物发生多聚泛素化,进而被蛋白酶复合体降解。在缺氧条件下,脯氨酰羟化酶活性受到抑制,HIF-1α转位至细胞核内,与HIF-1β亚基聚合生成具有转录因子活性的HIF-1[17]。因此,HIF-1α是一种缺氧诱导的转录因子,是细胞和组织缺氧的标志。动物实验证实,短期高脂饮食后,早在炎症反应和IR尚未发生之前,即可出现白色脂肪缺氧和HIF-1α表达上调[18]。研究显示儿童NAFLD患者往往伴有组织缺氧和HIF-1α表达上调[19],提示缺氧是早期炎症反应和脂肪组织功能紊乱的重要特征,HIF-1α在这一过程中可能有重要的调节作用。本研究通过饲喂高脂饮食和蛋氨酸-胆碱缺乏饮食(methione-choline deficient,MCD)饮食构建两种不同的NAFLD小鼠模型,分别检测其肝组织缺氧程度、HIF-1α mRNA和蛋白表达水平,并采用HIF-1α ShRNA腺病毒载体感染小鼠肝星状细胞JS-1细胞,检测其细胞活性并提取细胞总RNA,行逆转录后采用Real-time PCR法检测细胞1型胶原(COL1)和3型胶原(COL3)、TNF-α、IL-1β和TGF-β1等基因mRNA水平,以进一步探讨HIF-1α对NAFLD发病的影响。
1 材料与方法
1.1 动物、细胞和试剂 雄性C57BL/6J小鼠购自北京维通利华实验动物技术有限公司。JS-1细胞株购自雅吉生物有限公司。HIF-1α ShRNA腺病毒载体购自吉凯基因。基础饲料和MCD饲料均购自美迪森生物有限公司。胎牛血清和DMEM培养基购自Gibco。麻醉药物、甲醛固定液、HE染色液、TRIzol RNA抽提试剂、MTT试剂盒等购自碧云天生物技术有限公司,逆转录试剂盒、Real-time SYBR Green试剂购自大连Takara公司,所有引物均由上海生工生物工程股份有限公司合成。缺氧探针检测试剂盒购自北京博蕾德科技发展有限公司。
1.2 NAFLD模型的制备 给予30只小鼠饲喂基础饲料1 w后,随机分为3组,每组10只,其中正常饮食对照组10只,饲喂基础饲料;高脂饮食模型组10只,饲喂高脂饲料,自由摄食饮水,高脂饲料配比如下:基础饲料88%、猪油10%、胆固醇2%;MCD模型组10只,饲喂MCD饲料,自由摄食饮水。在实验第12 w末,将小鼠禁食12 h后测量体质量,给予氯胺酮0.2 g.kg-1腹腔注射麻醉,分离肝脏组织,切取0.5 cm× 0.5 cm× 0.5 cm大小肝组织经甲醛固定液固定,行石蜡包埋切片,将剩余的肝脏组织储存于液氮中,用于RNA和蛋白抽提。根据NAFLD活动度积分(NAFLD activity score,NAS)标准计算肝组织NAS积分[20],评估各组脂肪肝程度。NAS积分评分标准为0~8分:①肝细胞脂肪变:0分(<5%),1分(5%~33%),2分(34%~66%),3分(>66%);②小叶内炎症(20倍镜计数坏死灶):0分为无坏死灶,1分(<2个),2分(2~4个),3分(>4个);③肝细胞气球样变:0分为无,1分,少见,2分,多见。其中,对NAS<3分者,排除NASH诊断,NAS=3分或4分者为临界NASH,NAS≥5分者为确诊NASH。
1.3 肝组织缺氧程度的评估 在处死动物前6 h,经尾静脉注射派诺硝唑探针溶液60 mg.kg-1,分离部分肝脏组织,经甲醛固定,行石蜡包埋切片,用于后续染色以评估缺氧程度。
1.4 HIF-1α低表达JS-1细胞株的构建 将细胞冻存管在37 ℃水浴中快速摇晃融化,加入5 ml含10%胎牛血清的DMEM培养基混匀,1000 r/m离心4 min,弃上清,加上述培养基2 ml,吹匀后将细胞悬液加入培养瓶中,补加适量培养基,置于培养箱(温度37 ℃,湿度95%,CO25%)。待细胞融合度达90%时传代,待细胞生长状态良好时用于实验。细胞实验分为3组,即对照组、腺病毒载体组和HIF-1α ShRNA腺病毒载体感染组。传代接种密度为8×104个细胞/孔(6孔板)或2500个细胞/孔(96孔板),接种后22~24 h换液,在实验组分别同时加入腺病毒载体或HIF-1α ShRNA腺病毒载体:1×108/孔(6孔板)或3×106/孔(96孔板)。轻柔摇晃培养板。继续培养24 h换液。接种于6孔板的细胞于传代后48 h收集细胞,提取细胞总RNA和蛋白,分别采用Real-time PCR和Western blotting法检测证实HIF-1α ShRNA腺病毒载体感染组细胞HIF-1α mRNA和蛋白表达水平较对照组和腺病毒载体组明显下降(P<0.05,图1)。经Real-time PCR检测各组细胞COL1、COL3、TNF-α、IL-1β和TGF-β1 mRNA水平。接种于96孔板的细胞于传代后48 h更换含0.5%胎牛血清的DMEM培养基,继续培养24 h,采用MTT试剂盒检测各组细胞活性。
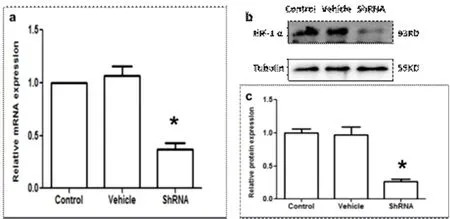
图1 HIF-1α低表达JS-1细胞株的构建 a: HIF-1α ShRNA腺病毒载体感染组JS-1细胞HIF-1α mRNA水平较对照组和腺病毒载体组显著下降(P<0.05);b和c:HIF-1α ShRNA腺病毒载体感染组JS-1细胞HIF-1α 蛋白表达水平较对照组和腺病毒载体组显著下降

2 结果
2.1 小鼠脂肪肝模型建立成功 在光镜下,正常组小鼠肝组织结构完整,肝细胞形态规则;高脂饮食模型组和MCD模型组小鼠肝组织可见明显的肝细胞脂肪变和肝细胞气球样变,间质可见炎性细胞浸润(图2)。在第12 w末,高脂饮食模型组NAS积分为6.170±0.302,显著高于对照组(0.020±0.042,P<0.05),MCD模型组NAS积分为5.940±0.241,也显著高于对照组(P<0.05),证实高脂饮食和MCD模型组小鼠肝组织符合NASH诊断。

图2 小鼠肝组织病理学表现 (HE,200×) 高脂饮食模型组:小鼠肝组织可见大面积肝脂肪变性和肝细胞气球样变,间质可见炎性细胞浸润,可见少量点状坏死灶和Mallory小体;MCD模型组:小鼠肝组织可见中到重度肝脂肪变性,可见肝细胞气球样变,间质可见炎性细胞浸润,坏死灶和Mallory小体罕见
2.2 小鼠肝组织缺氧情况 见图3。

图3 小鼠肝组织缺氧探针染色表现(派诺硝唑探针,200×) 缺氧探针试剂盒染色显示高脂饮食模型组和MCD模型组小鼠肝组织染色阳性率分别为85%和78%,显著高于对照组的7%(P<0.05)
2.3 三组肝组织HIF-1αmRNA及其蛋白表达比较 见图4。
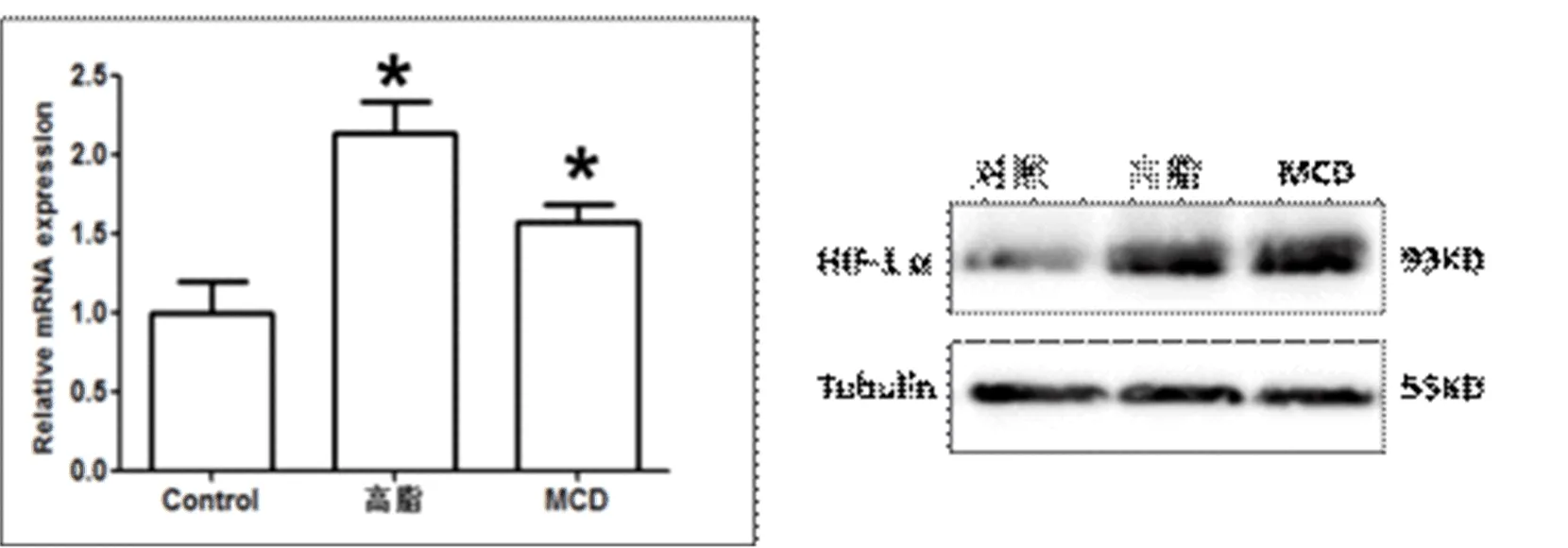
图4 三组肝组织HIF-1αmRNA及其蛋白表达比较 左图:高脂饮食模型组和MCD模型组小鼠肝脏HIF-1α mRNA水平分别为对照组小鼠的2.1倍和1.6倍(P<0.05);右图:高脂饮食组和MCD组小鼠肝脏HIF-1α蛋白表达水平明显增强
2.4 HIF-1α ShRNA抑制小鼠肝星状细胞HIF-1α表达后细胞活力情况 见图5。
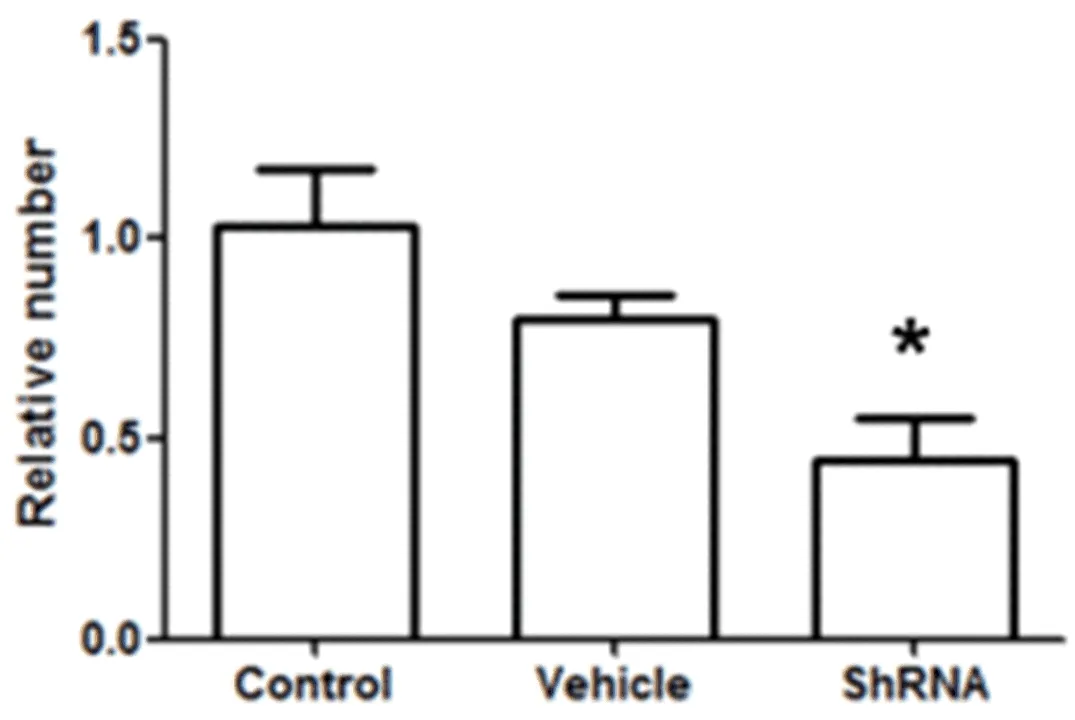
图5 三组活力变化 HIF-1α ShRNA腺病毒载体感染组细胞活力较对照组或空载体组明显下降,仅为对照组的37%(P<0.05)
2.5 三组细胞相关细胞因子mRNA水平比较 见图6。
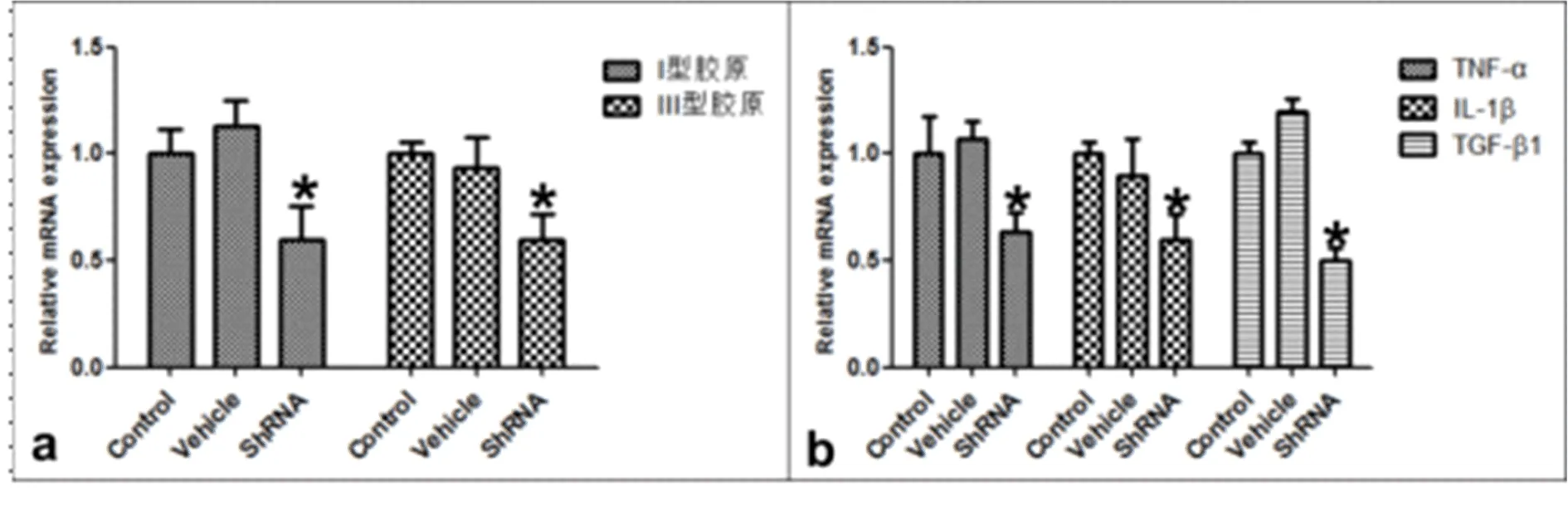
图6 三组细胞相关因子mRNA水平变化 a: HIF-1α ShRNA腺病毒载体感染组细胞COL1和COL3 mRNA水平较对照组或腺病毒载体组明显下降(P<0.05);b:HIF-1α ShRNA腺病毒载体感染组细胞TNF-α、IL-1β、TGF-β1 mRNA较对照组或腺病毒载体组均明显下降(P<0.05)
3 讨论
NAFLD的发病机制极其复杂。缺氧是脂肪组织功能障碍的关键影响因素。大量研究证实缺氧状态是早期炎症反应和脂肪组织功能紊乱的重要特征,也是NAFLD发病的风险因素之一。HIF-1α受缺氧的诱导,是细胞和组织缺氧的标志。本研究分别通过饲喂高脂饮食和MCD饮食构建两种不同的NAFLD小鼠模型,检测肝组织缺氧程度、HIF-1α mRNA和蛋白表达水平或采用HIF-1α ShRNA腺病毒载体感染小鼠肝星状细胞JS-1细胞,检测细胞活性并检测COL1、COL3、TNF-α、IL-1β、TGF-β1等基因mRNA水平,以进一步探讨HIF-1α对NAFLD发病的影响。结果显示,高脂饮食模型组和MCD模型组小鼠肝组织明显缺氧,且HIF-1α mRNA和蛋白表达水平均明显增强,提示缺氧在NAFLD发生和进展过程中有重要作用,HIF-1α可能参与调节这一过程。我们进一步采用HIF-1α ShRNA腺病毒载体感染JS-1细胞株,发现其细胞活力明显下降,COL1、COL3、TNF-α、IL-1β、TGF-β1 等相关基因mRNA水平也明显下降,提示抑制HIF-1α表达能够抑制肝星状细胞活化、胶原合成和炎性细胞介质的分泌,意味着抑制HIF-1α表达可能延缓NAFLD进展,为NAFLD治疗提供新的靶点和研究方向。

