着手课堂实验改良,提升学科核心素养
——以“二氧化硫的制取和性质一体化实验设计”为例
◎ 徐 雅
《普通高中化学课程标准(实验)》实施建议中指出:“要鼓励教师和实验管理人员开发实验仪器,研究低成本、少污染的化学实验。”[1]要提升高中学生的化学学科核心素养,必须对“创新意识”和“绿色应用”提出要求。由此,苏教版高中化学1“二氧化硫的性质实验探究”[2]还可以进一步改进。现用教材实验方案存在以下问题。
1.用料多。需要课前制备80mL 二氧化硫收集并保存于针筒中,且为了防止实验失败,教师往往会准备多管针筒的二氧化硫,制取过程需要消耗大量的实验原料。用针筒储存二氧化硫气体容易发生泄露,且二氧化硫气体易溶于水而被氧化,这些常见失误都会导致课堂演示实验或分组难以观察到实验现象。
2.有污染。二氧化硫水溶液的漂白实验和还原性在试管中进行。由于试管的不密闭环境,二氧化硫气体容易在实验操作时有水溶液逸出,如果进行分组多次实验,会积少成多,危及师生的健康。
3.操作烦琐。教材中二氧化硫水溶液的性质分三组实验进行探究,操作较多,耗时较长。实验只探究了二氧化硫水溶液的酸性、漂白性和还原性,却避开了二氧化硫氧化性的探究,学生对二氧化硫性质的认知不够系统化。
针对以上问题,近几年较有代表性的“二氧化硫的性质实验探究”改进设计思路为:用现制现用代替课前准备,节约药品;让实验在封闭或半封闭的装置中进行,吸收尾气,减少污染;将制备、性质检验和尾气吸收一体化,实验一旦触发,马上有现象,简化操作。然而,这些实验改进设计有些装置仍然是半敞开的,有些是装置的改进太复杂,甚至有些是需对玻璃进行加工,不具有普适性。同时,这些改进方案都采用了高锰酸钾这种强氧化剂验证二氧化硫的还原性,学生对于二氧化硫还原性强弱没有具体的感知。
一、实验目的
基于文献的梳理,笔者发现这些实验改进设计对高中化学实验教学而言仍存在一些不足。有鉴于此,将气体制取、性质检验、尾气吸收整合在同一装置中可提高实验效率,避免药品浪费和气体污染,经使用效果较好。
二、实验仪器及试剂
实验器具:分液漏斗、具支试管、气球、剪成条状的滤纸若干。
实验试剂:亚硫酸钠固体、98%浓硫酸、20%氢氧化钠、1%品红溶液、10%硫化钠溶液、1%氯化铁溶液、水、蓝色石蕊试纸、淀粉碘化钾试纸。
三、实验仪器装置图及仪器的组装说明
设计实验装置。在铁架台上固定好具支试管,具支试管底部装有半勺亚硫酸钠固体,试管壁上纵向贴上润湿的蓝色石蕊试纸、品红溶液浸泡过的滤纸条、硫化钠溶液浸泡过的滤纸条和铁离子氧化过的淀粉碘化钾试纸,试管支管口用橡皮筋绑上一个气球,用微热法检查装置气密性。
四、实验操作
[操作1]组装好仪器后,在分液漏斗中注入浓硫酸2mL,打开分液漏斗活塞,放出液体后迅速关闭活塞。
[现象]试管底部有大量气泡生成,约二十秒后,润湿的蓝色石蕊试纸变红,品红溶液浸泡过的滤纸条颜色褪去,硫化钠溶液浸泡过的滤纸条由无色变为黄色,铁离子氧化过的淀粉碘化钾试纸由蓝紫色变为无色,同时气球轻微膨胀。
[操作2]反应停止后,往分液漏斗中加入5mL20%氢氧化钠溶液,再次打开分液漏斗活塞,将溶液注入后迅速关闭活塞,充分振荡后静置。
[现象]试管底部微沸,气球膨胀,这是氢氧化钠和余酸中和放热。
[操作3]充分冷却后,往分液漏斗中加入5mL20%氢氧化钠,再次打开分液漏斗活塞,将水注入后迅速关闭活塞,充分振荡后静置,吸收剩余的二氧化硫气体。
[操作4]待气体吸收充分后,取出漂白后的品红试纸放入试管,微热。
[现象]试纸重新变红。
五、实验结论
1.湿润的蓝色石蕊试纸变红,说明二氧化硫的水溶液有酸性。
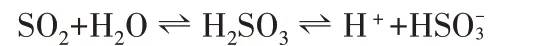
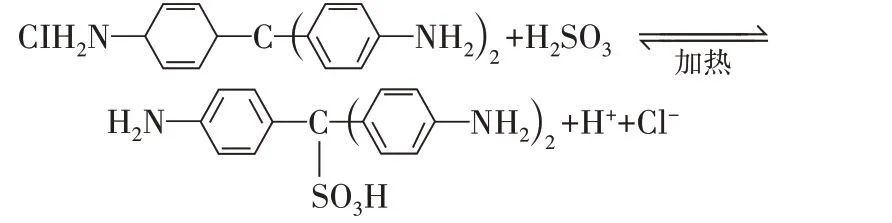
2.品红溶液浸泡过的滤纸条颜色褪去,证明二氧化硫水溶液具有漂白性。其加热后又恢复到原来颜色,证明二氧化硫水溶液漂白的不稳定性和可逆性。原理如下:
3.硫化钠溶液浸泡过的滤纸条由无色变为黄色,证明二氧化硫具有氧化性。
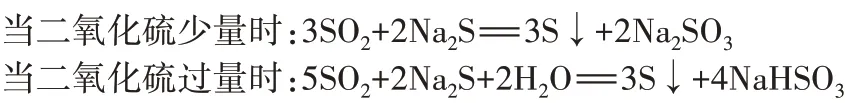
4.铁离子氧化过的淀粉碘化钾试纸由蓝紫色变为无色,是由于二氧化硫将碘单质还原,比高锰酸钾的氧化还原实验更能证明二氧化硫的强还原性。反应式:SO2+I2+2H2O=H2SO4+2HI
六、改进的意义
本实验现象直观,操作简单,同时这种一体化的组装设计能防止气体泄露,大大减少环境污染,节约药品的用量,让学生在学习二氧化硫的制取和性质的同时体会实验设计的方法和思路,体悟绿色化学的精神。
学生在改良的过程中,通过上面几种资料方案的对比与探讨的过程,潜移默化地提升了实验探究意识,在学习与批判中不断提升化学思维能力,在动手设计和着手实验时掌握关键知识,达到培育学科核心素养的目的。

