合并CKD对脑出血患者血肿变化及预后的影响
吴桐,刘利君,王训
(安徽医科大学第二附属医院,安徽 合肥 230601)
0 引言
脑出血(Intracerebral hemorrhage,ICH)是一种严重的神经系统疾病,发病率排在脑卒中各亚型中的第二位,占所有住院卒中患者的10%~30%,并且有着极高的致死率及致残率[1]。近年来,越来越多的证据表明慢性肾脏病(chronic kidney disease,CKD)与心脑血管疾病密切相关[2-4]。CKD患者往往存在血管硬化、血管脆性增加、血小板功能下降及凝血因子缺乏,这可能导致脑出血后更大的血肿体积及血肿扩大风险,而初始血肿体积、血肿体积的增长以及脑室出血的发展被证明是脑出血患者预后不良的独立预测因子[5],CKD可能与脑出血患者预后密切相关。但目前关于CKD与脑卒中关系的研究多集中于急性缺血性卒中,CKD与脑出血血肿体积及临床预后之间的关系尚不明确。本研究通过观察合并CKD的脑出血患者的临床特征及脑出血患者CKD分期与血肿体积的相关性,探讨CKD对脑出血患者病情的影响,旨在为临床上相关患者的诊治提供理论指导。
1 资料与方法
1.1 研究对象
回顾性分析2018年1月至2020年6月入住安徽医科大学第二附属医院神经内科脑出血患者的病历资料共203例,纳入患者均需符合2014年中国脑出血诊治指南中脑出血诊断标准[6]。纳入标准:①年龄>18岁;②入院时发病时间小于24h,且于24h内完善头部CT及采集血常规样本;③均接受常规脱水降颅压、调整血压、脑细胞保护等治疗。排除标准:①继发性脑出血,包括颅内肿瘤、外伤、动脉瘤、脑血管畸形等引起的颅内出血以及脑梗死出血转化等;②原发性蛛网膜下腔出血和脑室出血;③入院时存在急慢性感染、肿瘤等及凝血功能障碍者。
1.2 一般资料收集
收集患者人口统计学和临床资料,入院时登记患者年龄、性别,采集吸烟、高血压、糖尿病、卒中等病史资料,记录收缩压及随机血糖数值,进行美国国立卫生研究院卒中量表(NIHSS)和格拉斯哥昏迷量表(GCS)评分,收集患者的30天死亡情况。
1.3 头颅CT检查及评估
所有患者在入院时立即行头颅CT检查,入院48h内复查头颅CT,对脑出血部位进行影像学评估并计算脑血肿体积。血肿体积的计算采用多田公式[7],由两名专业神经科医师根据头颅CT结果共同完成。血肿扩大定义为:与初始血肿体积相比,复查血肿体积增长超过33%或增加12.5mL[8]。
1.4 实验室检查
入院24h内采集肌酐(SCr)、尿素氮(BUN)、血白蛋白、凝血酶原时间、活化部分凝血酶时间、凝血酶时间、中性粒细胞计数、血小板计数等实验室数据。
1.5 慢性肾脏病诊断标准
CKD诊断标准依据2012年改善全球肾脏病预后组织(KDIGO)慢性肾病临床指南[9],采用肾脏疾病饮食调整研究(MDRD)法[10]计算估测肾小球滤过率(eGFR),GFR=170×SCr0.999×年龄 -0.176×BUN-0.170×清蛋白0.318×(0.762女性)。eGFR<60mL/min/1.73m2为CKD组,eGFR≥60mL/min/1.73 m2为非CKD组;CKD病情程度分类标准[9]:eGFR30~60 mL/min/1.73 m2为中度(G3),eGFR15~30mL/min/ 1.73 m2为重度(G4),eGFR<15 mL/min/1.73 m2为肾衰竭(G5)。
1.6 脑出血预后评价
在患者发病90天后进行改良Rankin量表(mRS)评分,出院患者电话随访,mRS评分≤2分为预后良好,mRS>2分为预后不良。
1.7 统计学方法
运用SPSS 17.0对数据进行统计学分析,正态分布计量资料采用±s表示,两组比较采用t检验;非正态分布计量资料采用中位数及四分位间距[M(IQR)]表示,两组比较采用秩和检验。计数资料以例数(%)表示,组间比较采用卡方检验。多组数据间的差异性分析采用单因素方差分析(ANOVA),相关性分析采用Pearson相关分析。影响因素的分析采用多因素logistic回归分析。
2 结果
2.1 CKD组与非CKD组患者一般资料与临床特征的比较
CKD组与非CKD组在年龄、性别组成、高血压史、糖尿病史、吸烟史、卒中史、血脂异常率、血小板计数、凝血酶原时间、活化部分凝血酶时间及出血部位等方面差异均无统计学意义(均P>0.05)。CKD组与非CKD组在入院时收缩压、入院时随机血糖、中性粒细胞计数、纤维蛋白原含量、破入脑室比例、初始血肿体积、血肿扩大比例、NIHSS评分及GCS评分方面存在组间差异,差异有统计学意义(均P<0.05)。其中CKD组入院时收缩压、入院时随机血糖、中性粒细胞计数、纤维蛋白原含量、初始血肿体积、破入脑室比例及NIHSS评分大于非CKD组,GCS评分比非CKD组低。见表1。
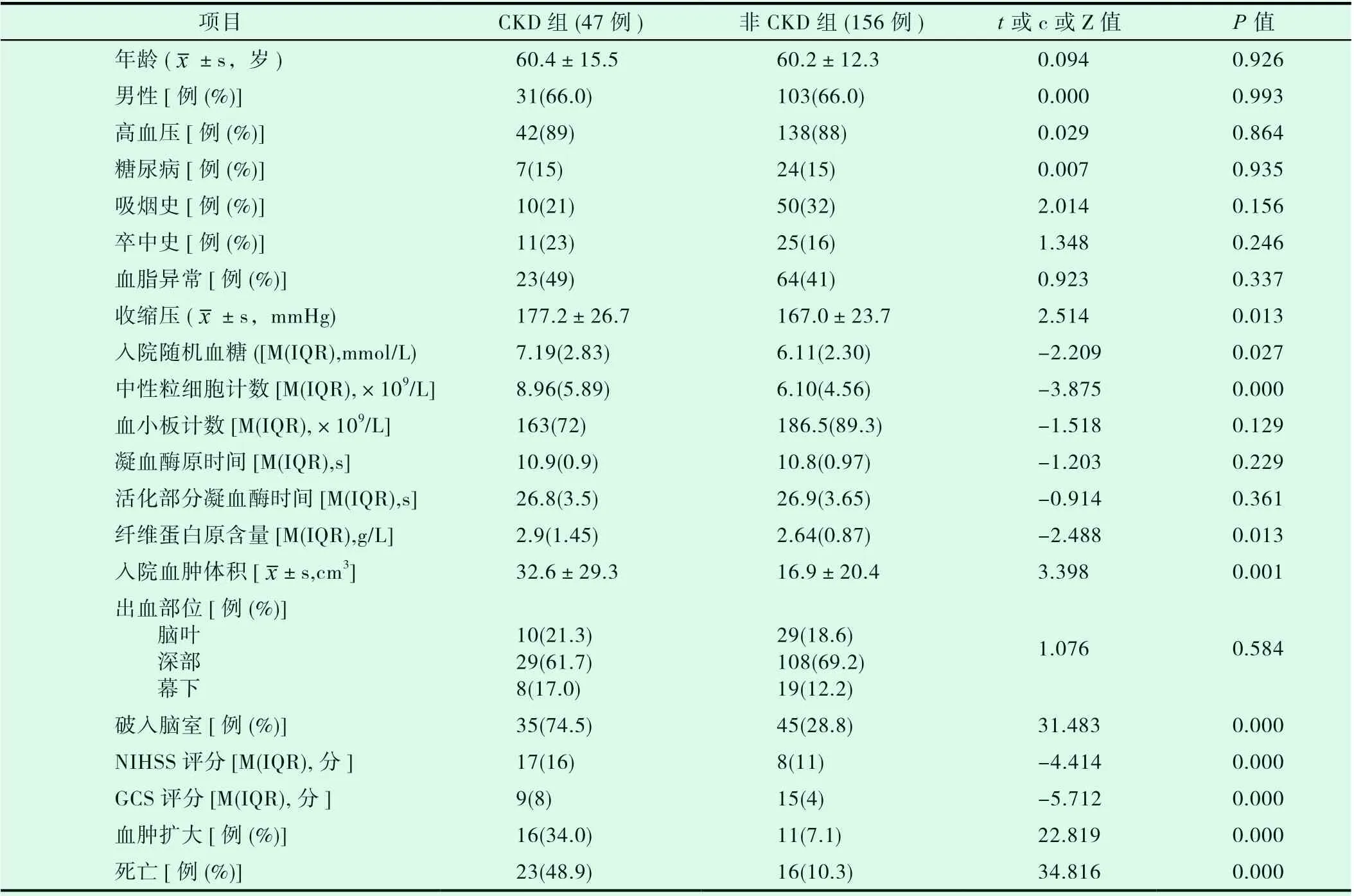
表1 CKD组与非CKD组患者一般资料与临床特征的比较
2.2 CKD分期与入院时血肿体积相关性分析
按eGFR值将CKD分为G3期、G4期及G5期,并分析比较各期之间初始血肿体积大小的差异。结果显示,G3期患者初始血肿体积明显大于非CKD组,而G5期患者初始血肿体积明显大于非CKD组、G3及G4期患者。见表2。
表2 不同CKD分期脑出血患者初始血肿体积的差异(±s)
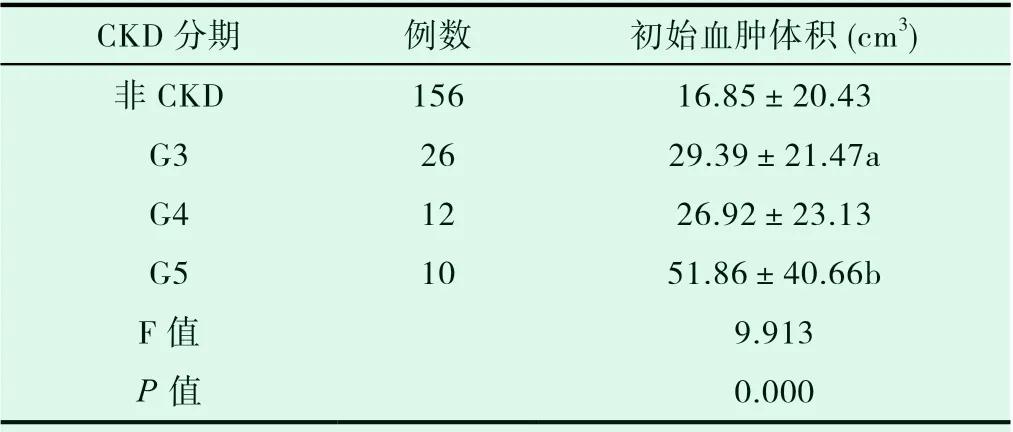
表2 不同CKD分期脑出血患者初始血肿体积的差异(±s)
注:a与对照组相比,P<0.05;b与对照组、G3组及G4组相比,P<0.05。
CKD分期 例数 初始血肿体积(cm3)非CKD 156 16.85±20.43 G3 26 29.39±21.47a G4 12 26.92±23.13 G5 10 51.86±40.66b F值 9.913 P值 0.000
将eGFR值与初始血肿体积行相关性分析,结果显示eGFR与初始血肿体积呈明显负相关(r= -0.322,P=0.000)。
2.3 脑出血预后相关因素分析
将发病90天预后作为因变量,经变量筛选,将年龄、合并CKD、破入脑室、入院时血肿体积、入院时收缩压、入院时随机血糖、NIHSS评分和中性粒细胞计数纳入多因素logistic回归分析。结果显示,合并CKD、破入脑室及入院时血肿体积是脑出血预后不良的独立危险因素(均P<0.01)。见表3。
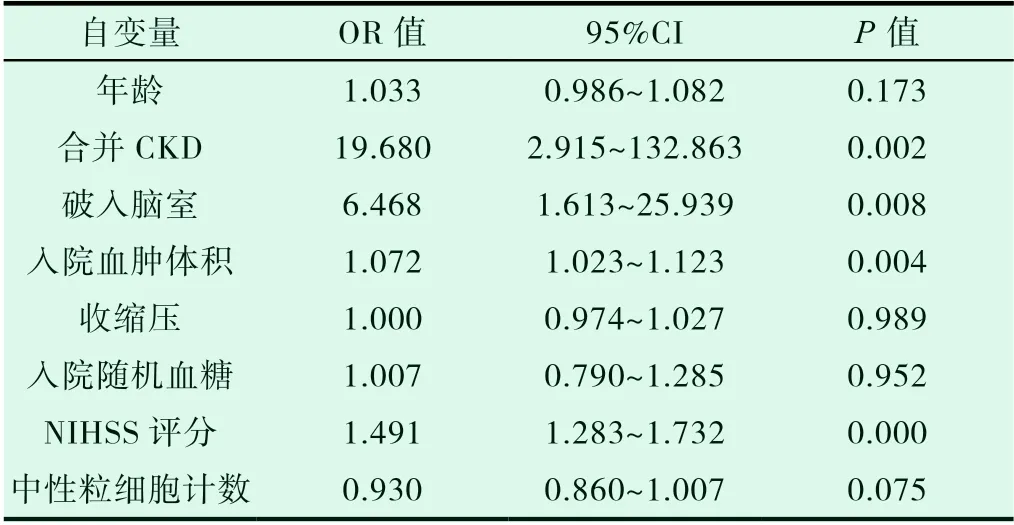
表3 脑出血预后的多因素logistic回归分析
3 讨论
慢性肾脏病(CKD)正成为世界范围内的重大公共卫生问题。据调查,1999年至2004年间约13%的美国成年人患有CKD;而根据2012年的一项全国性研究,我国的CKD患者约有1.17亿人。且CKD与高死亡率及心脑血管疾病密切相关[11]。Gilad等[12]的研究显示CKD是预测急性脑卒中死亡率和预后不良的独立危险因素,且随着肾小球滤过率的下降,患者的死亡率和出现严重中风的风险升高。慢性肾脏病已被证明与急性脑血管病密切相关,越来越多的人开始关注脑与肾的相关作用,Toyoda等提出了“脑肾综合征”的概念[13],而本研究主要观察合并慢性肾脏病对脑出血患者的影响。
Rakesh等[14]的研究结果显示预先存在肾功能衰竭的脑出血患者,其出现中-重度残疾及死亡的概率明显升高,且存在肾功能衰竭是死亡率升高的独立危险因素。本研究同样发现合并CKD的脑出血患者的30天死亡率升高,合并CKD是脑出血预后不良的独立危险因素。且Vanessa等[15]研究显示CKD是脑出血死亡率升高及预后不良的独立危险因素。因此我们认为预先合并CKD的患者发生急性脑出血后,其预后往往更差。而脑出血患者血肿量是患者病情及预后的重要影响因素,Noa等[16]研究发现存在慢性肾脏病的脑出血患者血肿量更大,且脑叶出血的比例更高,预后更差。而本研究结果也显示CKD组的初始血肿体积更大,出血破入脑室的比例更高,且更易发生血肿扩大,但出血部位却与非CKD组无明显差异,这与2016年的一项Meta分析[17]的研究结果是相似的。过去已有研究证实较大的基线血肿体积导致了早期血肿扩张,且血肿扩张是否存在脑室出血与独立相关[18,19],但目前关于肾功能不全与脑出血部位相关性的研究较少,还需后续实验来进一步明确二者关系。本研究还显示患者的初始血肿体积大小与CKD严重程度呈正相关,且G5期患者的血肿体积是要明显大于其他期的,Kang等[20]的研究结果也显示G5期患者的血肿更大,且更容易发生血肿扩大。这可能是由于长期透析损伤内皮细胞功能,也可能与血液透析过程中使用肝素抗凝有关。目前关于CKD导致脑出血血肿体积增大的机制现尚不清楚,可能与以下因素相关。首先CKD会导致血管内皮功能障碍和动脉硬化加速,脑血管发生重构,脑血流自动调节功能受损,高血压状态下仍保持持续性的高灌注[21]。Danni等[22]的研究显示eGFR<60mL/min/1.73 m2的脑出血患者初始收缩压是升高的,且早期强化降压治疗对于肾功能不全的患者是有获益的。本研究同样发现CKD组的入院时收缩压高与非CKD组,血管结构改变及功能失调所致的血压变化可能导致了大血肿。另外CKD患者往往存在血小板功能及凝血功能异常,这二者是脑出血患者血肿增长的主要原因[23]。CKD患者细胞内二磷酸腺苷(ADP)和血清素减少会引起血小板功能障碍,升高的血管前列腺素及活化的血友病因子也会导致出血倾向[24]。Kumai等研究发现[25]CKD患者的血浆纤维蛋白原、凝血酶原、d-二聚体和凝血酶-抗凝血酶Ⅲ复合物的循环浓度较普通人群更高。本实验结果也显示CKD组的纤维蛋白原含量更高,该指标主要反映凝血功能,可能是大出血量导致的应激性升高,其他反应血小板功能及凝血功能的指标CKD组与对照组却没有明显差异,这可能与样本量较小有关。
本研究显示CKD组入院时的随机血糖数值高于非CKD组,脑出血血糖升高主要原因是血肿导致的占位效应会刺激下丘脑产生促肾上腺皮质激素,后者引起皮质醇分泌增加,导致血糖升高。Anubhav等[26]研究结果显示高血糖与脑出血患者的预后不良相关,这可能与高血糖导致的血脑屏障破坏及相关毒性物质的产生有关,血糖升高可能也是导致CKD组预后不佳的间接原因。既往有研究显示ICH会导致小胶质细胞在数小时内被激活,进而分泌细胞因子和趋化因子,在12h内促进中性粒细胞和单核细胞浸润,浸润的中性粒细胞诱导产生的细胞毒性介质和促炎性细胞因子与神经毒性密切相关[27,28]。本研究显示CKD组的中性粒细胞计数更高,脑出血后更活跃的炎性反应可能也是患者病情更加严重的原因。
本实验得出结论,合并CKD的脑出血患者入院时血肿体积更大、出血破入脑室比例更高,血肿扩大风险更大,病情更严重,且初始血肿体积大小与CKD严重程度呈正相关,CKD对脑出血患者的病情转归有不良影响。这其中的机制目前可能与血管硬化、血小板及凝血功能和炎性反应有关,未来需要大样本的前瞻性多中心研究来进一步探讨论证。

