NFATc1对非小细胞肺癌细胞增殖、迁移和上皮间质转化的影响
李智慧,姚菲菲,王富霞
(郑州人民医院呼吸内科,郑州 450000)
肺癌是癌症相关死亡的主要原因,非小细胞肺癌(NSCLC)占肺癌类型的80%[1-2]。经过积极的手术切除、化学和放射治疗后,局部未转移患者的5年生存率约为55%,区域性疾病患者约为27%,远期转移患者约为4%[3]。这主要由于早期就诊率低且确诊时大多处于晚期阶段[4]。因此,寻找灵敏的肿瘤标志物和有效的治疗策略是亟待解决的问题。近年来,研究表明活化T细胞核因子(NFAT)参与肿瘤的发生、发展[5]。在前列腺癌中,活化T细胞c1核因子1(activated T cell c1 nuclear factor1,NFATc1)的表达水平增加,降低NFATc1的表达水平后,对膀胱癌细胞的增殖和转移有一定的抑制作用,可能是膀胱癌治疗的有效靶点之一[6]。在卵巢癌中,NFATc1可促进癌细胞增殖,发挥致癌作用[7]。而在NSCLC中,对NFATc1的表达水平及可能发挥的作用机制研究较少,本研究主要检测NFATc1在NSCLC细胞中的表达水平,利用转染技术敲低NFATc1的表达,进一步分析NFATc1对NSCLC细胞增殖、迁移和上皮间充质转化(EMT)的影响,为NSCLC的靶向治疗提供一定的理论依据。
1 材料与方法
1.1 材料NSCLC细胞H1650、H460、H1299及正常人支气管上皮细胞BEAS-2B(上海细胞生物学研究所);RPMI1640培养基(北京鼎国有限公司);总RNA提取试剂盒、反转录试剂盒(日本TaKaRa公司);NFATc1、Vimentin、N-cadherin、E-cadherin、β-actin一抗和二抗(美国Cell Signaling Technology公司);阴性对照质粒(si-NC)、NFATc1干扰质粒(si-NFATc1)和NFATc1 mimic质粒由北京华大基因合成。
1.2 实验方法
1.2.1 逆转录定量PCR(qRT-PCR)提取H1650、H460、H1299和BEAS-2B细胞中的总RNA,反转录为cDNA,按照SYBR Premix Ex Taq试剂盒说明进行实时定量PCR。以管家基因GAPDH的mRNA水平作为内参照。引物设计如下:NFATc1上游引物序列5′-CACCGCATCACAGGGAAGAC-3′,下游引物序列5′-GCACAGTCAATGACGGCTC-3′,GAPDH上游引物序列5′-AGAAAAACCTGCCAAATATGATGA C-3′,下游引物序列5′-TGGGTGTCGCTGTTGAAGT C-3′。反应条件:95℃5 min,95℃30 s,60℃30 s,72℃30 s,42个循环,采用2-ΔΔCt法计算mRNA相对表达水平。
1.2.2 转染实验 取对数生长期的H1650细胞进行转染实验,以104个/孔的密度接种于6孔细胞板,常规培养24 h,分为si-NC组和si-NFATc1组,按照脂质体lipofeetamine 2000说明书步骤操作,转染6 h后,更换新鲜培养基,放置恒温箱中继续培养48 h,收集各组细胞利用qRT-PCR和Wenstern印迹检测转染效果,qRT-PCR具体实验操作见1.2.1,Wenstern印迹具体实验操作见1.2.3。
1.2.3 Western印迹实验 收集si-NC组、si-NFATc1组细胞加入适量蛋白裂解液,放置冰块上裂解30 min。收集上清,利用BCA蛋白定量试剂盒检测蛋白浓度。取30 μg蛋白,行聚丙烯酰胺凝胶电泳,将凝胶上的蛋白湿转至PVDF膜上。配置5%脱脂奶粉室温封闭2 h,滴加anti-NFATc1(1∶1 000)在4℃冰箱中过夜孵育。采用TBST溶液清洗3遍,每次10 min。之后滴加二抗(1∶4 000)室温孵育1 h,采用TBST溶液清洗3遍,每次10 min。配置一定量的显影液,均匀滴加在膜上,曝光拍照。
1.2.4 CCK-8增殖实验CCK-8试剂检测细胞增殖情况,将si-NC组和si-NFATc1组细胞以每孔2×103的密度接种于96孔板中,每组细胞6个平行孔。饥饿过夜,然后更换含有10%胎牛血清的培养基。放置37℃、5%CO2条件的恒温箱中培养,分别在更换培养基的12、24、36、48、60、72 h时,至于酶标仪450 nm处检测细胞光密度(optical density,OD)值。
1.2.5 集落形成实验 将si-NC组和si-NFATc1组细胞悬液,反复吹打使细胞分散,按照每皿200个细胞的密度接种至培养皿中,以十字方向轻轻混匀,放置操作台中静置10 min,移至恒温箱中培养,根据培养液pH值变化情况更换培养液,培养至肉眼可见的克隆形成,终止培养。弃去培养基,PBS溶液清洗1遍,加入3 mL甲醇固定15 min,然后用DAPI染料染色10 min,终止染色后PBS溶液清洗1遍,拍照并统计集落形成数量。
1.2.6 划痕实验si-NC组和si-NFATc1组细胞以30万每孔的密度接种至6孔板中,放置恒温箱中孵育24 h,用10 μL的枪头至上从下划一道伤痕,在显微镜下拍照。划痕宽度为a值。更换培养基,以免划掉的细胞再次脱落贴壁生长。继续培养24 h,放置显微镜下拍照,划痕宽度为b值。细胞迁移率=(a-b)/a×100%。
1.2.7 Western印迹实验 收集si-NC组、si-NFATc1组细胞加入适量蛋白裂解液,放置冰块上裂解30 min。收集上清,利用BCA蛋白定量试剂盒检测蛋白浓度。取30 μg蛋白,行聚丙烯酰胺凝胶电泳,将凝胶上的蛋白湿转至PVDF膜上。配置5%脱脂奶粉室温封闭2 h,滴加anti-Vimentin、anti-N-cadherin、anti-E-cadherin抗体(1∶1 000),后续操作见1.2.3。
1.3 统计学处理 应用SPSS 21.0软件对数据进行统计分析,正态分布的计量资料以±s表示,两组间比较采用独立样本t检验,多组间均数比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 NFATc1在3种NSCLC细胞中高表达H1650、H460、H1299细胞中NFATc1 mRNA的相对表达水平均高于BEAS-2B细胞(t=10.732,P<0.001;t=4.705,P=0.009;t=4.792,P=0.009),且H1650细胞中NFATc1 mRNA表达水平高于H460、H1299细胞(t=3.593,P=0.023;t=7.505,P=0.002),见图1。

图1 不同细胞系中NFATc1 mRNA的相对表达水平Fig 1 Relative expression of NFATc1 mRNA in different cell lines
2.2 验证si-NFATc1对H1650的敲低效率 将si-NC、si-NFATc1转染至H1650细胞后,在mRNA和蛋白质水平分别检测敲低效率,结果显示转染si-NFATc1组NFATc1 mRNA低于si-NC组(t=9.325,P<0.001),NFATc1蛋白灰度值低于si-NC组(t=10.254,P<0.001),见图2。
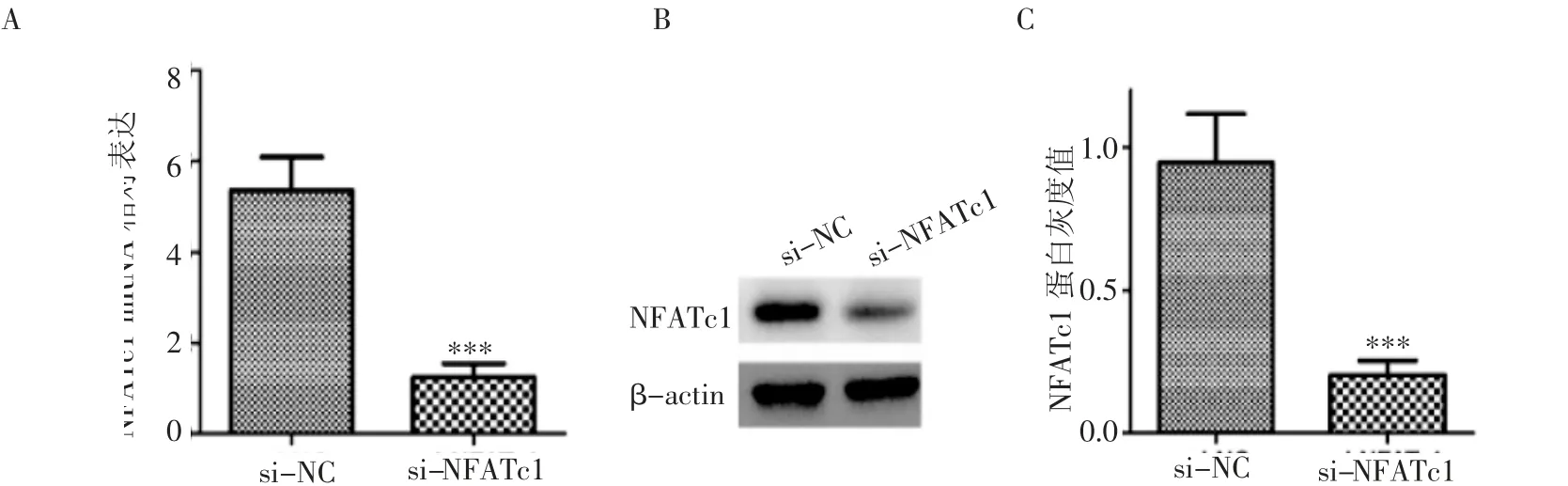
图2 特异性si-NFATc1对H1650的敲低效率Fig 2 Knockdown efficiency of specific si-NFATc1 on H1650
2.3 敲低NFATc1后可有效抑制H1650细胞的增殖 采用CCK8和集落形成实验检测转染质粒后细胞的增殖能力,培养72 h si-NFATc1组细胞的OD值低于si-NC组(t=7.954,P<0.001),细胞集落形成数低于si-NC组(t=12.210,P<0.001),见图3。

图3 敲低NFATc1后对H1650细胞增殖的影响Fig 3 The effect of knocking down NFATc1 on the proliferation of H1650 cells
2.4 敲低NFATc1后可有效抑制H1650细胞的迁移 利用迁移实验检测转染后细胞的迁移率,结果显示si-NFATc1组细胞的迁移率低于si-NC组(t=8.951,P<0.001),见图4。

图4 敲低NFATc1后对H1650细胞迁移的影响Fig 4 The effect of knocking down NFATc1 on the migration of H1650 cell
2.5 敲低NFATc1后可减弱H1650细胞的EMT能力 选择Vimentin、N-cadherin和E-cadherin蛋白水平评估EMT能力,Western印迹实验显示si-NFATc1组E-cadherin蛋白水平高于si-NC组(t=6.352,P<0.001),Vimentin和N-cadherin蛋白的表达水平低于si-NC组(t=6.012,P<0.001;t=10.241,P<0.001),见图5。
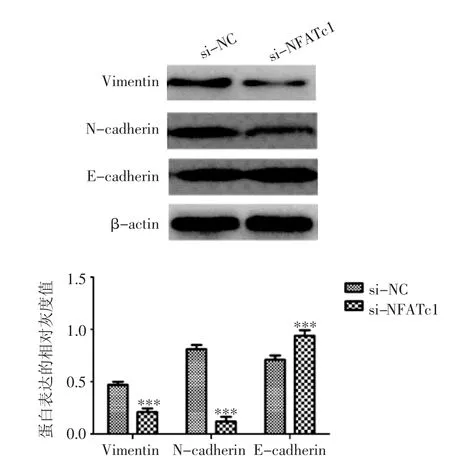
图5 敲低NFATc1后对H1650细胞EMT的影响Fig 5 The effect of knocking down NFATc1 on EMT of H1650 cells
3 讨论
NSCLC是最常见的肺癌,尽管其诊治水平在不断提高,但死亡率仍居高不下。因此,最重要的是研究肺癌发生、发展的潜在机制,并确定其诊断和治疗的基因靶标。NFAT蛋白属于炎症转录因子家族,主要在T细胞活化的背景下参与炎症反应。NFAT活性不仅限于免疫系统,还与几种恶性肿瘤的发生、发展有关。最近有多项研究显示,NFATc1具有致癌性,NFATc1在前列腺癌的治疗中具有一定的临床价值,与卵巢癌的不良预后相关,可促进胶质母细胞瘤侵袭[8-10]。但NFATc1在NSCLC中的作用机制目前研究还较少见,在本研究中发现NFATc1 mRNA水平在3种NSCLC细胞系中的表达水平均上调,并对EMT有影响。EMT是细胞失去上皮特征并获得间质特征的过程,通常由上皮标志物E-cadherin的丢失和间充质标志物Vimentin的表达增加来定义。上皮细胞失去了细胞极性,失去与基底膜的连接,获得了较高的迁移与侵袭、抗凋亡和降解细胞外基质的能力[11]。EMT与多种肿瘤功能有关,包括肿瘤发生、恶性进展、肿瘤细胞迁移和对治疗的抵抗性[12]。本研究中,敲低NFATc1表达水平后,增强了上皮标志物E-cadherin的表达,减弱N-cadherin和Vimentin的表达,表明NFATc1表达降低后可减弱NSCLC细胞EMT作用,以及肿瘤细胞的迁移和侵袭能力。
NFATc1在NSCLC细胞系中的表达水平增加,推断其在NSCLC中发挥促癌基因作用。LI等[13]研究显示,在卵巢癌中NFATc1的表达水平增加,降低其表达水平后可显著降低卵巢癌细胞在裸鼠中的增殖、迁移和侵袭能力,并减少卵巢癌的肿瘤发生。此外,在膀胱癌中亦观察到NFATc1的高表达,NFATc1与根治性前列腺切除术后的复发风险之间存在相关性,表明NFATc1在膀胱癌发展过程中至关重要[14]。本研究中敲低NFATc1的表达后可明显抑制NSCLC细胞的增殖和迁移,与以上的研究结果相一致。HE等[15]研究显示,叉头框蛋白C2可增强NSCLC细胞的增殖和EMT,有可能成为治疗NSCLC的有效靶点。WANG等[16]研究显示,Wnt5a可促进NSCLC细胞EMT和细胞的转移,有望成为治疗NSCLC的有效靶点。FBXW7可抑制NSCLC细胞EMT和顺铂耐药,增加FBXW7的表达水平有可能成为治疗NSCLC的方法之一[17]。本研究中NFATc1在NSCLC中的表达水平增加,降低其表达水平后可显著抑制细胞的增殖、迁移和EMT。
综上所述,NFATc1在NSCLC中表达水平增加,发挥促癌基因的作用,降低NFATc1的表达水平后可抑制NSCLC细胞增殖和EMT。因此,NFATc1有望成为NSCLC治疗的有效靶点。

