B族维生素对肌肉萎缩小鼠PMO运输效率的影响
宋军,林曹瑞,贾璐璐,韩刚,尹海芳
(1.天津医科大学基础医学院细胞生物学系,天津 300070;2.天津医科大学医学技术学院临床生物化学教研室,天津 300203)
杜兴肌肉萎缩症(Duchenne muscular dystrophy,DMD)是一种伴X染色体隐性遗传的致死性疾病,在新生男孩中发病率为1/3 500,是儿童最常见的肌肉萎缩症[1]。患者肌肉细胞膜严重受损,最终因膈肌或心肌纤维化或坏死而过早死亡[2-4]。
糖皮质激素是目前临床上针对DMD治疗使用最为广泛的一种药物,但由于该药物不能从根本上恢复dystrophin蛋白的表达,因此治疗效果十分有限[5-6];并且该激素药物普遍存在生长抑制等多种不良反应,使DMD的治疗仍具有重大挑战[7]。Eteplirsen是一种磷酸二胺吗啉代寡核苷酸(phosphorodiamidate morpholino oligonuclcotides,PMO),也是美国食品药品监督管理局(FDA)最早批准的用来治疗DMD的药物[8-9]。但eteplirseen在临床使用时出现治疗效果有限等问题,表明该治疗方法还需要更多的研究来改进和完善,因此寻找一种安全的小分子药物能够使PMO在较低剂量下,有效提高外显子跳读效率以及肌肉组织中dystrophin蛋白的表达,被认为具有巨大的临床价值。同时有报道称,6-thioguanine[10]、Dantrolene[11]等一些化学药物能够提高DMD模型鼠PMO的跳读效果,对PMO在DMD的治疗中起到显著的促进作用;并且本课题组前期发现,己糖和氨基酸等一些营养物也能够对DMD的外显子跳读疗法有明显的促进作用[12-13];而B族维生素作为人体内正常生命活动所必须的辅酶,是机体所必须的营养物质[14]。为探究其是否能够作为辅剂来增强PMO的治疗效果,笔者在DMD模型mdx小鼠开展筛选和系统测试。
1 材料与方法
1.1 动物与材料 所有维生素药物购自Sigma公司,O.C.T冷冻包埋剂购自Sakura公司,Bradford试剂购自上海生工公司,dystrophin抗体购自Abcam公司,伊红和苏木素染色试剂购自北京中杉金桥公司,山羊血清(NGS)和胎牛血清(FBS)购于Invitrogen公司,含DAPI荧光封片剂购自北京中杉金桥公司。SPF级C57BL/6小鼠购自北京维通利华公司[合格证号:1112511911004196;许可证号:SCXK(京)2017-0005];mdx小鼠自行繁殖于天津医科大学动物中心SPF级实验室。
1.2 方法
1.2.1 小鼠分组及给药 对于局部注射实验,27只同年龄的mdx小鼠通过简单随机抽样分成9组:PMO生理盐水组和PMO联合8种维生素实验组,每组3只,2 μg的PMO添加到生理盐水或其他维生素溶液(5%)中,制成40 μL体积的注射液,注射到各组mdx小鼠的胫骨前肌中,2周后收样,Saline表示PMO生理盐水组,其他为不同维生素与PMO混合治疗的实验组。对于系统注射实验,6只同年龄的mdx小鼠通过简单随机抽样分成两组:PMO生理盐水组和PMO联合维生素B12组,每组3只,将PMO剂量改成25 mg/kg添加到生理盐水和5% B12溶液中,制成120 μL体积的注射液通过尾静脉进行注射,每周1次,注射3次,最后1次注射后2周收样。PMO-S组表示PMO生理盐水组,PMO-B12表示PMO与维生素B12混合治疗的实验组,C57表示野生型的阳性对照,mdx组表示不给药的空白对照,且所有实验的C57和mdx小鼠都是年龄匹配的小鼠。
1.2.2 组织蛋白提取和浓度测定 动物处死后取出肌肉组织,用O.C.T包埋放入液氮冰冻,用冷冻切片机切成组织碎片收集到EP管中,加入90 μL组织裂解液(95%lysis buffer+5%β-mercaptoethanol)在冰上裂解30 min,随后13 000×g(r=40 cm)离心10 min,取上清即为蛋白样品。蛋白浓度测定使用Bradford法进行测定,取稀释100倍的蛋白样品和5个不同浓度梯度的蛋白标准品与250 μL的Bradford溶液混合,用酶标仪测量各溶液在595 nm处的吸光值,通过标准曲线法计算出不同样品的蛋白浓度。
1.2.3 Western印迹检测特异性蛋白表达水平 配制浓度为6%的SDS-PAGE凝胶,实验组以及阴性对照mdx组的每个蛋白样品取50 μg进行上样,阳性对照C57组根据标注的百分比乘以50 μg进行不同量的上样(2% C57即上样1 μg、5% C57即上样2.5 μg、6%C57即上样3 μg、8%C57即上样4 μg、10% C57即上样5 μg),80 V恒压下电泳30 min后调至120 V恒压电泳3 h,通过110 mA的恒流过夜将凝胶上的蛋白转到PVDF膜上,随后用5%脱脂牛奶封闭4 h,加入一抗孵育过夜,再用牛奶洗3次,每次10 min,立即用二抗进行孵育,再用PBST洗3次,每次15 min,洗完后加上发光液(A液:B液=1:1),在暗室进行压片曝光。每个样品中dystrophin蛋白表达水平通过Image J软件得出灰度值与对照的百分比C57样品灰度值进行对比定量,计算出样品中dystrophin蛋白的含量。
1.2.4 组织中dystrophin蛋白免疫荧光染色 选择冷冻切片机切出厚度为8 μm的组织切片,放室温平衡,随后用油性笔圈出组织在玻片上的范围,放入干净的PBS中浸泡10 min,取出滴入封闭液(20% NGS、20%FBS和60%PBS)室温封闭1.5 h,去除封闭液后滴加dystrophin一抗,室温孵育1.5 h,PBS洗3次,滴加荧光二抗,室温孵育1 h,PBS洗3次后滴加含有DAPI的封片剂封片并避光晾干。
1.2.5 肌肉组织HE染色 选择冷冻切片机切出的8 μm厚的组织切片,放室温平衡,随后放入干净的PBS中浸泡10 min,取出进行梯度水化(无水乙醇→95%乙醇→85%乙醇→70%乙醇各浸泡5 min),浸入蒸馏水15 s,取出浸泡到苏木素染液中13 min,用蒸馏水洗去玻片背景,浸入伊红染液染色1 min,同样用蒸馏水洗去背景后进行梯度脱水(70%乙醇→85%乙醇→95%乙醇→无水乙醇分别15 s、30 s、1 min、3 min),随后浸入二甲苯中通透5~10 min,最后用中性树脂进行封片。
1.3 统计学处理 使用Adobe photoshop、Adobe illustrator和Image J软件对图片和数据进行处理和分析,使用SPSS20.0进行统计分析,符合正态分布的计量数据通过±s表示,各组间比较采用t检验进行分析,P<0.05为差异具有统计学意义。
2 结果
2.1 免疫荧光染色检测B族维生素局部筛选情况 首先通过组织免疫荧光染色检测肌肉组织中dystrophin阳性肌纤维的数量和分布情况,结果显示:与PMO生理盐水组相比,PMO与维生素B2、B3、D-Panthenol、B9和B12混合能显著提高dystrophin阳性肌纤维的恢复数量(图1A),其中维生素B12混合治疗组dystrophin阳性肌纤维数量最多,达到了49.3%(t=8.015,P<0.01,图1B)。
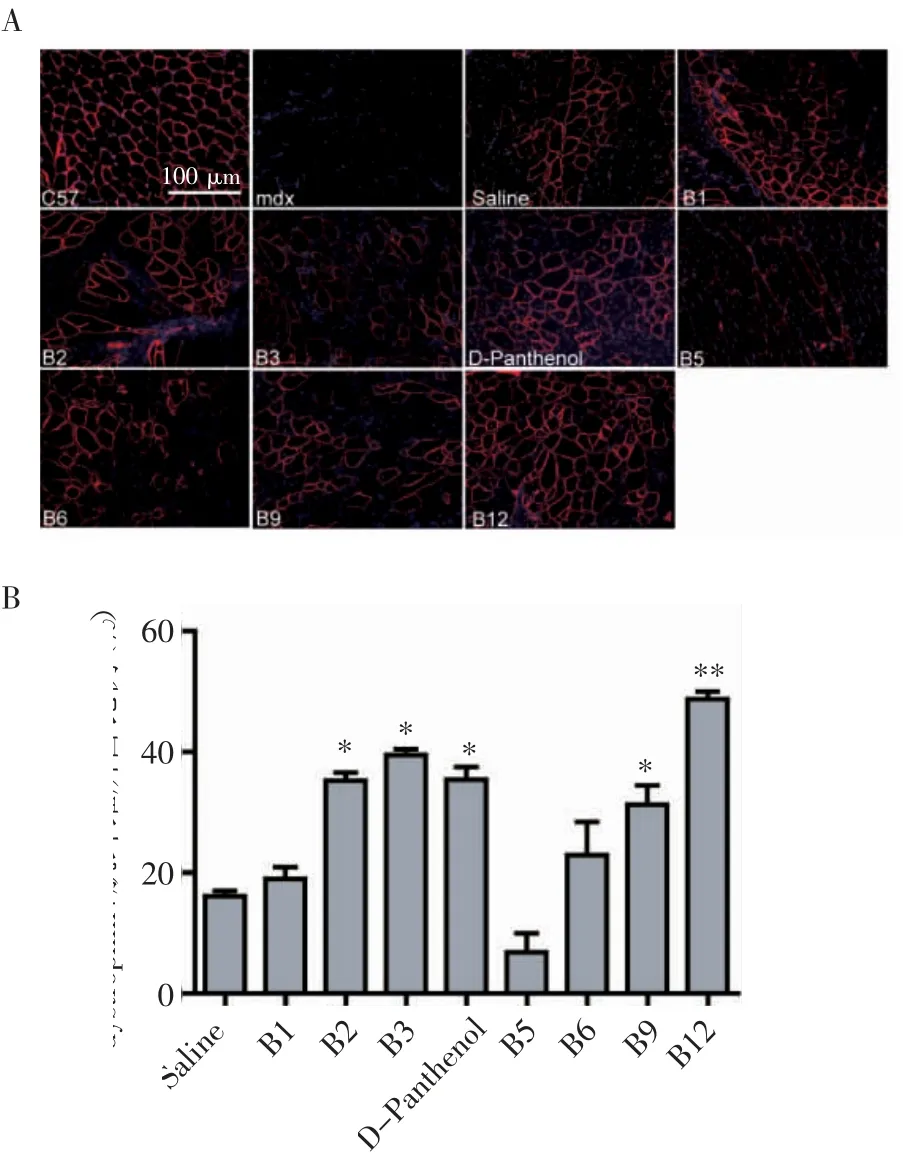
图1 免疫荧光染色检测不同维生素与PMO在mdx小鼠上的局部筛选情况(100×)Fig 1 Local screen of vitamins with PMO in mdx mice by immunofluorescence(100×)
2.2 Western印迹检测B族维生素局部筛选情况PMO与维生素B2、B3、D-Panthenol和B12混合能显著提高dystrophin蛋白的表达水平(图2A),通过计算各组灰度值与对应的2% C57(1 μg)、5%C57(2.5 μg)、8% C57(4 μg)、10% C57(5 μg)灰度值对比定量,结果显示,维生素B12混合治疗组表达水平最高,达到了10.5%(t=5.207,P<0.05,图2B)。

图2 Western印迹检测不同维生素与PMO在mdx小鼠上的局部筛选情况Fig 2 Local screen of vitamins with PMO in mdx mice by Western blotting
2.3 免疫荧光染色检测维生素B12对PMO系统的促进作用 相比于PMO生理盐水组B12治疗组胫骨前肌和股四头肌组织中dystrophin阳性肌纤维数量明显增多(图3)。

图3 免疫荧光染色检测维生素B12与PMO在mdx小鼠上的系统治疗情况(100×)Fig 3 Systemic evaluation of vitamin B12 and PMO in mdx mice by immunofluorescence(100×)
2.4 Western印迹检测维生素B12对PMO系统促进作用 同样选择小鼠肌肉组织蛋白检测dystrophin蛋白表达水平,结果显示,B12治疗后蛋白表达水平有所提高(图4A),而通过计算各组灰度值与对应的2% C57(1 μg)、5% C57(2.5 μg)、6% C57(3 μg)、10% C57(5 μg)灰度值对比定量,结果发现辅助添加B12联合治疗后胫骨前肌(t=9.631,P<0.01)和股四头肌(t=8.452,P<0.01)dystrophin蛋白表达水平得到了显著的提高(图4B)。
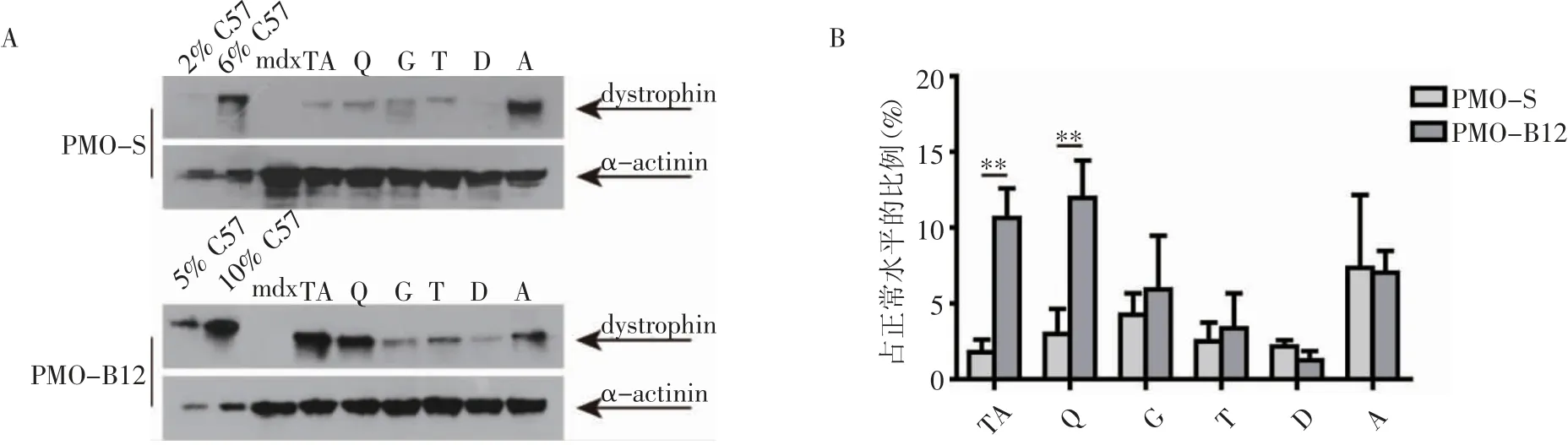
图4 Western印迹检测维生素B12与PMO在mdx小鼠上的系统治疗情况Fig 4 Systemic evaluation of vitamin B12 and PMO in mdx mice by Western blotting
2.5 PMO-B12对mdx小鼠肌肉病理的影响PMOB12联合治疗组没有出现肌肉的不良反应(图5)。

图5 维生素B12与PMO在mdx小鼠上的系统治疗病理检测(100×)Fig 5 Muscle pathology of mdx mice treated with vitamin B12 and PMO systemically(100×)
3 讨论
DMD是一种常见的遗传性肌肉萎缩症,患病儿童在少年时便开始发病,并随着年龄增加,症状不断加重,到青少年时便失去独自行动能力,最终由于膈肌或心肌病变导致呼吸衰竭或心脏功能受损而过早死亡,患者平均寿命只有21岁[1,15]。而本研究所使用的DMD模型小鼠mdx是其dystrophin基因外显子23发生点突变,形成终止密码子,使蛋白不能正常表达,与疾病的发病机制相同,因此这种模型小鼠在一定程度上很好的体现了DMD的一些病症[16-17]。
近年来关于DMD的治疗也取得了一定的进展,FDA批准上市了多款外显子跳读疗法的反义寡核苷酸药物[18-19]。尽管如此,但在临床使用时发现核酸药物存在着难以解决的如用药量大、靶向性差及系统运输效率低等问题,前期的报道称Dantrolene[11]、己糖GF[12,20]以及glycine等[13]小分子分别通过影响剪接频率、能量供给以及组织新生角度去促进反义寡核苷酸药物引起的外显子跳读,都取得了较好的治疗效果,但现有的这些小分子辅剂对DMD患者心脏功能的改善效果非常有限。因此笔者通过动物模型对生活中常见的营养分子维生素进行筛选。
本研究首先在局部筛选过程中使用PMO与不同维生素混合进行治疗,以单独的PMO治疗效果为基准,评价维生素带来的促进效果,结果发现,维生素B12能将dystrophin蛋白恢复水平从5%作用提高到接近12%,展现出了巨大的潜力。在随后的系统治疗中,维生素B12作为营养补充剂单独治疗并不能显示出对dystrophin蛋白的恢复,这与6-thiog uanine[10]和glycine等[13]小分子辅剂类似,因此在系统治疗中未设置单独维生素B12实验组,但通过与PMO生理盐水组进行比较,发现维生素B12联合治疗能够显著提高PMO在胫骨前肌和股四头肌上的治疗效果,但治疗效果主要体现在占比较大的骨骼肌上面,推测维生素B12在通过尾静脉注射进入循环系统后,很快随血流进行全身系统的分布,但由于脂溶性较差很难在组织内部进行停留,快速被机体清除出去[21-22]。因此针对占比较大的骨骼肌更能受到维生素带来的影响,这也导致PMO的治疗效果在大多数的肌肉组织非常有限,因此后续改变维生素B12的给药途径,例如口服给药或者给药频率改成每日补充,可能会显著提高维生素B12的治疗效果。同时通过HE染色检测肌肉组织病理情况发现,维生素PMO-B12联合治疗在提高原有的PMO治疗效果的同时,并未检测到肌肉的损伤,推测是由于水溶性维生素不会在体内进行蓄积,会被快速清除,因此避免了因为频繁给药而带来一定的不良反应在后续研究中,将会在mdx小鼠上对PMO联合维生素B12进行一个长期的系统治疗,进一步探究维生素B12对PMO治疗的促进作用,为DMD的临床治疗提供新的治疗手段。

