球霰石碳酸钙制备工艺优化及几丁质酶对碳酸钙的影响
吕凤娇,郭 悦,徐 露,施 雯,魏雨洪,孙丽丹,谢晓兰
(泉州师范学院化工与材料学院,福建泉州 362000)
碳酸钙是动物贝壳、甲壳、蛋壳、牙齿以及骨头等生物体硬组织的主要成分,在生物体内由蛋白质、多糖等生物大分子调控下矿化形成[1−4]。碳酸钙主要有方解石、文石、球霰石等3 种晶型,不同晶型具有不同形状、性质和功能[5−6]。方解石和文石是单晶体,具有热力学稳定、结构密实的特性,在自然界广泛存在;球霰石是多晶体,一般是由纳米级球形颗粒聚集而成的结构松软的多孔微球,具有密度小、比表面积大、溶解性和分散性好、良好生物安全性及可吸收利用性,被广泛用于食品和医药等行业领域[7−9]。如利用球霰石微球具有促进骨基质形成的特性[10],在增加骨密度的保健食品中,碳酸钙成为使用率最高的补钙配方主成分[11],同时也被用于人工骨和人造牙齿的制备[12];利用其孔隙率高的特性,用作药物、生物标记物、生物传感器等生物医药载体[13−15]。
然而球霰石热力学不稳定,易转化成文石或方解石,自然界中存量稀缺,故如何合成稳定的球霰石碳酸钙越来越受关注[7,9]。目前球霰石碳酸钙的合成方法主要采用碳化法和复分解法,碳化法是直接往Ca2+溶液中通入CO2反应生成碳酸钙,产品纯度较高,但容易受CO2溶解速率影响导致球霰石产率较低;复分解法是利用可溶性钙盐和碳酸盐混合反应制备碳酸钙,反应快产率高,但容易引入杂质;且非仿生体系下,两种方法合成的产品稳定性均较差,易转化成文石与方解石导致产品纯度不高[7,9]。为了提高球霰石稳定性,近年来在碳化法和复分解法合成体系里添加糖、蛋白质等有机分子做为晶型调控剂。仿生合成稳定球霰石的研究报道不少[16−24],但研究内容基本侧重于添加剂对晶型的调控,而关于添加剂对球霰石产率和纯度的影响鲜少研究。
几丁质酶是一种糖苷键水解酶,广泛分布在动物、植物以及微生物等各种生物体内,具有消化几丁质食物、调控形态发育、抗菌防御等功能,在食品、医疗、环保等方面具有广泛应用[25−26]。虾蟹、昆虫等甲壳动物的几丁质酶主要分布在胃肠等内脏和壳膜等组织部位,与围食膜蜕换和周期性蜕壳生长发育密切相关[27−31]。韩晓梅等[2]报道虾蟹壳约含15%~25%的甲壳素和50%矿物质等化合物,其中矿物质主要是碳酸钙,虾蟹壳中碳酸钙生物合成应该与壳膜几丁质酶的调控具有密切关系,但有关几丁质酶对碳酸钙仿生合成调控的研究未见报道。本文优化了钙离子碳化合成碳酸钙的工艺条件,并在优化工艺条件下考察了几丁质酶对钙离子碳化合成碳酸钙的调控,通过扫描电镜(SEM)、红外光谱(IR)等表征分析了产品组成与形貌特征,研究内容对高产率高纯度的球霰石仿生合成和食药级碳酸钙的制备具有重要指导意义。
1 材料与方法
1.1 材料与仪器
几丁质酶 实验室自制,以凡纳滨对虾内脏为材料,经pH 7.5 Tris-HCl 缓冲液抽提、硫酸铵分级沉淀、透析、Sephadex G-100 和DEAE-32 柱层析制备得电泳纯制剂[26],比活力为14.15 U/mg,备用;99.95% CO2气体 泉州市丰泽区东流焊接材料经营部;无水氯化钙(分析纯) 国药集团化学试剂有限公司;乙二胺四乙酸二钠(分析纯)、钙羧酸指示剂(分析纯) 北京鼎国昌盛生物技术有限责任公司;氨水(分析纯) 西陇科学股份有限公司;其它试剂 均为国药集团化学试剂分析纯产品;实验用水 为去离子水。
DGG-9123A 型电热恒温鼓风干燥箱 上海森信实验仪器有限公司;DF-101S 集热式恒温加热磁力搅拌器 巩义市予华仪器有限责任公司;JY3002电子天平 上海舜宇恒平科学仪器有限公司;AR124CN 分析天平 奥豪斯仪器(常州)有限公司;FE28 pH 计 梅特勒-托利多仪器有限公司;NICOLET iS 10 红外光谱仪 Thermo Fisher SCIENTIFIC;ZEISS MERLIN Compact 扫描电镜 德国Zeiss 公司;STA 409 PC 热重分析仪 NETZSCH。
1.2 实验方法
1.2.1 碳酸钙碳化制备工艺 用氨水调节CaCl2溶液至合适pH,再加入适量几丁质酶(按不同酶钙质量比或不加),混匀后,在一定温度下通入CO2,使钙离子碳化析出晶体,抽滤、洗涤后烘干得碳酸钙产品。

式中:cs,EDTA 标准溶液浓度,mol/L;V2,滴定消耗的EDTA 标准溶液体积,mL;V1,样液体积,mL。
碳化前后溶液体积变化忽略不计,钙离子碳化率计算公式如下:

1.2.3 碳化工艺的单因素实验 对几丁质酶添加量(按不同酶钙质量比添加)、温度、CaCl2浓度、pH、碳化时间等5 个因素进行单因素实验,平行实验3 次,分别考察各因素对钙离子碳化率的影响,确定较优工艺条件。
1.2.3.1 几丁质酶对钙离子碳化率的影响 按0:1、0.001:1、0.002:1、0.004:1、0.01:1 的酶钙质量比,分别往30 mL pH 12.0 的1.00 mol/L 的CaCl2溶液中加入不同量的几丁质酶,搅拌混匀后,20 ℃下,按1 L/min 气流速度通入CO2碳化5 min 后,过滤收集样品,测定分析计算碳化率,考察几丁质酶添加对钙离子碳化率的影响。
1.2.3.2 温度对钙离子碳化率的影响 分别在0、10、20、30、40、50、60 ℃等不同温度下,按1 L/min气流速度,往30 mL pH12.0 的1.00 mol/L 的CaCl2溶液,通入CO2碳化 5 min 后,过滤收集滤液和CaCO3产物,分析滤液残余钙离子浓度,计算碳化率,考察温度对钙离子碳化率影响,确定较佳碳化温度。
1.2.3.3 CaCl2浓度对钙离子碳化率的影响 20 ℃下,按1 L/min 气流速度,分别往30 mL pH12.0 的0.25、0.50、0.75、1.00、1.25、1.50 mol/L 等不同浓度的CaCl2溶液,通入CO2碳化5 min 后,过滤收集样品,测定分析计算碳化率,考察CaCl2浓度对钙离子碳化率影响,确定较佳CaCl2浓度。
1.2.3.4 pH 对钙离子碳化率的影响 20 ℃下,按1 L/min气流速度,分别往30 mL 用氨水调节至pH 10.5、11.0、11.5、12.0、12.5 等不同pH 的1.00 mol/L 的CaCl2溶液,通入CO2碳化5 min 后,过滤收集样品,测定分析计算碳化率,考察pH 对钙离子碳化率影响,确定较佳pH。
1.2.3.5 碳化时间对钙离子碳化率的影响 20 ℃下,按1 L/min 气流速度,往30 mL pH 12.0 的1.00 mol/L的CaCl2溶液,分别通入CO2碳化1、2、3、5、7、9 min 后,过滤收集样品,测定分析计算碳化率,考察碳化时间对钙离子碳化率影响,确定较佳碳化时间。
1.2.4 正交试验优化碳化工艺条件 为进一步优化碳化工艺条件,根据单因素实验结果,选取A 碳化温度(℃)、B 碳化时间(min)、CpH、DCaCl2浓度(mol/L)等4 个因素作为试验因素,以钙离子碳化率为指标,按L9(34)正交表制定正交方案并实验,正交试验因素水平见表1。

表1 正交试验因素水平设计Table 1 Factors and levels of orthogonal test
1.2.5 几丁质酶对碳酸钙晶型调控的研究 在优化的碳化工艺条件下,分别按0:1、0.002:1、0.004:1、0.01:1 酶钙质量比往30 mL 的碳化体系中加入几丁质酶,充分搅拌混匀后,以1 L/min 气体流速持续通入CO2碳化,碳化结束后过滤收集滤液和CaCO3产物,分析滤液残余钙离子浓度,计算碳化率,洗涤收集CaCO3固体,并置于105 ℃下干燥至恒重,称重并取样分析产品几丁质酶含量及表征产品形貌特征,与同等条件下不加几丁质酶碳化制备的CaCO3形貌比较,考察几丁质酶对碳酸钙晶型的调控。
1.2.6 碳酸钙产品表征
1.2.6.1 扫描电镜形貌分析 用直接分散法处理样品:先把裁剪好的尺寸适中的导电胶粘在铜片上,接着将烘干的待测样品借外物直接散落附着于导电胶。进样,观察各样品在放大1000~20000 倍下的形貌,晶型及粒径大小。
1.2.6.2 红外光谱定性分析 按50:1~100:1 的质量比取适量KBr 粉末和少量碳酸钙样品于玛瑙研钵中,研磨后压片,以KBr 空白片剂为参照,扫描4000~400 cm−1之间的红外光谱,表征分析产物组成。
1.3 数据处理
所有工艺优化实验均做3 个平行,用Excel 2007、SPSS 18.0、Grapher 8.0 等软件进行数据处理与分析,实验结果以平均值±标准差表示,单因素方差分析(ANOVA)按P<0.05 分析显著性。
2 结果与分析
2.1 单因素实验
2.1.1 几丁质酶对钙离子碳化率的影响 蛋白质类调控剂的侧链一般都含有—COOH 等可解离基团,会与钙离子产生静电与配位作用,影响碳化反应。由图 1 可见,按不同酶钙质量比分别往相同的碳化体系中加入不同量几丁质酶后,钙离子碳化率基本在98.31%~98.54%间波动,对实验数据进行单因素方差分析,P=0.775>0.05,说明几丁质酶添加对钙离子的碳化率不具有显著性影响。

图1 几丁质酶添加量对钙离子碳化率的影响Fig.1 Effect of chitinase addition on the rate of carbonation of calcium ion
2.1.2 温度对钙离子碳化率的影响 温度会影响化学反应速度和化学反应平衡,温度升高可以提升体系中离子运动速率促进离子之间碰撞结合的机会,有利碳化反应;但温度升高也会降低CO2的溶解度,导致体系中CO32-离子浓度下降,不利钙离子的碳化反应。由图2 可见,在固定碳化体系下,温度低于30 ℃时,钙离子碳化率随着温度升高而轻微上升;温度高于30 ℃时,钙离子碳化率随温度升高而出现下降趋势;整体变化趋势显示,低温体系下的钙离子溶液碳化率优于高温体系;说明随着温度升高,CO2的溶解度对碳化率影响渐趋主导,在30 ℃下,具有较好的碳化效果,钙离子碳化率达97.89%;单因素方差分析P=0.00657<0.05,说明温度对钙离子碳化率具有显著性影响。
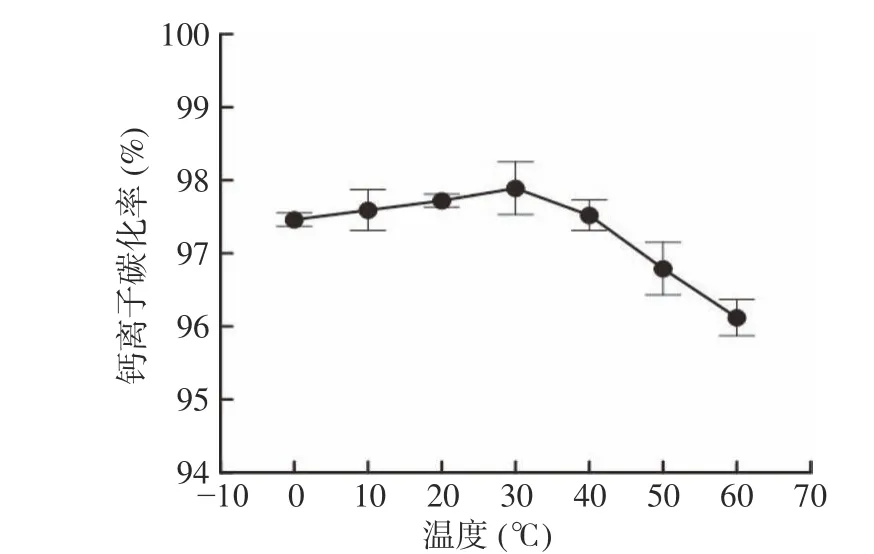
图2 温度对钙离子碳化率的影响Fig.2 Effect of temperature on the rate of carbonation of calcium ion
2.1.3 CaCl2浓度对钙离子碳化率的影响 固定碳化时间、CO2通入流速时,体系CaCl2初始浓度直接影响到CO32−/Ca2+的比例,从而影响钙离子的转化率。图3 显示,随CaCl2浓度上升,钙离子碳化率呈现先增大后趋于平稳的趋势。当钙离子浓度小于1.0 mol/L 时,体 系 局 部CO32−/Ca2+的 比 例 较 高,CO32−过饱和,碳化结束时可能导致碳化成的碳酸钙少量转化成碳酸氢钙,从而导致钙离子碳化率较低;但随着CaCl2浓度上升,体系CO32−/Ca2+比例下降,CO32−过饱和度下降并逐渐趋于稳定,体系钙离子基本都碳化成碳酸钙并稳定存在,故钙离子碳化率随钙离子浓度增大而上升,并趋于稳定;当钙离子浓度为1.00 mol/L 时,就具有较佳的碳化效果,碳化率为98.37%。单因素方差分析P=4.56×10−10<0.05,说明CaCl2浓度对钙离子碳化率的影响具有显著性。
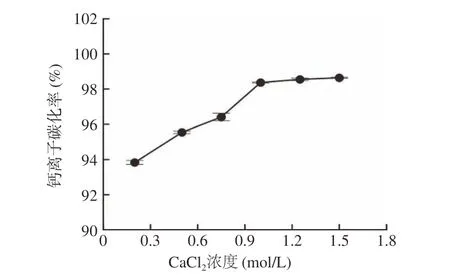
图3 CaCl2 浓度对钙离子碳化率的影响Fig.3 Effect of CaCl2 concentration on the rate of carbonation of calcium ion
2.1.4 pH 对钙离子碳化率的影响 碳化体系的pH 直接影响二氧化碳的溶解度以及碳酸的解离趋势(碳酸二级解离常数,pKa2=10.2),进而影响着体系钙离子的碳化反应效果。实验采用氨水调节碳化体系pH,考察pH 对钙离子碳化率的影响,由图4 可知,钙离子碳化率随着体系pH 增大呈现先增大后趋于平稳的趋势;pH<12.0,体系钙离子碳化率随着pH 增大快速增大;pH>12.0,钙离子的碳化率随pH 增大变化不明显;当pH=12.0 时,钙离子碳化率为98.14%。单因素方差分析P=1.25×10−17<0.05,说明pH 对钙离子碳化率的影响具有显著性。考虑强酸强碱设备成本,确定碳化体系较佳pH 为12。

图4 pH 对钙离子碳化率的影响Fig.4 Effect of pH on the rate of carbonation of calcium ion
2.1.5 碳化时间对钙离子碳化率的影响 固定碳化体系下,碳化时间直接影响着钙离子与通入的二氧化碳的碳化反应程度。图5 显示,随碳化时间延长,钙离子碳化率呈现先增大后趋于平稳的趋势。当碳化时间小于3 min 时,碳化率随碳化时间延长而快速上升,说明在这个时间范围内,钙离子不能达到完全的碳化效果;当碳化时间为3、5、7、9 min,体系钙离子碳化率分别达97.60%、98.57%、99.11%、99.22%;即碳化时间大于3 min 后,钙离子的碳化率上升缓慢,基本趋于稳定,说明碳化3 min 后体系大部分钙离子已基本完成碳化反应;单因素方差分析P=1.45×10−21<0.05,说明碳化时间对钙离子碳化率具显著性影响。考虑碳化程度,确定较佳碳化时长为5 min。
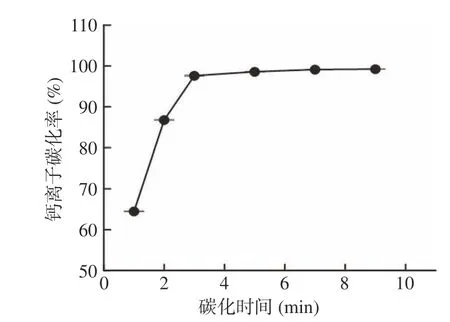
图5 碳化时间对钙离子碳化率的影响Fig.5 Effect of reaction time on the rate of carbonation of calcium ion
2.2 正交试验优化碳化工艺条件
2.2.1 正交试验与结果分析 由于添加少量几丁质酶不影响碳化率,故确定A 碳化温度(℃)、B 碳化时长(min)、C pH、D CaCl2浓度(mol/L)等四因素进行正交试验,根据单因素优化结果,分别在A 碳化温度(℃)、B 碳化时长)min)、C pH、D CaCl2浓度(mol/L)等4 个因素的较佳值周边选择三个水平,按L9(34)正交表设计组合出9 个实验方案,以钙离子碳化率为指标,进一步优化碳化工艺条件。具体的实验方案及实验结果极差分析见表2,实验结果的SPSS 方差显著性分析见表3。
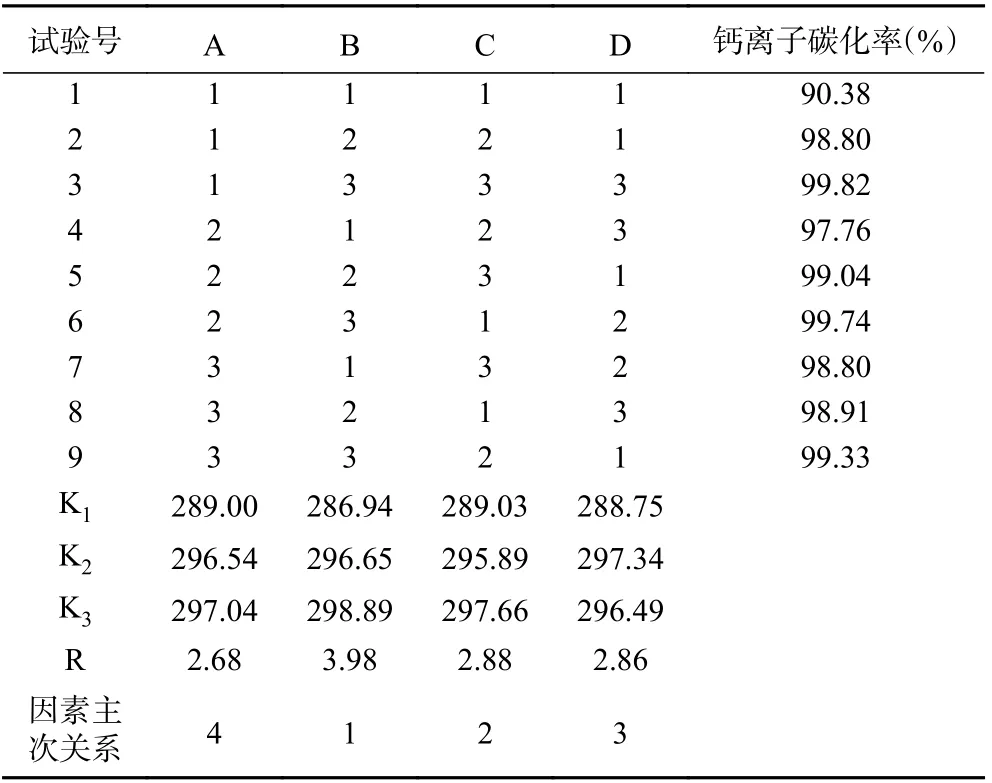
表2 钙离子碳化制备碳酸钙的正交实验方案及实验结果Table 2 The schemes and results of orthogonal experiments for the preparation of calcium carbonate by calcium ion carbonization

表3 正交试验结果方差统计分析Table 3 Statistical analysis of variance of orthogonal test results
由表2 实验结果可知,按A1B3C3D3组合的工艺条件,即在体系pH12.5,碳化温度25 ℃下,对30 mL 1.1 mol/L CaCl2溶液碳化时间6 min,可取得最佳碳化效果,碳化率达99.82%。但对实验结果进行极差分析,结果显示最佳碳化工艺条件组合应该为A3B3C3D2,即体系pH 为12.5、碳化温度为35 ℃、CaCl2浓度为1 mol/L、碳化时间为6 min;通过比较R 值可知,四个因素对钙离子碳化率的影响主次顺序为:B>C>D>A,即碳化时间>pH>CaCl2浓度>碳化温度。表3 的SPSS 统计分析结果显示,四个因素对钙离子碳化率影响均具有显著性,影响主次顺序同极差分析结果基本一致。
2.2.2 钙离子碳化最佳工艺条件验证 由于正交实验结果显示最佳反应条件为A1B3C3D3组合,而正交实验结果极差分析得出的最佳反应条件为A3B3C3D2组合,结果不一致。故在A3B3C3D2组合条件下进行验证实验,平行实验三次,得钙离子碳化率达99.88%±0.02%,比A1B3C3D3组合条件下的碳化率99.82%稍高一点,故确定钙离子最佳碳化工艺条件为体系pH 为12.5、碳化温度为35 ℃、CaCl2浓度为1 mol/L、碳化时间为6 min。
2.3 几丁质酶对碳酸钙晶型的调控
在优化的碳化工艺条件下,分别按0:1、0.002:1、0.004:1、0.01:1 的酶钙质量比,往35 ℃、pH 12.5、30 mL 的1 mol/L CaCl2溶液中加入几丁质酶,搅拌混匀后,持续通入二氧化碳碳化6 min,碳化结束分析计算钙离子碳化率,不同体系下的碳化率在99.85%~99.92%范围内波动,结果进一步显示几丁质酶的添加确实不影响钙离子的碳化率。产品经洗涤、烘干至恒重后,取适量产品酸溶后,根据蛋白质的紫外特征吸收性质,测定样品液在280 nm 的吸光度值判断产品是否夹杂几丁质酶,结果显示不同酶钙质量比的碳化体系制备的产品均无夹杂几丁质酶。在此基础上,取样进行扫描电镜、红外光谱等性能表征测试,进一步了解几丁质酶对碳酸钙晶型的调控及产品组成情况。
2.3.1 扫描电镜分析 采用扫描电镜(SEM)测定不同量几丁质酶调控下碳化而成的碳酸钙的形貌和粒径。图6 中的a、b、c、d 分别是未加酶、按0.002:1、0.004:1、0.01:1 的酶钙质量比添加几丁质酶调控碳化形成的碳酸钙的SEM 图像。
由图6a 可见,未添加几丁质酶调控碳化制备的碳酸钙是由约110 nm 的球状颗粒和少部分尺寸近1 μm的菱形块状自组装形成的直径为2 ~ 8 μm 左右的大小不一的微球。图6b 显示,按0.002:1 的酶钙比添加几丁质酶制备得到的碳酸钙微球尺寸变小,且菱形块状形貌消失,碳酸钙基本由80 nm 的纳米级球状颗粒团聚而成的粒径约为2 ~ 4 μm 的大小较均匀的微球。进一步增大几丁质酶加入量,由图6c、6d 可知,碳酸钙基本颗粒和微球粒径随着酶添加量增大而减小,纳米球基本颗粒的团聚由紧密趋向蓬松;按0.004:1 的酶钙比添加酶调控,可得到70 nm 的纳米颗粒团聚组成的粒径约为1.5 μm 的大小均匀的微球;当比例增到0.01:1,得到60 nm 的纳米颗粒团聚组成的粒径小于1 μm 的蓬松微球。SEM 表征结果说明几丁质酶的添加不仅能改变碳酸钙基本颗粒的晶型与尺寸,还会影响碳酸钙颗粒团聚的紧密度与团聚微球粒径,这对食品、保健等轻工业新型钙制剂的制备与应用具有重要意义。几丁质酶对碳酸钙晶型的调控效应与高平章等[17]用胰蛋白酶调控碳酸钙晶型的效果类似,肯定了蛋白质类物质对碳酸钙的仿生制备过程具有实际的调控作用。

图6 不同量几丁质酶调控制备的碳酸钙的扫描电镜图Fig.6 Scanning electron microscope of calcium carbonate prepared under the control of different amounts of chitinase
2.3.2 红外光谱分析 方解石型碳酸钙的红外光谱特征吸收峰为876 cm−1和712 cm−1[4,32]。图7 是未加几丁质酶调控CaCl2碳化形成的碳酸钙红外光谱图,由图可见,在3436、1421、875 cm−1和714 cm−1处出现特征吸收峰,与竹文坤等[22]以CaCl2和碳酸钠为原料在纯水体系下复合合成的方解石型碳酸钙的红外谱图基本一致,均具有876 cm−1和712 cm−1的红外特征峰,说明未加几丁质酶调控碳化形成的碳酸钙为方解石型。图中3436 cm−1是H-O 键的伸缩振动吸收峰,表明碳酸钙含有水分;而1421 cm−1是方解石型碳酸钙中的C-O 键的伸缩振动特征吸收峰;875 cm−1和714 cm−1是方解石型碳酸钙中C-O键的弯曲振动特征吸收峰。目前大部分实验制备的方解石基本是密实菱形,但电镜图显示未加几丁质酶碳化制备的碳酸钙为球形;实验结果与徐焕焕等[32]采用复分解法,用豆腐废水调控制备出球形方解石碳酸钙的形貌相似,表明特定条件下制备的方解石碳酸钙并不完全是菱形。

图7 未加几丁质酶的碳酸钙红外谱图Fig.7 Infrared spectrum of calcium carbonate without chitinase
球霰石型碳酸钙的红外光谱特征吸收峰为876 cm−1和745 cm−1[4]。图8 是按0.01:1 酶钙质量比加入几丁质酶调控CaCl2碳化形成的碳酸钙红外光谱图,由图可知,在1456~1409 cm−1之间出现了较宽的分裂吸收峰,1089、874 cm−1和745 cm−1处也出现特征吸收峰,特征峰与马晓明等[23]在胃蛋白酶调控下水醇体系中用CaCl2和碳酸氢铵仿生合成的球霰石碳酸钙的红外特征吸收峰基本一致,也与王芬等[33]利用CO2碳化制备的球霰石型碳酸钙的红外特征峰基本吻合。图中1456~1409 cm−1之间的分裂吸收峰是球霰石型碳酸钙中C-O 键反对称伸缩振动吸收峰;1089、874 cm−1和745 cm−1分别是球霰石型碳酸钙中C-O 键的对称伸缩振动、面外弯曲振动和面内弯曲振动吸收峰。结果说明几丁质酶存在影响了Ca2+碳化形成的碳酸钙的晶型,可调控碳化形成的球霰石型碳酸钙,红外谱图表征结果与SEM 观测结果相一致。
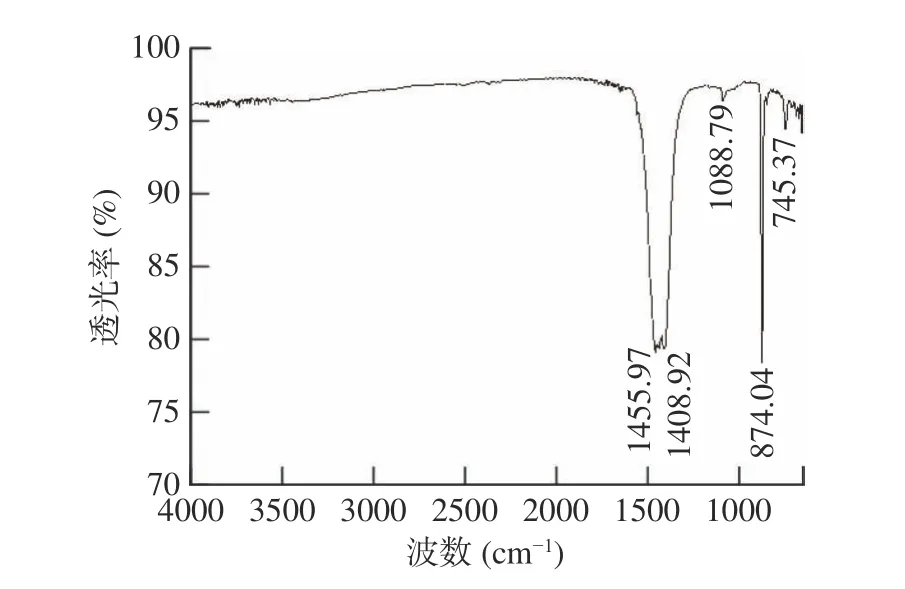
图8 加几丁质酶的碳酸钙红外谱图Fig.8 Infrared spectrum of calcium carbonate with chitinase
几丁质酶对碳酸钙晶型的调控机理应该与大部分蛋白质与氨基酸的调控机理类似,借助分子中的—COOH 实现,该基团在中性或碱性条件下解离成—COO-,与Ca2+发生静电和配位作用,提高体系局部Ca2+浓度,为碳酸钙结晶提供成核位点,降低成核活化能,调控球霰石型晶体形成[5,17]。目前报道的水体系中蛋白质调控制备的碳酸钙晶型基本以球霰石为主,且晶体中会夹杂有水分和蛋白质[17,22−23],但由图8 可见,几丁质酶调控制备的碳酸钙不仅未出现水分子H-O 键的伸缩振动峰,也没有出现蛋白质酰胺键的特征峰,说明几丁质酶虽调控碳酸钙晶型,但在晶体生长过程中确实没有夹杂入几丁质酶。
产品未夹杂几丁质酶可能是所用的几丁质酶虽含有较多天冬氨酸、谷氨酸等酸性氨基酸,等电点为5.2[26],在碳化体系下几丁质酶侧链酸性基团基本解离成负离子,加入少量即可与钙离子相互作用起到良好的晶型调控效果,但由于加入量少又可使结合在几丁质酶上的钙离子重新被置换碳化,从而防止碳化过程中的夹杂;故按0.01:1 酶钙质量比加入少量几丁质酶调控碳化,既可制出较纯的干燥的球霰石型碳酸钙。
3 结论
以CaCl2为原料碳化合成碳酸钙,以钙离子碳化率为指标,单因素考察了碳化温度、CaCl2浓度、pH、碳化时间和几丁质酶添加等五个因素对钙离子碳化率的影响,结果显示碳化温度、CaCl2浓度、pH、碳化时间等4 个因素对钙离子碳化率有显著性影响,但几丁质酶添加基本不影响钙离子的碳化率。采用正交试验对4 个显著影响因素进行优化,确定了最佳碳化工艺条件为:35 ℃下,以1 L/min 气体流速往pH 12.5 的1.00 mol/L CaCl2溶液持续通入CO2碳化6 min,钙离子碳化成碳酸钙可获最佳效果,碳化率达99.88%。极差分析与SPSS 统计分析均显示四个因素对碳化率的影响主次顺序为:碳化时间>pH>CaCl2浓度>碳化温度,四个因素对钙离子碳化率影响均具有显著性。
在优化工艺条件下,分别按0:1、0.002:1、0.004:1、0.01:1 的酶钙质量比往体系中加入不同量几丁质酶后,碳化制备碳酸钙,考察几丁质酶对碳酸钙晶型的调控。蛋白成分测定分析显示,碳化过程未夹入几丁质酶;SEM 和IR 等表征结果显示,未加几丁质酶时,碳化得到的是由球状颗粒和少部分菱形块状组装形成的直径为2 ~ 8 μm 的大小不一的方解石型碳酸钙微球;加入几丁质酶后,菱形块状形貌消失,且随着几丁质酶的添加比例增大,碳酸钙微球尺寸逐渐下降;当酶钙质量比为0.01:1 时,可制备得直径小于1 μm 的大小较均一的高纯度蓬松球霰石型碳酸钙微球。说明几丁质酶调控下可以改变碳酸钙的晶型与尺寸,是高产率高纯度碳化法制备球霰石型碳酸钙仿生合成的良好调控剂。

