酶解前后鹿筋体外抗炎活性与其氨基酸组成的相关性
郅 慧,兰 梦,尹馨雪,杨小倩,张 辉,*,李晶峰,*
(1.长春中医药大学吉林省人参科学研究院,吉林长春 130117;2.吉林省东北亚生物科技有限公司,吉林长春 130017)
鹿筋为鹿科动物梅花鹿(Cervus nipportTemminck)四肢的筋,性温,味淡微咸,具有壮筋骨、续劳损等功效,可用于治疗风湿关节疼痛、腰膝软弱等疾病[1−2]。鹿筋含有丰富的胶原蛋白、氨基酸,作为药食同源的名贵中药材,营养及药用价值极高,因而需要测定鹿筋的氨基酸种类及含量[3],目前已有一些文献对鹿筋的氨基酸组成及其含量进行了研究。
王晓通等[4]采用聚类分析的定性研究方法分析了鹿产品中17 种水解氨基酸的含量;庞博等[5]利用柱前衍生化法测定了鹿筋中氨基酸的含量。机体发生炎症反应主要是由于细胞炎症因子的过度释放,其中NO、IL-6 为典型的致炎因子,通过抑制细胞分泌致炎因子,可达到一定的抗炎效果[6−8],故抗炎功效与降低细胞炎症因子的含量水平密切相关。现代研究表明鹿筋蛋白具有抗炎、镇痛等作用,孙晓迪等[9]研究发现鹿筋胶原通过抑制炎性细胞因子IL-lβ和TNF-α的释放从而减轻小鼠的炎性反应。由于鹿筋胶原在抗炎方面表现出良好的活性,氨基酸作为构成胶原蛋白的基本单位,鹿筋酶解过程中氨基酸组成及含量的变化可能会影响抗炎活性,近几年的报道仅对鹿筋的氨基酸组成及含量进行了测定,并没有研究氨基酸组成及含量的变化与抗炎活性之间的关系,不能全面地评价酶解法对鹿筋品质特征的影响,因此本研究具有一定意义。
本研究筛选鹿筋天然蛋白(DSNP)和鹿筋酶解蛋白(DSEP)中对MH7A 细胞增殖抑制作用最强的活性组分,测定了活性组分的氨基酸组成、含量以及细胞炎症因子分泌量,结合多元统计分析[10−11],揭示其特征差异氨基酸,并筛选出潜在具有抗炎活性的氨基酸,初步探索鹿筋的药用价值与其氨基酸组成及含量变化的相关性,为鹿筋的进一步开发与应用提供了一定的参考依据。
1 材料与方法
1.1 材料与仪器
梅花鹿鹿筋 吉林省东鳌鹿业科技开发有限公司;类风湿性关节炎成纤维样滑膜细胞(MH7A) 广东吉尼欧生物技术公司;牛血清蛋白 上海源叶生物科技有限公司;噻唑蓝(MTT) 美国Amersco 公司;TNF-α北京索莱宝科技有限公司;NO、IL-6 试剂盒 长春百金生物科技有限公司;碱性蛋白酶(20000 U/mg) 上海宝曼生物科技有限公司;DMEM 高糖培养基 美国Hyclone 公司;其余试剂均为国产分析纯。
pH 计 北京赛多利斯科学仪器有限公司;1、3、10 kDa 超滤离心管 Millipore;680 型酶标仪日本TAKARA 公司;HERAEUS HERAcell 150 CO2培养箱 日本三洋公司;L-8900 型氨基酸自动分析仪 日本日立公司;Alpha1-2LDplus 冷冻干燥机德国CHRIST 冻干机有限公司。
1.2 实验方法
1.2.1 样品制备
1.2.1.1 DSNP 样品制备 称取5.0 g 鹿筋,剪碎成8 mm×8 mm 的小块,按料液比1:20 g/mL 溶于水中,于80 °C 下磁力搅拌8 h[12],过滤,微滤,滤液用超滤离心管进行超滤分级(1、3、10 kDa 超滤离心管),按不同分子量分为:DSNP 总提物、DSNP>10 kDa 组分、DSNP 3~10 kDa 组分、DSNP 1~3 kDa、DSNP<1 kDa, 依 次 命 名 为 DSNP-1、 DSNP-2、DSNP-3、DSNP-4、DSNP-5,−40 ℃真空冷冻干燥,制得冻干粉备用。
1.2.1.2 DSEP 样品制备 称取一定量的DSNP-1 冻干粉,加入一定量的水,超声溶解,选用碱性蛋白酶,经前期实验筛选,在酶解最适条件下(温度50 ℃、pH9.0、底物浓度3%、酶底比1%)酶解5 h,酶解后沸水浴加热15 min 灭酶,冷却至室温,3600 r/min 离心15 min 取上清液[13],超滤分级方法同“1.2.1.1”节,所获得组分依次命名为DSEP-1、DSEP-2、DSEP-3、DSEP-4、DSEP-5,−40 ℃冻干备用。
1.2.2 MH7A 细胞培养 MH7A 细胞接种于含10%胎牛血清的DMEM 高糖培养基中,于37 ℃、5%CO2的恒温培养箱中培养[14]。
1.2.3 DSNP 和DSEP 不同超滤组分对MH7A 细胞增殖抑制的影响 实验分别设置空白组、模型组、给药组,每组设置5 个复孔。选取对数生长期的细胞以5×104个/mL 接种于96 孔板中,每孔100 μL,5% CO2、37 ℃培养箱中培养24 h 后,除空白组(加DMEM高糖培养液)外,其余各组加入终浓度为60 ng/mL的TNF-α100 μL,继续培养24 h 后,给药组分别加入终浓度为50 μg/mL 的DSNP-1~DSNP-5 和DSEP-1~DSEP-5 溶液进行给药干预,培养24 h 后每孔加入20 μL MTT 溶液(5 mg/mL),继续培养4 h,弃上清液,加入150 μL DMSO,振荡10 min,酶标仪检测490 nm 波长处的吸光度OD 值,计算细胞增殖抑制率,实验独立重复3 次[15]。

1.2.4 不同质量浓度DSNP-5、DSEP-5 对MH7A 细胞增殖抑制的影响 按“1.2.4”项下方法,给药组分别加入25、50、100、200 μg/mL 的DSNP-5、DSEP-5 溶液100 μL,37 ℃、5% CO2培养24 h,每孔加入5 mg/mL 的MTT 溶液20 μL,培养4 h 后弃去上清,加入150 μLDMSO,振荡10 min,于490 nm 波长处测其OD 值,计算细胞增殖抑制率,实验独立重复3 次。
1.2.5 DSNP-5、DSEP-5 对MH7A 细 胞 释 放NO、IL-6 含量水平的影响 细胞给药培养24 h 后(分别加入50 μg/mL DSNP-1~DSNP-5 和DSEP-1~DSEP-5溶液,25、50、100、200 μg/mL 的DSNP-5、DSEP-5 溶液进行给药干预),吸取上清液,按照ELISA 试剂盒说明书检测NO、IL-6 的释放量,实验独立重复3 次[16]。
1.2.6 氨基酸含量的测定
1.2.6.1 检测样品制备 称取10 mg 鹿筋DSNP-5、DSEP-5 样品各6 份,分别加入10 mL 浓度为6 mol/L的盐酸溶液中,110 °C 水解24 h,用氨基酸分析仪进行测定[17]。
1.2.6.2 色谱条件 色谱柱:P/N 855-3507 色谱柱(4.6 mm×60 mm),分离柱内填料为3 μm 磺酸型阳离子交换树脂;柱温50 ℃;流速0.4 mL/min;进样量20 μL。
1.3 数据分析
测定的实验结果以±s表示,采用SPSS 25.0 软件进行数据的显著性分析,组间比较采用单因素方差分析和t检验。将得到的18 个氨基酸峰面积数据导入SIMCA-P14.0(Umetrics,Umea,Sweden)软件中进行多元统计分析。运用主成分分析(principal component analysis, PCA)、偏最小二乘法(partial least squares, PLS)、偏最小二乘法判别分析(partial least squares discriminant analysis, PLS-DA)和正交偏最小二乘法判别分析(orthogonalPLS-DA, OPLSDA)[18−20],找出酶解前后DSNP-5、DSEP-5 的差异氨基酸,采用灰色关联度(the grey relational degree analysis, GRA)和偏最小二乘法(partial least squares,PLS),筛选抑制MH7A 细胞分泌炎症因子的氨基酸。
2 结果与分析
2.1 DSNP 和DSEP 不同超滤组分对MH7A 细胞的增殖抑制作用
由表1 可知,与空白组相比,模型组能显著促进MH7A 细胞的增殖(P<0.05);在50 μg/mL 质量浓度下,给药组中DSNP-5、DSEP-5 对MH7A 细胞的增殖抑制作用最强,分别为56.99%、52.68%,与其他给药组相比具有显著性差异(P<0.05),故选择DSNP-5、DSEP-5 做进一步研究。

表1 不同超滤组分的DSNP 和DSEP 对MH7A 细胞的增殖抑制作用Table 1 Inhibitory effect of different ultrafiltration fractions DSNP and DSEP on the proliferation of MH7A cells
2.2 不同质量浓度DSNP-5、DSEP-5 对MH7A 细胞的增殖抑制作用
由表2 可知,TNF-α诱导剂能显著促进MH7A细胞的增殖(P<0.05),在25~200 μg/mL 质量浓度范围内,随着DSNP-5、DSEP-5 质量浓度的增加,细胞增殖抑制率呈现向上升后下降的趋势,当质量浓度为100 μg/mL 时,DSNP-5、DSEP-5 对MH7A 细胞增殖抑制作用最强,与其他给药组相比具有显著性差异(P<0.05),在25~200 μg/mL 质量浓度范围内,与DSEP-5 组相比,DSNP-5 抑制MH7A 细胞增殖的能力更强,具有显著性差异(P<0.05)。

表2 不同质量浓度的DSNP-5、DSEP-5 对MH7A 细胞的增殖抑制作用Table 2 Inhibitory effects of different concentrations of DSNP-5 and DSEP-5 on the proliferation of MH7A cells
结果表明,不同质量浓度的DSNP-5、DSEP-5 均可不同程度的抑制MH7A 细胞增殖,在质量浓度为100 μg/mL 时,对MH7A 细胞的增殖抑制作用最强,抑制率分别为77.60%、68.03%。
2.3 DSNP-5、DSMP-5 对MH7A 细胞NO、IL-6 分泌量的影响
2.3.1 对MH7A 细胞释放NO 的影响 NO 是炎症反应发生的重要介质,在炎症反应的发展与归转中起着多种作用,具有代表性意义,过度释放NO,会引发炎症,造成组织损伤[21]。由图1 可知,与空白组相比,模型组可以显著诱导MH7A 细胞分泌NO(P<0.05);随着样品质量浓度的增加,NO 的分泌量呈现先下降后上升的趋势,其中,当质量浓度达到100 μg/mL时,NO 分泌量达到最低,显著低于其他给药组(P<0.05),抑制作用最强,与DSEP-5 相比,DSNP-5 抑制MH7A 细胞释放NO 的能力更强(P<0.05)。

图1 DSNP-5、DSEP-5 对MH7A 细胞NO 分泌量的影响Fig.1 Effects of DSNP-5 and DSEP-5 on NO secretion of MH7A cells
2.3.2 对MH7A 细胞释放IL-6 的影响 IL-6 作为刺激因子,在炎症反应过程中扮演重要角色[22],由图2 可知,与空白组相比,TNF-α模型组可以显著诱导MH7A 细胞分泌IL-6(P<0.05);与TNF-α模型组相比,质量浓度在25~200 μg/mL 范围内,各剂量组均可不同程度地下调IL-6 的含量水平,有显著性差异(P<0.05),当质量浓度达到100 μg/mL 时,IL-6 的分泌量达到最低,显著低于其他给药组(P<0.05),效果最佳,与DSEP-5 相比,DSNP-5 抑制MH7A 细胞释放IL-6 的能力更强(P<0.05)。

图2 DSNP-5、DSEP-5 对MH7A 细胞IL-6 分泌量的影响Fig.2 Effects of DSNP-5 and DSEP-5 on IL-6 secretion in MH7A cells
结果表明DSNP-5、DSEP-5 能抑制MH7A 细胞炎症因子的释放,在质量浓度为100 μg/mL 时,炎症因子NO、IL-6 释放量达到最低,效果最显著。由此推测DSNP-5、DSEP-5 可能通过抑制炎症因子(NO、IL-6)的释放,减缓细胞炎症反应,从而达到抗炎的效果。同时DSNP-5、DSEP-5 对炎症因子NO、IL-6 抑制的最佳浓度(100 μg/mL)与对细胞增殖抑制率的最佳浓度(100 μg/mL)一致,推测可能是由于DSNP-5、DSEP-5 抑制MH7A 细胞释放两种炎症因子NO、IL-6,降低炎症因子含量水平,从而抑制了MH7A 细胞的增殖。与DSEP-5 相比,DSNP-5 对细胞增殖及细胞炎症因子分泌的抑制能力更强,具有显著性差异(P<0.05),推测酶解过程中可能使蛋白质的结构或成分发生了变化从而降低了生物活性。
2.4 DSNP-5 和DSEP-5 氨基酸的组成与含量
DSNP-5、DSEP-5(每组样品数量n=6)的氨基酸种类和含量测定结果见表3。从表3 中可以看出,DSNP-5、DSEP-5 均含有18 种氨基酸,说明酶解前后的氨基酸组成基本一致,但含量有所差异。甘氨酸的含量是DSNP-5、DSEP-5 氨基酸总含量中占比最高的,分别为31.01%、28.91%,且DSNP-5 的甘氨酸含量高于DSEP-5 的甘氨酸含量,据文献报道甘氨酸与炎症密切关联[23−24],当LPS 刺激机体时,炎症模型中甘氨酸合成减少、含量下降,抗炎的作用机制可能是与受体特异性结合或抑制炎症细胞因子的合成与分泌,由此推测甘氨酸含量的高低与鹿筋蛋白的抗炎效果有一定的关系。
表3 DSNP-5、DSEP-5 的氨基酸组成及含量( ±s,n=3)Table 3 Aminoacid composition and content of DSNP-5 and DSEP-5(±s,n=3)

表3 DSNP-5、DSEP-5 的氨基酸组成及含量( ±s,n=3)Table 3 Aminoacid composition and content of DSNP-5 and DSEP-5(±s,n=3)
注:*:表示必需氨基酸。
氨基酸种类 DSNP-5(%) 氨基酸种类 DSEP-5(%)天冬氨酸(Asp) 5.27±0.033g 天冬氨酸(Asp) 4.76±0.025g苏氨酸(Thr)* 2.01±0.024l 苏氨酸(Thr)* 1.95±0.016m丝氨酸(Ser) 4.35±0.011h 丝氨酸(Ser) 4.65±0.019h谷氨酸(Glu) 8.57±0.017d 谷氨酸(Glu) 8.74±0.024d甘氨酸(Gly) 31.01±0.013a 甘氨酸(Gly) 28.91±0.018a丙氨酸(Ala) 10.63±0.028b 丙氨酸(Ala) 12.00±0.014b半胱氨酸(Cys) 2.64±0.026k 半胱氨酸(Cys) 2.74±0.013k缬氨酸(Val)* 1.32±0.015o 缬氨酸(Val)* 1.92±0.026n蛋氨酸(Met)* 0.60±0.023q 蛋氨酸(Met)* 0.67±0.020q异亮氨酸(Ile)* 1.45±0.011n 异亮氨酸(Ile)* 1.39±0.010p亮氨酸(Leu)* 2.91±0.019j 亮氨酸(Leu)* 2.82±0.025j酪氨酸(Tyr) 0.39±0.014r 酪氨酸(Tyr) 0.29±0.022r苯丙氨酸(Phe)* 1.78±0.020m 苯丙氨酸(Phe)* 2.04±0.017l赖氨酸(Lys)* 3.34±0.012i 赖氨酸(Lys)* 3.73±0.034i组氨酸(His) 1.24±0.016p 组氨酸(His) 1.54±0.019o精氨酸(Arg) 5.67±0.017f 精氨酸(Arg) 6.10±0.011f脯氨酸(Pro) 10.20±0.031c 脯氨酸(Pro) 9.27±0.021c羟脯氨酸(Hyp) 6.62±0.020e 羟脯氨酸(Hyp) 6.48±0.027e必需氨基酸 13.41 必需氨基酸 14.52总和 100.00 总和 100.00
2.5 DSNP-5 和DSEP-5 的氨基酸多元统计分析
采用PCA 分析法对DSNP-5、DSEP-5 所含氨基酸进行分析,所得结果见图3。从图3 中可以看出,PCA 法可以将DSNP-5 和DSEP-5 分开,二者存在一定差异,推测可能是由于酶解过程中肽键的断裂造成了氨基酸含量的变化。进一步采用OPLS-DA分析,而OPLS-DA 分析的基础为PLS 模型的验证,采用排列实验对模型进行验证,在PLS-DA 模型参数中R2和Q2分别表示对数据的解释程度和对模型的预测能力,从图4 中可以看出,PLS-DA 模型排列实验中左端任何一次随机变量y变量产生的R2、Q2值均小于右端的原始值,表明模型有效(R2=0.443,Q2=−0.53)。
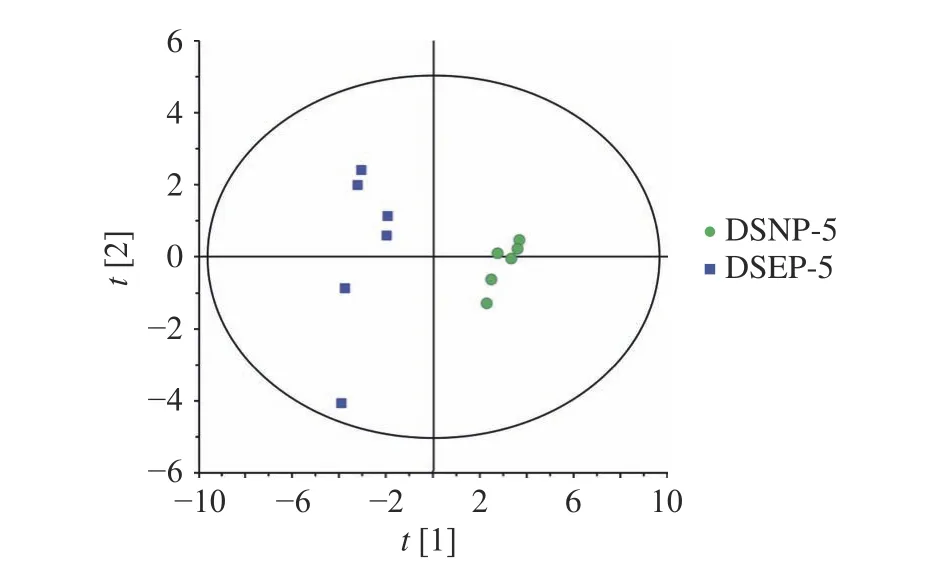
图3 鹿筋DSNP-5 及DSEP-5 的PCA 分析散点图Fig.3 PCA analysis of DSNP-5 and DSEP-5 for deer sinew
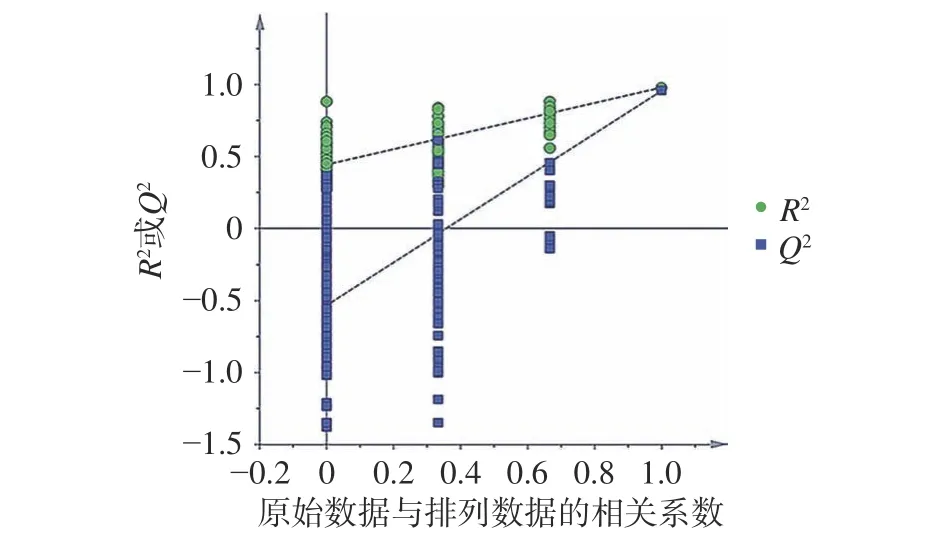
图4 鹿筋DSNP-5 及DSEP-5 的PLS-DA 模型图Fig.4 PLS-DA model diagram of DSNP-5 and DSEP-5 of deer sinew
OPLS-DA 分析散点图见图5,OPLS-DA 分析可以最大程度地将DSNP-5、DSEP-5 分离,并且降低样本的组内差异,更准确地找出二者之间的差异氨基酸。由OPLS-DA 分析得到DSNP-5、DSEP-5 的VIP 值见表4,选取VIP>1,表示其差异性贡献率大于其他组分,找出酶解前后DSNP-5、DSEP-5 所含的差异氨基酸分别是Phe、Asp、Pro、Arg、Lys、Gly、Glu、Cys、Ala 和Hyp。

表4 DSNP-5、DSEP-5 组分基于OPLS-DA 分析的VIP 值Table 4 VIP results of DSNP-5 and DSEP-5 components based on OPLS-DA analysis

图5 鹿筋DSNP-5 及DSEP-5 的OPLS-DA 分析散点图Fig.5 OPLS-DA of DSNP-5 and DSEP-5 analyzed scatter plots
通过PCA 分析得到了酶解前后DSNP-5、DSEP-5中的特征差异氨基酸,但未能筛选出抑制MH7A 细胞活性的氨基酸。故本研究以抑制MH7A 细胞炎症因子(NO、IL-6)释放量作为活性指标,应用灰色关联度(GRA)分析和偏最小二乘法(PLS)筛选出鹿筋抑制MH7A 细胞分泌NO、IL-6 细胞炎症因子的氨基酸。
灰色关联分析的目的是确定参考序列和若干个比较序列之间的关联系数和关联度,寻求系统中各个因素间的主要关系[25]。使用EXCEL 对实验数据进行灰色关联分析,将DSNP-5、DSEP-5 的氨基酸含量Xi(自变量)设为比较数列(子序列);MH7A 分泌的炎症因子(NO、IL-6)的含量Xo(因变量)设为参考序列(母序列),将对应的数据输入到EXCEL 表中,进行灰色关联分析,得到各个氨基酸对抑制MH7A炎症因子分泌活性的贡献程度排名:Lys>Phe>Ser>Arg>Ala>Met>Glu>Leu>Cys>Ile>Val>Thr>His>Gly>Pro>Asp>Hyp>Tyr(NO);Lys>Arg>Leu>Glu>Ala>Ser>Phe>Ile>Thr>Gly>Cys>Met>Pro>Asp>Hyp>Val>His>Tyr(IL-6)。关联度>0.7 时,认为子序列与母序列之间存在一定关联性,结果表明(见表5),Lys、Phe、Ser、Arg、Ala、Met、Glu、Leu、Cys、Ile、Val、Thr、Gly 与抑制NO、IL-6 含量水平相关,由此可以看出DSNP-5、DSEP-5 抑制MH7A 分泌炎症因子活性是多种氨基酸共同作用的结果。

表5 DSNP-5、DSEP-5 的氨基酸含量与抗炎指标的关联序和关联度Table 5 Correlation order and correlation degree of amino acid content andanti-inflammatory index of DSNP-5 and DSEP-5
偏最小二乘回归法是一种能广泛使用的多元统计分析方法,该方法集多元线性回归分析、主成分分析、典型相关分析基本功能于一体,与其他统计方法相比,具有计算简单、建模效果好、解释性强、预测性较高等优点[26−27]。利用SIMCA-P14.1 软件,经过多次提取主成分,多次迭代,拟合出酶解前后DSNP-5、DSEP-5 的氨基酸含量与抑制MH7A 细胞炎症因子NO、IL-6 分泌活性数据之间的数理方程:Y=−0.11230XAsp−0.06724XThr−0.11420XSer+0.0319 6XGlu−0.10012XGly+0.07324XAla+0.05723XCys+0.01513XMet−0.10235XIle+0.0061XLeu−0.00608X Tyr+0.07580XPhe+0.12093XLys+0.03706XVal+0.12401XHis+0.07391XArg−0.07735XPro−0.02773 XHyp (NO);Y=−0.12345XAsp−0.12381XThr+0.04279 XSer−0.00482XGlu−0.08449XGly+0.09871XAla−0.04969XCys+0.01149XMet−0.11810XIle−0.11237 XLeu−0.04932XTyr+0.07780XPhe+0.08740XLys+0.17387XVal+0.13180XHis+0.07661XArg−0.09188 XPro−0.01731XHyp(IL-6)(XAsp~XHyp 为氨基酸含量丰度,Y 为酶解前后鹿筋抑制MH7A 细胞释放炎症因子NO、IL-6 的活性)。
相关系数的绝对值大小反映对MH7A 细胞炎症因子NO、IL-6 分泌活性抑制的贡献程度,绝对值越大,贡献程度越大,相关系数的符号反映与抑制MH7A 细胞炎症因子NO、IL-6 分泌活性的相关性[28],由于炎症因子释放量与药效呈负相关,故相关系数为负值的氨基酸是对药效的贡献氨基酸。各氨基酸对抑制MH7A 细胞炎症因子NO 分泌活性贡献绝对值大小顺序为:His>Lys>Ser>Asp>Ile>Gly>Pro>Phe>Arg>Ala>Thr>Cys>Val>Glu>Hyp>Met>Leu>Tyr,其中Asp、Thr、Gly、Ile、Tyr、Pro、Hyp 与活性呈负相关,各氨基酸对抑制MH7A 细胞炎症因子IL-6 分泌活性贡献绝对值大小顺序为:Val>His>Thr>Asp>Ile>Leu>Ala>Pro>Lys>Gly>Phe>Arg>Cys>Tyr>Ser>Hyp>Met>Glu,其中Asp、Thr、Glu、Gly、Cys、Ile、Leu、Tyr、Pro、Hyp 与活性呈负相关,相关系数见表6。

表6 DSNP-5、DSEP-5 的氨基酸含量与抗炎指标的相关系数Table 6 Correlation coefficient of amino acid content andantiinflammatory index of DSNP-5 and DSEP-5
综合三种分析方法,多元统计分析VIP 值>1,灰色相关度>0.7,与活性呈负相关的特征性氨基酸为Gly。
3 结论
本实验研究发现DSNP-5、DSEP-5 在体外抗炎实验中表现出较强的增殖抑制活性,能够抑制MH7A 细胞分泌炎症因子(NO、IL-6),与DSEP-5 相比,DSNP-5 对细胞增殖及细胞炎症因子分泌的抑制能力更强,具有显著性差异(P<0.05)。将多元统计分析筛选出的特征差异氨基酸(VIP 值>1)、PLS(相关系数>0.7)、GRA(活性呈负相关)结果相结合,分析得到Gly 是特征差异性成分。DSNP-5 的Gly 含量(31.01%)高于DSEP-5 的Gly 含量(28.91%),Gly 参与了许多重要生理活性分子的合成,具有抗炎、免疫调节的作用,可通过抑制炎症因子的分泌来降低炎症损伤[29−30],而在相同浓度下,DSNP-5 较DSEP-5 抗炎效果好,可能是由于DSNP-5 所含的Gly 含量更高,具有更好的抗炎效果,但是DSNP-5 中的Gly 含量的高低与DSNP-5 抑制MH7A 细胞分泌活性的能力强弱的内在关系尚不清楚,需要进一步研究。

