基于网络药理学研究青风藤治疗高尿酸血症作用机制※
高忠林 权浩浩 张晓凤 程小红
(陕西中医药大学2019级硕士研究生,陕西 咸阳 712000)
高尿酸血症(hyperuricemia,HUA)是一种常见的生化异常,由尿酸盐生成过多或(和)肾脏尿酸排泄减少,或者两者共同存在而引起的[1]。根据其发病机制的差异分为原发性HUA和继发性HUA,原发性HUA多由基因突变引起,属遗传病;继发性HUA常由肾脏病、药物、血液病等引发。随着人们生活水平的提高和饮食结构的改变,HUA发病率呈逐年上升趋势[2],据统计高达21%的人群和25%的住院患者有无症状HUA[3]。因此,降低血清尿酸值是临床上常用的防治HUA措施[4]。常用药物分为促尿酸排泄药(如丙磺舒)、抑制尿酸生成药(如黄嘌呤氧化酶抑制剂)、碱化尿液药(如碳酸氢钠片)和尿酸酶合成剂(如拉布立酶)4类[5]。这4类药物广泛应用于临床,其降尿酸效果显著,疗效确切[6],得到普遍认可。但长期服用此类降尿酸药易出现斑丘疹、脱发、胃肠道反应及肾脏毒性等副作用[7-8]。
中医学并无HUA病名,由于无症状型HUA可演变为痛风,故经典文献多将其归为“痹证”“痛风”“白虎历节”等范畴[9]。历代医家认为,HUA的发生与后天饮食不节、年老体弱、脏腑不调及先天禀赋不足有关。病机为嗜食海鲜肥甘、辛辣煎炸之品易蕴湿生热,又逢先天体质虚弱,外感风、寒、湿、热邪气,致脾胃运化失司,水湿停留,郁久化热,酿结成毒,湿热浊毒阻塞经脉、血络而发病[10]。王先敏等[11]通过临床大数据分析得出,HUA主要分为水湿内停、湿热、痰浊阻滞、血瘀、气阴不足、脾气亏虚、肾阳不足7个证型,其中以水湿停留、湿热最为常见。中医理论的“湿”相当于现代医学概念中的“尿酸”[12]。治疗上以清热化湿、解毒化浊为主[13]。由于HUA早期仅表现为尿酸值异常升高,可无任何临床症状,易忽略血清尿酸等辅助检查。如能在无症状HUA期间结合患者的尿酸值辨证论治,就有可能延缓甚至遏制HUA向痛风的转变,体现中医“未病先防,既病防变”特色。杜敏等[14]临床观察证实,“治未病”理论管理HUA患者取得显著疗效,血尿酸等相关指标明显下降,疾病得到有效控制,临床实用价值极高,极大体现了中医优势。
青风藤原名清风藤,首载于宋《图经本草》。其味苦、辛,性平,入肝、脾经,具有祛风除湿、疏通经络、通利小便之效。Zhao Z J等[15]通过小鼠模型的体外和体内实验发现,青风藤提取物青藤碱(Sinomenine)抗炎和渗透作用较其他化合物及衍生物强,这为青风藤综合治疗高尿酸引发炎性反应提供了基础研究依据。此外,郝赛恒等[16]也经动物实验证实,青风藤复方颗粒(该药的主要成分是青风藤)具有显著降尿酸作用。以上基础研究提示,青风藤有良好的抗炎和降尿酸作用,但其具体作用机制尚未阐明。借助网络药理学预测青风藤治疗HUA的作用机制具有重要的临床意义。网络药理学从药物与疾病间相互作用的系统性和整体性出发,运用计算机虚拟筛选潜在药效成分、作用靶标及通路,构建“药物-靶标-疾病”多维网络联系,初步预测出药物作用机制[17],符合中医的“整体观念”和“辨证论治”特色。因此,本研究基于网络药理学预测青风藤治疗HUA的作用机制,结果如下。
1 资料与方法
1.1 青风藤的活性成分及作用靶标的筛选和获得 分别于中药系统药理学数据库与分析平台(TCMSP)和中药综合数据库(TCMID)数据库输入“青风藤”,以口服生物利用度(oral bioavailability,OB)≥30%、类药性(drug-likeness,DL)≥0.18为筛选条件,查找青风藤的活性成分并查阅相关文献进行验证[18]。依次使用TCMSP、瑞士靶标预测数据库(Swiss Target Prediction)和中药分子机制的生物信息学分析工具(BATMAN-TCM)收集青风藤的作用靶标。
1.2 HUA相关基因收集 分别于疗效药靶标数据库(TTD)、药物数据库(Drug Bank)、疾病相关的基因与突变位点数据库(Dis Ge NET)和人类基因数据库(Gene cards)以“Hyperuricemia”“Gout”为关键词检索HUA相关基因。
1.3 靶标映射 将1.1获取的青风藤候选作用靶标和1.2收集的HUA相关基因分别导入绘图软件Venny 2.1中进行靶标映射。Venny 2.1用于展示在不同的事物集合之间的逻辑联系,尤其适用于表示集合之间的关系。
1.4 生物学过程与通路富集分析 将靶标映射所获取的基因以P<0.05为筛选条件分别借助基迪奥生物信息云平台(Omicshare)、生物信息学资源数据库(DAVID)进行GO和KEGG通路富集分析。DAVID是生物信息数据库,整合生物学数据并进行分析。为大规模的基因或蛋白列表提供系统综合的生物功能注释信息,用于差异基因功能和通路富集分析。
1.5 成分-靶标-通路多维生物网络的构建及分析 将筛选出的青风藤与HUA共同靶标导入Cytoscape 3.2.1软件,构建成分-靶标-信号通路多维生物网络。Cytoscape是一款图形化显示网络并进行分析和编辑的软件。
2 结果
2.1 青风藤活性成分 TCMSP数据库共查到青风藤有16个活性成分,其中以OB≥30%,DL≥0.18为限定条件,共得到6个活性成分,TCMID共获得45个作用成分。将这2个数据库汇总去重复值并查阅相关文献进行验证[18],最后筛选出26个活性成分。见表1。

表1 青风藤活性成分
2.2 青风藤作用靶标 TCMSP收集到5HT2A、ADA1A、ADA1B等360个青风藤作用靶标,Swiss Target Prediction收集到RORC、SREBF2、AR等390个作用靶标,BATMAN-TCM收集到VDR、CYP27B1、GC等301个靶标。将其汇总去重复值共得到499个靶标。
2.3 HUA相关基因的获得 TTD得到XDH和URAT1共2个基因,Drug Bank得到ALB、FABPI、AOX等共29个基因,Dis Ge NET得到XDH、ABCG2、SLC2A9等共196个基因,Gene cards得到UMOD、SARS2、HPRT1等共625个基因,最后归纳汇总删除重复值后共得到744个HUA相关基因。
2.4 青风藤与HUA共同靶标映射分析 将筛选出青风藤和HUA靶标进行映射共得到基因CYP27B1、MED1、BAX等58个基因。见图1。

图1 青风藤与HUA共同靶标映射图
2.5 青风藤与HUA共同靶标的生物学过程与通路富集分析 借助DAVID数据库进行GO和KEGG通路富集分析,其中GO富集分析包括生物过程(biological process,BP)、细胞组成(cellular component,CC)、分子功能(molecular function,MF)3个部分,BP有positive regulation of transcription from RNA polymerase Ⅱ promote、response to drug、negative regulation of cell proliferation等79个条目,CC有cytoplasm、plasma membrane、mitochondrion等26个条目,MF有protein homodimerization activity,identical protein binding,heme binding等22个相关的条目。其中涉及的BP包括腺苷酸环化酶激活多巴胺受体信号通路、调控炎症反应、抑制细胞增殖等,CC包括细胞质、质膜、线粒体等,MF包括黄素腺嘌呤二核苷酸结合、花生四烯酸环氧酶活性、Ras鸟苷核苷酸交换因子活性等。以“Count”从大到小依次排列,取文献和临床报道较多的生物学过程进行可视化处理(见图2)。KEGG通路分析对涉及的58个青风藤与HUA共同靶标的信号通路中的作用进行了筛选,得到了PI3K-Akt signaling pathway、Serotonergic synapse、Dopaminergic synapse等38条信号通路。以“Count”从大到小依次排列,取前10条通路进行可视化处理(见图3)。

图2 GO富集分析图
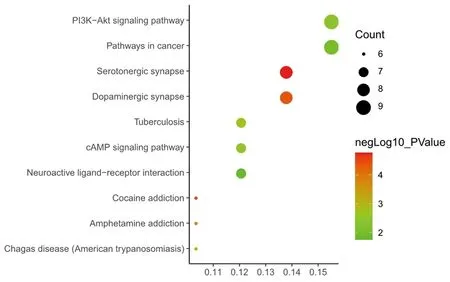
图3 KEGG通路分析图
2.6 成分-靶标-通路网络图构建结果与分析 利用Cytoscape 3.2.1软件,建立“青风藤—成分—基因—通路”图(见图4),图中清晰地表现了58个青风藤与HUA共同靶标分布于不同的通路,体现了青风藤对HUA的治疗机制。图中共有84个节点,131条边。面积的大小是根据成分、靶标和通路节点和边数目依次分布,图中面积越大青风藤与HUA的成分靶标以及通路连线节点数目越密集,同时为保证青风藤治疗HUA的作用靶标及机制预测的相对客观、全面,结合查阅相关实验文献,初步预测出青风藤的作用成分可能是Sinomenine(青藤碱),有效靶标可能是次黄嘌呤-鸟嘌呤磷酸核糖转移酶(HPRT1)和前列腺素内过氧化物合酶2(PTGS2),作用通路可能是PI3K- Akt signaling pathwa(磷脂酰肌醇-3-激酶/丝苏氨酸蛋白激酶通路)和cAMP signaling pathway(环磷酸腺苷通路)。

图4 成分-靶标-通路网络图
3 讨论
临床研究发现,HUA不仅可以进展为痛风,而且还可引发糖尿病、冠状动脉粥样硬化性心脏病、原发性高血压等疾病,已成为我国第二大代谢性疾病,严重威胁人们健康[19]。青风藤治疗HUA疗效确切[16],但具体机制尚不明确。本研究借助网络药理学手段,获取其治疗HUA主要成分及相关的疾病基因,然后进行GO和KEGG富集分析预测青风藤治疗HUA的作用机制。
本研究通过Cytoscape 3.2.1软件共筛选出Sinomenine、beta-sitosterol、syringaresinol、Michelenolide等13个青风藤主要成分。Cabau G等[20]临床研究证实,HUA与多种常见的成人炎性疾病有关。Wang Lan等[21]研究发现,青风藤主要成分Sinomenine、magnoflorine、menisperine和stepharanine是主要抗炎化合物,其中Sinomenine报道最多。Xu W等[22]研究证明,Sinomenine对类风湿关节炎患者外周血单核细胞增殖、细胞因子产生均有抑制作用。Zhu Q等[23]经动物实验证实,不同剂量的Sinomenine均具有抗炎、镇痛和抗过敏作用。Qian L等[24]也发现,Sinomenine可通过抑制小胶质细胞烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶活性治疗炎症介导的神经退行性疾病。因此,Sinomenine可通过抑制炎性反应而发挥治疗成年人HUA的作用。
通过青风藤与HUA共同靶标进行映射得到基因CYP27B1、MED1、BAX、HPRT1和PTGS2等共58个基因,其中HPRT1和PTGS2参与了HUA的关键环节。HUA由尿酸产量增加或排泄减少所致[4],Li L等[25]研究发现,HPRT可以改善内源性嘌呤的产生,进而减少尿酸的过量产生和积累。此外,HUA最常见的并发症是痛风。Mishima E等[26]临床研究发现,即使没有神经系统症状,HPRT缺乏也是家族性青少年痛风的潜在原因。Cheng M H等[27]研究表明治疗痛风的代表性药物丙磺舒可通过抑制PTGS2(也称COX-2)和PI3K- Akt途径抑制活性氧(ROS)的产生并发挥抗破骨细胞活性。从上分析可得出HPRT基因部分缺乏可导致尿酸生成过量,PTGS2基因则主要参与了抑制痛风的重要环节。
GO和KEGG富集分析表明,青风藤治疗HUA的通路是PI3K- Akt signaling pathway和cAMP signaling pathway。Wang C等[28]研究也证明,硫氧还蛋白(Trx)调节炎症细胞的激活和迁移作用与cAMP-PKA通路和PI3K-Akt通路有关。Balakumar P等[29]研究发现,PI3K- Akt通路与肾性HUA密切相关。Chen C等[30]通过曲霉菌素(AST)干预骨关节炎(OA)大鼠模型发现,AST可以通过下调PI3K- Akt信号通路发挥抗炎作用,进而改善OA症状。Li K等[31]研究证明,罗替戈汀缓释微球(RTGT-MS)对炎性疼痛模型大鼠的保护作用与降低cAMP、COX-2和前列腺素E2(PGE2)含量有关。以上研究显示,PI3K- Akt通路和cAMP通路在降尿酸、抗炎和镇痛中发挥着作用。
综上所述,本研究初步预测青风藤治疗HUA的作用机制可能是Sinomenine通过作用于HPRT1和PTGS2关键靶标调控PI3K-Akt和cAMP信号通路,进而发挥减少尿酸生成、抑制炎性反应和保护肾脏。在临床和基础研究中均未找到青风藤活性成分14-methylhexadecanoicacid Michelenolide和sinalbin治疗HUA的证据,此方面研究空白可为医学工作者提供思路。下一步将对Sinomenine的HPRT1和PTGS2基因开展基础和临床研究,为明确青风藤治疗HUA的作用靶标和机制提供实验证据。

