肿瘤患者数字荧光分子杂交技术基因检测复测原因分析
白羽,马旭,张艳华
·技术与方法·
肿瘤患者数字荧光分子杂交技术基因检测复测原因分析
白羽,马旭,张艳华
100142 北京大学肿瘤医院暨北京市肿瘤防治研究所药剂科,恶性肿瘤发病机制及转化研究教育部重点实验室
药物基因组学(pharmacogenomics,PGx)是基于人类遗传多样性,在药物治疗中具有预测药物疗效和不良反应的作用。通过检测特定的 PGx 生物标志物,临床医生能够更好地预测哪些患者可能发生严重不良反应和(或)疗效不佳治疗,为医生临床决策提供参考依据[1-3]。对于多数基因检测研究,研究者多采用聚合酶链式反应(polymerase chain reaction,PCR)联合 Sanger 法或焦磷酸对药物代谢酶或药物作用靶点进行单核苷酸多态性(single nucleotide polymorphism,SNP)检测[4]。但是进行 PCR 对实验室要求较高,需要相应的实验室资质和认证。此外,传统的测序技术存在着处理量低、成本高、操作困难等缺点,限制了其在实验室诊断中的广泛应用[5]。然而杂交测序不需要高通量测序,也不受 PCR 实验室条件的限制,数字荧光分子杂交技术(digital fluorescence molecular hybridization,DFMH)是基于荧光原位杂交技术(fluorescence in situ hybridization,FISH)发展起来的一种新技术。荧光团偶联特异的脱氧核糖核酸(DNA)作为探针杂交到互补序列上。FISH 探针的设计包括两个荧光团,一个作用于染色体靶区特定的 SNP,另一个作用于同源染色体的特定 SNP,其分别对两个染色体进行差异性标记,通过荧光检测系统进行分析[6]。目前国内大部分医院采用 DFMH 进行 SNP 检测。
DFMH 进行 SNP 检测过程中需要收集白细胞,部分患者会因出现信号低或峰型差而进行复测。目前国内外尚无复测原因分析文献,而我院属于肿瘤专科医院,发现进行标准的放化疗等肿瘤常规治疗方案后会导致骨髓抑制,降低白细胞数量,因此本研究旨在探索患者体内白细胞水平或患者基本特征是否是导致 DFMH 复测的原因。
1 材料与方法
1.1 材料
1.1.1 病例收集 收集 2015 年 4 月 – 2019 年 6 月在我院接受药物代谢酶 SNP 检测的患者。筛选因检测信号低或峰型差难以判断基因型的患者。回顾性收集患者在基因检测前后 5 日内的白细胞计数结果,若在 5 日内未进行白细胞检测则不纳入研究。患者基本信息缺失的也不纳入研究。
1.1.2 试剂与仪器 核酸纯化试剂、NH4Cl 预处理液、测序反应通用试剂盒均为北京华夏时代基因科技发展有限公司产品。D2012 离心机购自美国 Scilogex 公司;L988A 荧光检测仪购自西安天隆科技有限公司。
1.2 方法
在 1.5 ml 离心管中加入 1.2 ml 1 × NH4Cl 预处理液,取 200 μl 全血加入到 1 × NH4Cl 预处理液中。上下颠倒 10 次,室温下静置 5 min。将静置后的离心管放入离心机中,室温下 3000 r/min 离心 5 min,将上层透明红色液体吸取干净,注意避免吸走管底的白细胞。再向离心管中加入1 ml 1 × NH4Cl 重悬白细胞,室温下 3000 r/min 离心 5 min,将上层液体吸取干净。向富集有白细胞的离心管中加入 50 μl 核酸纯化试剂,反复吹打混匀。
根据需检测的基因位点,取出相对应的测序反应通用试剂盒,向相应的试剂盒中加入 1.5 μl 处理后的白细胞样本混匀后上机检测。
1.3 统计学处理
2 结果
2.1 一般资料
2015 年 4 月 – 2019 年 6 月,我院共检测患者3713 例,其中需要复测的患者有 225 例,占总病例数的 6.03%。其中 12 例患者无相关白细胞计数检测结果,20 例患者因门诊就诊无住院病历信息,未能采集患者相关信息。最终 193 例患者纳入本次研究,其中需复测位点数 230 个,涉及纯合型基因型 109 个(47.39%),杂合型基因型 121 个(52.61%)。患者一般资料见表 1。
2.2 基因位点复测情况
193 例患者中总共复测基因位点 230 个,其中复测次数最多的基因为ABCB1,共复测 68 次,占复测总数的 29.57%。其次为MTHFR 和GSTP1基因,分别复测 36 和 35 次,占复测总数的15.65% 和 15.22%。具体基因位点复测情况见表 2。
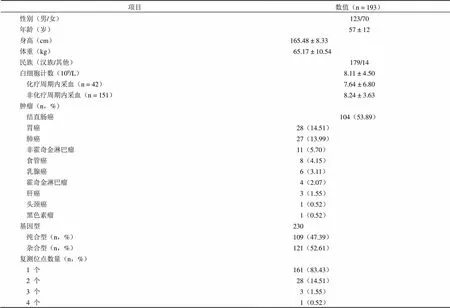
表1 患者的一般资料

表2 基因位点复测情况统计

表3 基因检测复测情况与患者基本特征的关系
2.3 基因检测复测情况与患者基本特征的关系
根据患者复测位点个数及复测原因进行分组。①按位点数:需复测一个位点的共 161 例患者,复测位点数≥ 2 的共 32 例患者;②按复测原因:由于检测信号低需要复测的患者共 171 例,由于检测峰型不好,无法判断具体基因型的患者共 22 例。根据患者的基本情况如性别、年龄、身高、体重、白细胞计数、基因型和癌种进行考察。根据复测位点个数分组,未发现其与患者基本特征的相关性;而根据复测原因分组,在肝癌患者中,峰型异常的发生率较信号低的发生率高,差异具有统计学意义(= 0.03);男性患者多因峰型异常而复测,女性患者多因信号低而复测,但无统计学差异(= 0.06),其他各组均未发现统计学差异。基因检测复测情况与患者基本特征的相关性见表 3。
2.4 基因检测复测位点个数与复测原因的相关性
根据患者的复测位点个数与复测原因进行分析,但各组间均没有统计学差异。具体情况见表 4。

表4 基因检测复测位点个数与复测原因的相关性
2.5 不同采血时间白细胞计数与基因检测复测原因的相关性
根据不同的采血时间分组,分为化疗周期内采血及非化疗周期内采血,复测位点数 N ≥ 2 中,化疗周期内采血白细胞计数为(5.67 ± 3.27)× 109/L,较非化疗周期内采血低,差异具有统计学意义(= 0.04)。在非化疗周期内采血,复测位点数 N = 1 中,白细胞计数为(7.94 ± 3.41)× 109/L 较 N ≥ 2 低,差异具有统计学意义(= 0.03)。各组白细胞计数处于正常水平,其他各组没有统计差异性。具体情况见表 5。
3 讨论
目前我院主要利用 DFMH 进行药物代谢酶相关基因检测,6.03% 的患者会出现基因检测复测情况,其中可能还会有多次复测的情况,这将使得医院付出更多的人力物力,导致医院的直接经济损失,目前国内外尚没有相关文献研究报道,为了探索其失败原因我们进行了此项研究。

根据单个患者需要进行基因检测复测位点个数进行分组,无论复测位点数是 1 个还是≥ 2 个,其与患者的基本特征都没有明显的相关性。根据患者复测的原因分为低信号组和峰型异常组,其在肝癌患者中,由于峰型异常导致复测的原因明显高于低信号组(= 0.03),其原因可能与肝脏的功能降低有关,但由于此类患者样本数较少,仅有 3 例患者,后续还需扩大样本量加以证实。其他患者基本特征与复测原因没有明显相关性。
根据患者的采血时间进行分组,分为化疗周期内采血及非化疗周期内采血,其中在复测位点数≥ 2 个时,化疗周期内采血的白细胞水平较非化疗周期内采血的白细胞水平偏低,差异具有统计学意义(= 0.04)。非化疗周期内采血,复测位点数为 1 个时白细胞计数较复测位点数≥ 2 个时低,差异具有统计学意义(= 0.03),这提示虽然白细胞计数处于正常水平,但是仍可能影响复测结果,其原因可能为术中患者输血,或化疗后常规使用升白药物导致,其具体原因有待后续探索。
本研究存在一定的局限性,仅对复测患者病例进行了分析,而没有与非复测患者进行比较,无法明确患者的基本特征是否与复测相关。复测患者中白细胞计数水平虽然维持正常水平,但也对复测产生了一定的影响,其具体原因还有待后续探索。此外,由于部分门诊患者无需入院治疗,无法收集患者基本信息,因此对这部分基因检测复测的患者排除在外,可能存在一定的偏倚。

表5 化疗周期与基因检测复测原因的相关性
综上,肿瘤患者虽然白细胞计数水平维持在正常范围内,但仍对基因检测复测产生影响,其原因尚不明确,后续还需与非复测患者进行比较来探索更多的可能性。因基因检测均由同一人完成,暂时忽略人为因素,同时也考虑试剂的自身原因可能是导致基因检测复测的原因。
[1] Relling MV, Evans WE. Pharmacogenomics in the clinic. Nature, 2015, 526(7573):343-350.
[2] Wellmann R, Borden BA, Danahey K, et al. Analyzing the clinical actionability of germline pharmacogenomic findings in oncology. Cancer, 2018, 124(14):3052-3065.
[3] Wang B, Canestaro WJ, Choudhry NK. Clinical evidence supporting pharmacogenomic biomarker testing provided in US food and Drug Administration drug labels. JAMA Intern Med, 2014, 174(12):1938- 1944.
[4] Yang LY, Yang X, Fan DM, et al. Common gene-related polymorphisms of drug metabolism in Chinese population and their detection methods. J Mol Diagn Ther, 2017, 9(5):358-363. (in Chinese)
杨琳艳, 杨旭, 范冬梅, 等. 中国人群常见的药物代谢相关基因多态位点及其检测方法. 分子诊断与治疗杂志, 2017, 9(5):358-363.
[5] Yang Y, Xie B, Yan J. Application of next-generation sequencing technology in forensic science. Genomics Proteomics Bioinformatics, 2014, 12(5):190-197.
[6] Cui C, Shu W, Li P. Fluorescence in situ hybridization: cell-based genetic diagnostic and research applications. Front Cell Dev Biol, 2016, 4:89.
[7] Wang NN, Bai Y, Liu H, et al. Characteristics of adverse reactions of antineoplastic drugs in 787 cases and the prognosis analysis. Anti-Tumor Pharm, 2019, 9(1):143-148. (in Chinese)
王娜娜, 白羽, 刘红, 等. 787例抗肿瘤药物不良反应特点及预后因素分析. 肿瘤药学, 2019, 9(1):143-148.
张艳华,Email:zyh8812@163.com
2021-01-07
10.3969/j.issn.1673-713X.2021.04.015

