丹皮酚软膏微生物限度检查方法适用性研究
夏新生,陈扣宝,吕小燕
·论著·
丹皮酚软膏微生物限度检查方法适用性研究
夏新生,陈扣宝,吕小燕
230088 安徽,合肥市食品药品检验中心微生物科
根据《中国药典》(2020 年版)最新规定,对丹皮酚软膏微生物限度检查方法适用性进行研究,建立该产品的微生物限度检查方法。利用金黄色葡萄球菌、铜绿假单胞菌、枯草芽胞杆菌、白色念珠菌和黑曲霉菌 5 种代表菌进行试验,选用 1:10、1:20、1:50 供试液的平皿倾注法,以及 1:10 供试液分别冲洗 320 ml/膜、560 ml/膜的薄膜过滤法,分别进行消除样品抑菌活性筛查试验。采用薄膜过滤法(冲洗 560 ml/膜),金黄色葡萄球菌、枯草芽胞杆菌试验回收比值达到要求;采用增加供试品稀释(1:20)后,白色念珠菌的回收比值也达到要求。丹皮酚软膏微生物限度检查,需氧菌总数可采用薄膜过滤法(冲洗 560 ml/膜)测定,霉菌和酵母菌总数可按供试品稀释(1:20)倾注法测定,控制菌中金黄色葡萄球菌可采用稀释法(400 ml)、铜绿假单胞菌可采用常规法测定,结果符合要求。
丹皮酚软膏; 微生物限度检查; 适用性研究; 薄膜过滤法
丹皮酚是中药丹皮的主要有效成分之一[1],具有广泛的生物学活性[2],有镇静[3]、催眠、抗感染[4]、抗炎[5]、抗氧化、降血压[6]和抑制变态反应[7]的作用。大量研究表明:丹皮酚这种有效成分在防治心血管疾病方面具有较大潜力[8],但由于该成分存在易挥发[9]、易分解和难溶性等不足,其临床应用在一定程度上受到限制[10]。
丹皮酚软膏[11]是通过将丹皮酚、丁香油[12]两种原料药,加入适宜基质而制成的中药类外用膏剂,它具有消炎、止痒作用[13],临床可用于湿疹、皮炎、蚊虫叮咬、皮肤瘙痒等[14],对防治过敏性鼻炎和感冒也有一定疗效[15]。《中国药典》(2020 年版)于 2020 年 12 月 30 日正式实施,然而历版《中国药典》中,均无药品品种项下微生物限度检查的具体方法,所以每次新版药典实施前,都需要开展相关药品微生物限度检查的方法研究,以确保该检查方法的适用性,从而达到所采用方法的有效、可行[16]。因此,该文依据新版药典对丹皮酚软膏,按照皮肤给药制剂要求,进行了需氧菌总数、霉菌和酵母菌总数、金黄色葡萄球菌、铜绿假单胞菌测定方法的适用性研究。
1 材料与方法
1.1 材料
1.1.1 试验仪器 IPP260 生化培养箱购自德国美墨尔特公司;MJX-160B-Z 型霉菌培养箱和立式压力蒸汽灭菌器购自上海博迅实业有限公司医疗设备厂;HTY-305SP 型微生物限度检测仪、匀浆仪和开放式薄膜过滤器均购自杭州泰林生物技术设备有限公司;生物安全柜购自上海振梓创空气净化设备有限公司;显微镜购自莱卡显微系统上海贸易有限公司。
1.1.2 试验样品 丹皮酚软膏,购买市售三批样品(批号为 20190714、20190719、20191202),规格为 20 g(批准文号国药准字Z34020837),购自安徽立方制药有限公司。
1.1.3 试验用培养基 沙氏葡萄糖琼脂培养基、胰酪大豆胨液体培养基、胰酪大豆胨琼脂培养基、沙氏葡萄糖液体培养基、甘露醇氯化钠琼脂培养基、溴化十六烷基三甲铵琼脂培养基平板均为北京三药股份有限公司产品,且经适用性检查合格。
1.1.4 试验用稀释剂 使用的稀释剂主要有北京三药股份有限公司生产的无菌氯化钠-蛋白胨缓冲液,自制的 0.9% 无菌氯化钠溶液和 0.1% 聚山梨酯 80 溶液,均质控合格。
1.1.5 试验用菌株[17]枯草芽孢杆菌()[CMCC(B)63501]、金黄色葡萄球菌()[CMCC(B)26003][18]、铜绿假单胞菌()[CMCC(B) 10104]、白色念珠菌()[CMCC(F) 98001]、黑曲霉()[CMCC(F) 98003],这 5 种试验标准菌均由中国食品药品检定研究院提供,经复苏、传代后使用第四代工作菌悬液。
1.2 方法
1.2.1 工作菌液制备[19]
1.2.1.1 制备枯草芽孢杆菌、金黄色葡萄球菌、铜绿假单胞菌的工作菌悬液[20]分别取1 ml经 33 ℃培养 22 h 的枯草芽孢杆菌、金黄色葡萄球菌、铜绿假单胞菌的液体培养物,加到 9 ml 无菌氯化钠溶液(0.9%)中,分别 10 倍稀释至 10-7不大于 100 CFU/ml 菌悬液,备用。
1.2.1.2 制备白色念珠菌的工作菌悬液[20]取1 ml 经 22 ℃培养 46 h 的白色念珠菌的液体培养物,加到 9 ml 无菌氯化钠溶液(0.9%)中,再10 倍稀释至 10-6不大于 100 CFU/ml 菌悬液,备用。
1.2.1.3 制备黑曲霉的工作菌悬液[20]取经 22 ℃在沙氏葡萄糖琼脂培养基上培养 6 d 的黑曲霉菌斜面培养物,加入 6 ml 0.9% 无菌氯化钠溶液(含 0.05% 聚山梨酯 80)洗下黑曲霉孢子,经无菌脱脂棉滤过吸出,作为原菌液,再用 0.9% 无菌氯化钠溶液(含 0.05% 聚山梨酯 80)10 倍稀释至 10-6不大于 100 CFU/ml 菌悬液,备用。
1.2.2 工作菌液计数[19]
1.2.2.1 对枯草芽孢杆菌、金黄色葡萄球菌、铜绿假单胞菌计数 分别取 1 ml 枯草芽孢杆菌 10-7、金黄色葡萄球菌 10-7、铜绿假单胞菌 10-7的稀释液,再依次加入 25 ml 44 ℃的胰酪大豆胨琼脂培养基到无菌平皿中,每种菌测定 2 皿,33 ℃培养46 h,计数,3 次平行测定,结果不大于 100 CFU/ml,可以使用。结果见表 1。
1.2.2.2 对白色念珠菌和黑曲霉菌计数 分别取 1 ml 白色念珠菌 10-6、黑曲霉菌 10-6的稀释液,再依次加入 25 ml 44 ℃的沙氏葡萄糖琼脂培养基到无菌平皿中,每种菌测定 2 皿,22 ℃培养96 h,计数,3 次平行测定,结果不大于100 CFU/ml,可以使用。结果见表 1。
1.2.3 供试液制备 取丹皮酚软膏内容物 10 g,加入 45 ℃含 1% 聚山梨酯 80 无菌 pH 7.0 氯化钠-蛋白胨缓冲液至 100 ml,用匀浆仪充分混匀,静置 10 min,取上清液作为 1:10 供试液,备用。再取 1:10 供试液稀释制成 1:20 和 1:50 的供试液,作为筛选有效消除抑菌活性方法的样品。
1.2.4 需氧菌总数、霉菌和酵母菌总数计数方法的适用性试验
1.2.4.1 采用平皿法(倾注法)计数 1:10、1:20、1:50 供试液的需氧菌总数与 1:10、1:20 供试液的霉菌和酵母菌总数 试验组:①分别取 9 ml 1:10、1:20、1:50 的供试液和 1 ml 已制备好枯草芽孢杆菌、金黄色葡萄球菌、铜绿假单胞菌的菌液(不大于 1000 CFU/ml),混合均匀,再分别取上述混合溶液 1 ml 注入平皿,迅速倒入 15 ~20 ml 不超过 45 ℃的胰酪大豆胨琼脂培养基,待凝,每个菌株制备 2 个平皿,在 33 ℃培养箱中培养 72 ~ 120 h,观察菌落生长情况,点计菌落数,取均值。②分别取 1:10、1:20 供试液 9 ml和 1 ml 已制备好的白色念珠菌、黑曲霉(不大于 1000 CFU/ml),混合均匀,再分别取上述混合溶液 1 ml 注入平皿,迅速倒入 15 ~ 20 ml 不超过 45 ℃的沙氏葡萄糖琼脂培养基,待凝,每个菌株制备2 个平皿,在 22 ℃培养箱中培养 120 ~ 168 h,观察菌落生长情况,点计菌落数,取均值。菌液组:用无菌氯化钠溶液(0.9%)代替供试液,分别取9 ml 和 1 ml 已制备好的 5种菌液(同试验组中菌液),混合均匀,再分别取 1 ml 注入平皿内,每种菌平行制备 2 个平皿,测定所加的试验菌数(培养基与培养时间同试验组)。供试品对照组:按试验组方法,不加试验菌,直接取制备好的供试液试验,测定供试品菌数(本底菌)。稀释剂对照组:取与供试液等量的稀释剂代替供试液试验,其余按试验组方法进行,平行做2 份,培养计数。
1.2.4.2 薄膜过滤法计数 1:10 供试液的需氧菌总数计数方法试验[20]试验组:分别取 9 ml1:10 的供试液和 1 ml 已制备好枯草芽孢杆菌、金黄色葡萄球菌、铜绿假单胞菌的菌液(不大于1000 CFU/ml),混合均匀,分别取上述混合溶液1 ml 注入 100 ml 含 1% 聚山梨酯 80 无菌pH 7.0 氯化钠-蛋白胨缓冲液中,混合均匀后全部滤过薄膜过滤器(滤器先用约 50 ml 的无菌 pH 7.0 氯化钠-蛋白胨缓冲液润湿),再用 pH 7.0 无菌氯化钠-蛋白胨缓冲液分次冲洗,分别共用 320 ml/膜、560 ml/膜,按80 ml/次进行,冲洗完毕后,滤干滤膜,最后将滤干的滤膜轻轻贴于制备好的胰酪大豆胨琼脂培养基上,33 ℃培养 72 ~ 120 h,观察菌落生长情况,点计菌落数。菌液组:用无菌氯化钠溶液(0.9%)代替供试液,分别取 9 ml 和 1 ml 已制备好的 5 种菌液(同试验组中菌液),混合均匀,其余同试验组方法。供试品对照组:按试验组方法,不加试验菌,直接取制备好的供试液试验,测定供试品菌数(本底菌)。稀释剂对照组:取与供试液等量的稀释剂代替供试液试验,其余按试验组方法进行。
1.2.4.3 加菌回收比值的计算公式
整个方法适用性试验中,只有使试验组加菌回收比值与稀释剂对照组加菌回收比值均在 0.5 ~ 2 范围内[16],整个试验方法才能有效,否则需要调整方法重新试验。
1.2.5 控制菌(金黄色葡萄球菌、铜绿假单胞菌)检查方法的适用性试验 丹皮酚软膏作为以皮肤给药为主的一种外用制剂,按照 2020 年版《中国药典》四部通则 1107 的要求[16],其控制菌主要检查金黄色葡萄球菌和铜绿假单胞菌,因此针对该2 种菌进行方法适用性试验。
1.2.5.1 供试液的制备 同“1.2.3”项下 1:10 供试液的制备。
1.2.5.2 试验组 ①常规法:取 1:10 的供试液 10 ml 和金黄色葡萄球菌或铜绿假单胞菌的菌悬液 1 ml(同 1.2.1.1 法制备,不大于 100 CFU/ml)接种至 100 ml 胰酪大豆胨液体培养基中,置于 33 ℃培养 22 h,再取上述培养物 0.1 ml,划线接种于甘露醇氯化钠琼脂(金黄色葡萄球菌)或溴化十六烷基三甲铵琼脂(铜绿假单胞菌)平板上,33 ℃培养 22 ~ 70 h,观察菌落生长特性。有可疑菌落时进行分离、纯化和鉴定试验,以确证是否为金黄色葡萄球菌或铜绿假单胞菌。②培养基稀释法:取 1:10 的供试液 10 ml 和金黄色葡萄球菌的菌悬液 1 ml (同 1.2.1.1 法制备,不大于 100 CFU/ml)接种至 400 ml 胰酪大豆胨液体培养基中,置于 33 ℃培养 22 h,再取上述培养物 0.1 ml,划线接种于甘露醇氯化钠琼脂平板上,33 ℃培养 22 ~ 70 h,观察菌落生长特性。有可疑菌落时进行分离、分纯和鉴定试验,以确证是否为金黄色葡萄球菌。
1.2.5.3 供试品组 取供试液 10 ml,不加菌,其余按试验组检验。
1.2.5.4 阳性对照组 不加供试液,其余按试验组检验。
1.2.5.5 阴性对照组 取制备供试液的稀释剂 10 ml 取代供试液,不加菌,其余同试验组。
2 结果
2.1 需氧菌总数、霉菌和酵母菌总数计数方法的适用性试验结果
由于本品具有较强抑菌性,在采用平皿法(倾注法)对 1:10、1:20、1:50 供试液的需氧菌总数计数方法试验中,虽然铜绿假单胞菌在 1:50 供试液试验中加菌回收比值达到 0.5 ~ 2 范围,但金黄色葡萄球菌和枯草芽孢杆菌的试验组加菌回收比值均为 0,因此不能采用平皿法(倾注法)进行本品需氧菌总数计数检查。结果数据见表 2 ~ 4。
在对 1:10 供试液的需氧菌总数计数试验时,采用薄膜过滤法(分别冲洗 320 ml/膜、560 ml/膜)。当冲洗 320 ml/膜时,只有枯草芽孢杆菌与铜绿假单胞菌加菌回收比值均达到了 0.5 ~ 2 范围,而当冲洗 560 ml/膜时,枯草芽孢杆菌、金黄色葡萄球菌与铜绿假单胞菌的试验组加菌回收比值均达到了 0.5 ~ 2 范围,符合《中国药典》(2020 年版)的规定,因此可以采用薄膜过滤法(冲洗 560 ml/膜)进行本品需氧菌总数计数检查。结果数据见表5、表 6。
在采用平皿法(倾注法)对 1:10、1:20 供试液的霉菌和酵母菌总数的计数方法试验中,白色念珠菌和黑曲霉在 1:20 供试液试验中加菌回收比值达到 0.5 ~ 2 范围,符合《中国药典》(2020 年版)的规定,因此可以采用平皿法(倾注法)1:20供试液进行本品霉菌和酵母菌总数计数检查。结果数据见表 2、表 3。
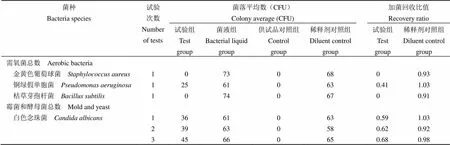
表 3 1:20 供试液平皿倾注法测定试验组结果
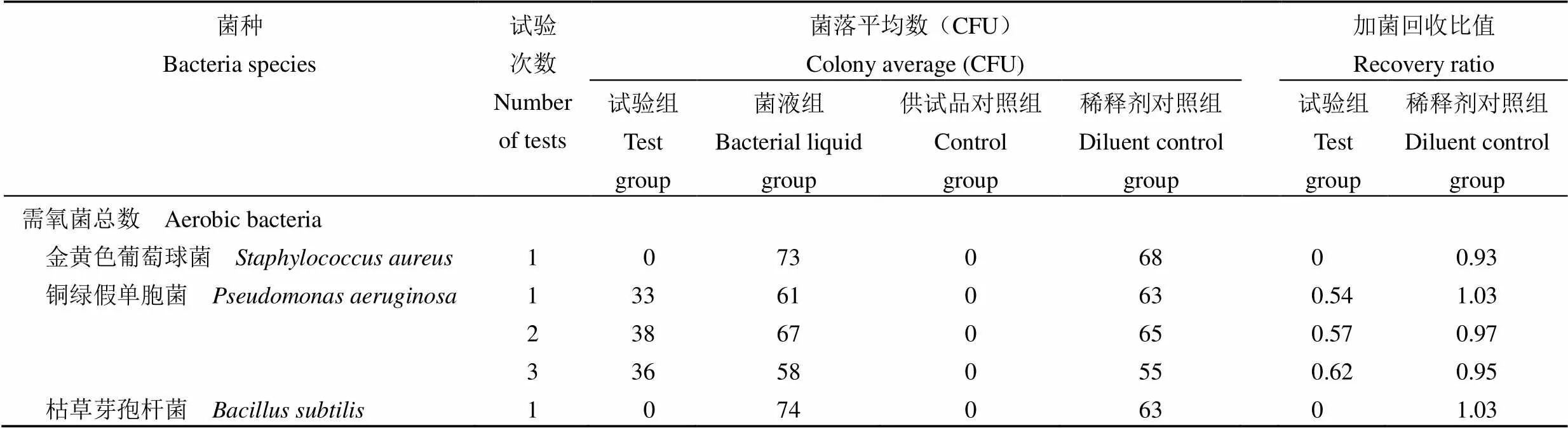
表 4 1:50 供试液平皿倾注法测定试验组结果
2.2 控制菌(金黄色葡萄球菌、铜绿假单胞菌)检查方法的适用性试验结果
由于本品对金黄色葡萄球菌具有较强抑制性,在采用常规法对取 1:10 供试液 10 ml 时,加入 100 ml 增菌培养基的金黄色葡萄球菌检查时,与阳性对照组比较菌的生长不好,因此调整试验方法,改为采用培养基稀释法(400 ml)对金黄色葡萄球菌进行控制菌检查,结果达到了要求。而铜绿假单胞菌采用常规法即达到了试验要求。所以,从表 7、表 8 可得出,金黄色葡萄球菌采用培养基稀释法(400 ml)、铜绿假单胞菌采用常规法,阴性对照组、供试品组均未检出试验菌,阳性对照检出试验菌,试验组也检出试验菌,该法对两种控制菌检查可行、有效。

表 5 1:10 供试液薄膜过滤法(冲洗 320 ml/膜)测定试验组结果

表 6 1:10 供试液薄膜过滤法(冲洗 560 ml/膜)测定试验组结果

表 7 金黄色葡萄球菌控制菌检查试验结果
注:“+”表示检出金黄色葡萄球菌,“-”表示未检出金黄色葡萄球菌。
Note: “+”was detected,“-”was not detected.

表 8 铜绿假单胞菌控制菌检查试验结果
注:“+”表示检出铜绿假单胞菌,“-”表示未检出铜绿假单胞菌。
Note: “+”was detected,“-”Nowas detected.
2.3 试验结论
丹皮酚软膏微生物限度检查:取本品内容物 10 g,加入 45 ℃含 1% 聚山梨酯 80 无菌 pH 7.0 氯化钠-蛋白胨缓冲液至 100 ml,用匀浆仪充分混匀,静置 10 min,取上清液作为 1:10 供试液,再稀释为 1:20 供试液,备用。需氧菌总数采用薄膜过滤法(冲洗 560 ml/膜)测定,霉菌和酵母菌总数采用 1:20 稀释供试品的平皿倾注法测定;控制菌中金黄色葡萄球菌采用稀释法(400 ml)测定,铜绿假单胞菌采用常规法(100 ml)测定。
3 讨论
从 2015 年起《中国药典》就对微生物限度检查方法适用性中试验接种和稀释步骤进行了调整,需将供试液和试验菌混匀后,再加入到平皿中或者进行薄膜过滤的操作,这样更能真实地反映药品被微生物污染的情况,更加科学严谨[21]。
通过此次试验,在需氧菌总数计数试验中,丹皮酚软膏对三种典型代表阳性菌(枯草芽孢杆菌、金黄色葡萄球菌、铜绿假单胞菌)都有明显抑制作用,特别是对金黄色葡萄球菌和枯草芽孢杆菌的抑制更为强烈;而在霉菌和酵母菌总数计数试验中,仅仅是对白色念珠菌有一定的抑菌作用。可见试验中本品对典型菌的作用与其临床应用于皮肤类细菌、真菌感染治疗具有一致性[22]。
此次试验中所采用薄膜过滤法涉及的冲洗次数,结果显示选择冲洗量为 80 ml/次比 100 ml/次的效果更好,即当冲洗次数增加时,特别是金黄色葡萄球菌和枯草芽孢杆菌的回收比值有显著提升,可见其对样品抑菌性消除有很好的促进作用,因此最终选择冲洗 7 次[20]。
根据 2020 年版《中国药典》新要求与实际工作经验,作者认为在整个试验中还需要充分考虑菌液制备时间与供试液制备后加入培养基的时间,既要符合要求,也要考虑试验组中供试液和菌液的混合接触时间不宜太短,否则就会影响后期方法重现性,甚至出现方法的重大偏差,因此需要特别关注与重视。
[1] Gong MY, Xu Q, Li ST. Preventive and therapeutic effect of paeonol on atherosclerosis in rats and its mechanism. Chin Traditional Patent Med, 2018, 40(2):437-440. (in Chinese)
龚明玉, 许倩, 李素婷. 丹皮酚对动脉粥样硬化大鼠的防治作用及其机制. 中成药, 2018, 40(2):437-440.
[2] Dai M, Li HK. Effect of paeonol on proliferation of vascular smooth muscle cells in atherosclerotic rabbits. Chin Pharmacol Bull, 2006, 22(5):587-591. (in Chinese)
戴敏, 李后开. 丹皮酚对动脉粥样硬化家兔血管平滑肌细胞增殖的影响. 中国药理学通报, 2006, 22(5):587-591.
[3] Chen Y, Kang LH. Protection effect of paeonol on regulation of lipid metabolism in hyperlipidemia mice and its mechanisms. Chin J Clin Pharmacol, 2017, 33(11):2273-2277. (in Chinese)
陈云, 康莉华. 丹皮酚对高脂血症小鼠的脂代谢调节保护作用及其机制. 中国临床药理学杂志, 2017, 33(11):2273-2277.
[4] Cao JP, Xu L, Ma Y, et al. Effects of paeonol on CRP in rats with atherosclerosis. Chin J Integr Med Cardio/Cerebrovasc Dis, 2014, 12(8):991-992. (in Chinese)
曹军平, 徐丽, 马毅, 等. 丹皮酚对动脉粥样硬化大鼠CRP的影响. 中西医结合心脑血管疾病杂志, 2014, 12(8):991-992.
[5] Zhang Z, Li MC. Pharmacological action and mechanism of the Peony Root Bark Phenol. Inf Traditional Chin Med, 2006, 23(2):21-23. (in Chinese)
张旃, 李明昌. 丹皮酚的药理作用及机制. 中医药信息, 2006, 23(2):21-23.
[6] Xing GS, Fang DM, Zhou YM, et al. Progress in preparation and pharmacological action of paeonol. Chin Traditional Herbal Drugs, 2006, 37(11):attachment 2-attachment 7. (in Chinese)
邢国胜, 房德敏, 周咏梅, 等. 丹皮酚的制备及药理作用研究进展. 中草药, 2006, 37(11):附2-附7.
[7] Huang TQ, He RX, Chen HJT, et al. Preparation of vesicle-entrapped paeonol cream and evaluation of its percutaneous absorption in vitro.
J Anhui Univ Chin Med, 2016, 35(3):79-83. (in Chinese)
黄天擎, 何瑞曦, 陈贺骏涛, 等. 丹皮酚泡囊乳膏的制备及其体外透皮吸收考察. 安徽中医药大学学报, 2016, 35(3):79-83.
[8] Xu TT, Gao J. Synthesis, characterization and biological activity of the Schiff base compound from paeonol and organic polyamine. Chem Reagents, 2012, 34(9):849-852. (in Chinese)
许同桃, 高健. 丹皮酚缩脂肪胺Schiff 碱的合成及生物活性研究. 化学试剂, 2012, 34(9):849-852.
[9] Liu BC. Research progress of paeonol. Chin Traditional Herbal Drugs, 2007, 38(11): attachment 4- attachment 6. (in Chinese)
刘本臣. 丹皮酚的研究进展. 中草药, 2007, 38(11):附4-附6.
[10] Ji MJ, Bai ZW, Wang Y, et al. Synthesis and biological evaluation of paeonol-nitrate derivatives. Chem World, 2020, 61(7):487-490. (in Chinese)
纪孟姣, 柏志伟, 王宇, 等. 丹皮酚席夫碱衍生物的合成及其生物活性研究. 化学世界, 2020, 61(7):487-490.
[11] Pharmacopoeia Committee, Ministry of Health, Ministry of Health of the People's Republic of China. Drug standard of the Ministry of Health of the People's Republic of China Formulation of traditional Chinese medicine (volume 10). 1995:Z10-Z30. (in Chinese)
中华人民共和国卫生部药典委员会. 中华人民共和国卫生部药品标准 中药成方制剂(第十册). 1995:Z10-Z30.
[12] Cai YQ, Feng J, Liu C, et al. Research on the formulation optimization and crystallization behaviors of paeonol gel. Chin J Hosp Pharm, 2018, 38(13):1363-1366. (in Chinese)
蔡雅琴, 冯军, 刘晨, 等. 丹皮酚凝胶处方优选及结晶行为研究. 中国医院药学杂志, 2018, 38(13):1363-1366.
[13] Wei ZW, Du CY, Jiang EL. Clinical observation on glycyrrhizic acid compound combined with paeonol on allergic contact dermatitis. World Chin Med, 2014, 9(5):595-597. (in Chinese)
位争伟, 杜朝阳, 姜恩林. 复方甘草酸苷联合丹皮酚软膏治疗48例变应性接触性皮炎临床观察. 世界中医药, 2014, 9(5):595-597.
[14] Shi LL, Liu ZQ, Qi JM. Equilibrium of Th1/Th2 in patients with senile pruritus and the influence of paeonol. Pract Geriatr, 2016, 30(3): 216-219. (in Chinese)
施林林, 刘振强, 戚建明. 老年性皮肤瘙痒症患者Th1/Th2细胞因子平衡状态及丹皮酚软膏的疗效. 实用老年医学, 2016, 30(3):216- 219.
[15] Liu Y, Chai PP. Clinical effect of NB-UVB combined with herbal fumigation and external use of paeonol ointmen on pityriasis rosea.J Milit Surgeon Southwest China, 2016, 18(5):418-420. (in Chinese)
柳研, 柴盼盼. 窄谱中波紫外线照射联合中药熏蒸及丹皮酚软膏治疗玫瑰糠疹. 西南军医, 2016, 18(5):418-420.
[16] Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China. Volume 4, 2020. Beijing: China Medical Science Press, 2020:160-176. (in Chinese)
国家药典委员会. 中华人民共和国药典. 2020年版四部. 北京: 中国医药科技出版社, 2020:160-176.
[17] Chinese Pharmacopoeia Commission. Guidance on analysis and testing of technology of the Chinese pharmacopoeia. Beijing: China Medical Science Press, 2017:537-563. (in Chinese)
国家药典委员会. 中国药典分析检测技术指南. 北京: 中国医药科技出版社, 2017:537-563.
[18] Gao J, Xiang HY, Xu TT, et al. Study on the antimicrobial activity of paeonol and its Schiff base derivatives. Chem Reagents, 2007, 29(1): 59-60, 62. (in Chinese)
高健, 相海鹰, 许同桃, 等. 丹皮酚及其席夫碱衍生物的抑菌性研究. 化学试剂, 2007, 29(1):59-60, 62.
[19] China Institute for the Control of Pharmaceutical and Biological Products. Chinese Standard Operating Procedures for Drug Inspection (2010 Edition). Beijing: China Medical Science Press, 2010:341-342. (in Chinese)
中国药品生物制品检定所. 中国药品检验标准操作规程(2010年版). 北京: 中国医药科技出版社, 2010:341-342.
[20] Zhang GH, Li YL, Liu WJ, et al. Method for microbial limit test of ciprofloxacin hydrochloride gel. Chin J Pharm, 2020, 51(8):997-1001. (in Chinese)
张光华, 李玉立, 刘文杰, 等. 盐酸环丙沙星凝胶的微生物限度检查方法. 中国医药工业杂志, 2020, 51(8):997-1001.
[21] Zhang WY, Cao XY. Establishment of microbial limit test method for Shagrel Hydrochloride tablets. Tianjin Pharm, 2016, 28(5):14-17. (in Chinese)
张文燕, 曹晓云. 盐酸沙格雷酯片微生物限度检查方法的建立. 天津药学, 2016, 28(5):14-17.
[22] Wang YH, Du JB, Lu SS. Clinical efficacy observation of paeonol ointment joint compound Minwei syrup in the treatment of children with acute eczema. Shaanxi J Traditional Chin Med, 2016, 37(7):810- 812. (in Chinese)
王艳会, 杜建波, 芦珊珊. 丹皮酚软膏联合复方敏维糖浆治疗小儿急性湿疹的疗效观察. 陕西中医, 2016, 37(7):810-812.
Study on the applicability of microbial limit test method for paeonol ointment
XIA Xin-sheng, CHEN Kou-bao, LYU Xiao-yan
Author Affiliation: Department of Microbiology, Hefei Food and Drug Inspection Center, Anhui 230088, China
We aim to study the applicability of microbial limit test method of paeonol ointment according to the latest regulations of Chinese Pharmacopoeia (2020 edition), was studied, and establish the microbial limit test method of paeonol ointment.Five representative bacteria were tested, including,,,and. The plate pouring method of 1:10, 1:20 and 1:50 test solution and the membrane filtration method of 1:10 test solution rinsing 320 ml/membrane and 560 ml/membrane were used to screen the bacteriostatic activity of eliminating samples.Using membrane filtration method (flushing 560 ml/membrane), the recovery ratio ofandmet the requirements. After dilution (1:20), the recovery ratio ofalso met the requirements.In the microbial limit test of paeonol ointment, the total number of aerobic bacteria can be determined by membrane filtration method (flushing 560 ml/film); the total number of mold and yeast can be determined by dilution (1:20) pouring method;can be determined by dilution method (400 ml) andcan be determined by conventional method. All results meet the requirements.
paeonol ointment; microbial limit test; applicability study; membrane filtration
CHEN Kou-bao, Email: chyjcqb@163.com
陈扣宝,Email:chyjcqb@163.com
2021-02-01
10.3969/j.issn.1673-713X.2021.04.007

