RNA干扰V1和C1提高番茄植株对番茄黄化曲叶病毒(TYLCV)的抗性
李云洲 岳宁波 陈相儒 李玉龙 曹贺贺 闫见敏 梁 燕
(1贵州大学农学院,贵州 贵阳 550025;2西北农林科技大学园艺学院,陕西 杨凌 712100;3西北农林科技大学植物保护学院,陕西 杨凌 712100;4西北农林科技大学资源环境学院,陕西 杨凌 712100)
番茄黄化曲叶病毒(Tomato yellow leaf curl virus,TYLCV)属双生病毒科(Geminiviruses)菜豆金色花叶病毒属(Begomoviruses)[1]。番茄幼苗感染TYLCV 后,会造成严重损失[2-3]。TYLCV 已成为威胁番茄安全生产的重要病害之一[4-5],该病毒主要通过烟粉虱(Bemisia tabaci)传播[6-7]。粉虱很难控制,所以培育TYLCV 抗性新品种是控制TYLCV 蔓延的重要途径。目前,已发现的番茄抗TYLCV 标记/基因主要有Ty-1[8-10]、Ty-2[11-12]、Ty-3[10-11]、Ty-4[13]、Ty-5[14-15]和Ty-6[16],其中Ty-1 和Ty-3 是一对等位基因,在番茄育种中应用最为广泛[17-18]。但是,TYLCV 属于单链DNA(single strand DNA,ssDNA)病毒,易变异,因此造成抗性不稳定[19]。
RNAi 是植物抗病毒的重要机制[20]。通过RNAi技术抗TYLCV 可以解决因病毒变异而造成的抗性不稳定的现象。RNAi 是指在生物体内双链RNA(double strand RNA,dsRNA)分子所引起的序列特异性降解靶基因,引发内源靶基因沉默的现象。RNAi 现象最先发现于秀丽隐杆线虫(Caenorhabditis elegans),将dsRNA注入虫体,可以抑制转录后基因沉默,从而抑制同源基因的表达,之后逐渐在昆虫、植物以及人体中陆续报道[20-21]。RNAi 是真核生物中普遍存在的、比较保守的抗病毒机制。
人工设计dsRNA 沉默靶标基因已被广泛应用,如将病毒基因作为靶标设计dsRNA 已成功应用于马铃薯Y 病毒(Potato virus Y,PVY)、大麦黄矮病毒(Barley yellow dwarf virus,BYDV)、烟草花叶病毒(Tobacco mosaic virus,TMV)和TYLCV[22-24]。参与RNAi 过程主要有三类蛋白:Ⅲ型核糖核酸酶蛋白(Dicer-like,DCL)、AGO 蛋白(Argonaute,AGO)、RNA 依赖型RNA聚合酶(RNA dependent RNA polymerases,RDR)。内源或外源dsRNA 经DCL 酶加工miRNA (microRNA)或siRNA(small interference RNA),miRNA 或siRNA 与AGO 结合形成 RNA 沉默复合体(RNA-induced silencing complex,RISC),RISC 通过碱基互补配对方式降解和干扰靶标核酸或病毒,降低病毒的转录本[25-26],目前RNAi 技术已在多种病毒中成功应用[27]。
TYLCV 基因组相对比较小,大约2 700~2 800 bp,该病毒基因组含有6 个开放阅读框(open reading frame,ORF):V1、V2、C1、C2、C3 和C4,其中V1 和C1在病毒的复制过程中发挥着重要作用,V1 编码外壳蛋白(coat protein,CP),CP 也是病毒颗粒的基础结构,在病毒进化过程中相对保守[28-29]。CP 对于病毒的侵染和移动是必需的[30]。CP 突变体可以影响病毒的侵染[31]。C1 编码复制相关蛋白(replication-associated protein,Rep)调控病毒复制的开始[32-33],因此通过RNAi 技术抑制TYLCVV1 和C1 基因,阻止病毒在植物体内继续组装、扩繁是植物防御病毒的有效途径。
本研究利用NCBI 中已登陆TYLCVV1 和C1 基因的保守序列设计引物,通过同源克隆获得TYLCV 的V1 保守片段tCP和C1 基因保守片段tRep,以这两段保守序列为靶标构建RNAi 干扰载体:pFGC5941-rtCP-tCP和 pFGC5941 -rtRep-tRep。以感病番茄TTI1103B-2 为材料,农杆菌介导遗传转化,获得RNA干扰株系RNAi-CP-2 和RNAi-Rep-12,通过实验室和田间鉴定,研究RNAi TYLCV 病毒关键基因V1 和C1对TYLCV 的抗性,旨在为番茄抗TYLCV 育种提供材料与理论基础。
1 材料与方法
1.1 材料
番茄材料TTI1103B-2 来自西北农林科技大学园艺学院番茄种质创新实验室;大肠杆菌DH5α、农杆菌GV3101 及克隆载体为pMD18-T 购于生工生物工程(上海)股份有限公司,pFGC5941 空载体为中国农业科学院蔬菜花卉所朱德蔚教授馈赠。
1.2 方法
1.2.1 RNAi 干扰载体设计流程 利用软件DNAMAN 比对以色列TYLCV(X15656)、中国安徽TYLCV(FJ646611)、 中国上海TYLCV(AM282874)、中国 广西TYLCV(AF311734)、中国台湾TYLCV(U88692)、日本TYLCV(AB192966)、泰国TYLCV(X63015)、中国广东TYLCV(AY602165)、多米尼加TYLCV(AF024715)、波多黎各TYLCV(AY134494)、荷兰TYLCV(FJ439569)、葡萄牙TYLCV(AF105975)、伊朗TYLCV(AJ132711)、埃及TYLCV(AY594174)、古巴TYLCV(AJ223505)、美国TYLCV(EF539831)、约旦TYLCV(EF054893)、中国杨凌TYLCV(KC293824)等不同TYLCV 基因组序列,选择其V1 和C1 保守区tCP、tRep,采用Primer Premier 5.0 分析tCP和tRep并设计引物F-tCP/R-tCP和tRep-F/tRep-R(表1),酶切位点在设计引物时已加两端[34]。
1.2.2 重组表达载体的构建 将目的片段PCR 产物连接到pMD18-T 载体上,构建中间载体pMD18-T-tCP和pMD18-T-tRep,转入大肠杆菌DH5α 感受态细胞中,涂布于LB(Luria-Bertani,LB)固体培养基(氨苄青霉素Amp 50 mg·L-1),37℃黑暗培养16 h,挑取单菌落送上海桑尼生物科技有限公司测序。提取测序正确的菌落质粒,分别对中间载体pMD18-T-tCP、pMD18-TtRep 和pFGC5941 载体酶切,用T4 连接酶将目的片段与载体pFGC5941 连接,构建目标载体pFGC5941-rtCP-tCP、pFGC5941-rtRep-tRep,再次转入大肠杆菌DH5α 感受态细胞中,Baste 抗性筛选目标克隆,提取质粒进行验证。
采用冻融法将目标载体转入农杆菌GV3101 感受态细胞中,涂布于LB 固体培养基(25 mg·L-1利福平、30 mg·L-1卡娜霉素),28℃黑暗培养直至长出单菌落,并提取质粒,利用限制性内切酶进行验证。
1.2.3 转基因植株的获得 转基因方法参考赵菁菁等[35]方法,略加修改。选取饱满的番茄种子,揉搓脱毛5 min,55℃温汤浸种4~6 h,1.0%NaClO 杀菌25 min,无菌水冲洗5 次,25℃暗培养3 d,待种子发芽露白后移置3 000 Lux 光强的培养间培养。12 d 后将番茄无菌苗子叶切割成0.5 mm×0.5 mm 小叶盘,在预培养基[2.0 mg·L-16-苄基腺嘌呤(6-benzylaminopurine,6-BA)+0.1 mg·L-1吲哚-3-乙酸(indole-3-acetic acid,IAA)]上预培养2 d,用含有目标载体的农杆菌侵染5 min,于共培养基(2.0 mg·L-16-BA+0.1 mg·L-1IAA)上暗培养36~48 h,移至抑菌培养基[2.0 mg·L-16-BA+0.1 mg·L-1IAA+400 mg·L-1头孢霉素(Carb)]培养5~10 d,转接于筛选培养基[2.0 mg·L-16-BA+0.1 mg·L-1IAA +0.2 mg·L-1除草剂(Basta) +400 mg·L-1Carb]进行培养。生根阶段为1/2 MS 培养基(0.1 mg·L-1IAA+300 mg·L-1Carb)[34]。各阶段培养基基本组分均为:MS+3.0%蔗糖+7.0%琼脂,1/2 MS培养基中蔗糖为1.5%,pH 值均为5.8。
1.2.4 转基因植株的PCR 检测 提取Baste 抗性植株及阴性对照(非转基植株)的总DNA 进行PCR 分析检测,以pFGC5941-rtCP-tCP和pFGC5941-rtRep-tRep质粒DNA 为阳性对照,未转化植株总DNA 为阴性对照。PCR 反应条件:94℃预变性3 min;94℃变性30 s、55℃退火30 s、72℃延伸30 s,35 个循环;72℃总延伸10 min。PCR 产物经过1.0%琼脂糖凝胶电泳分析,在凝胶成像系统上观察并记录结果。
1.2.5 TYLCV 接种方法 通过带毒粉虱自然接种TYLCV,具体方法参考文献[36]。接种30 d 统计发病严重度,分级标准,0:无病毒症状;1:叶片边缘黄化;2:叶片严重黄化和叶片卷曲;3:叶片严重卷曲和皱缩;4:叶片严重皱缩[37]。
1.2.6 转基因植株体内病毒含量检测 温室接种带毒粉虱,3 周后拍照,病情鉴定及病情指数参考李云洲[38]的分级标准。取实验室粉虱接种6 周左右的转基因与非转基因叶片,CTAB 法提取总DNA,CP 保守序列tCP用于检测TYLCV 病毒含量,引物如表1(FtCP/R-tCP),反应条件:94℃预变性3 min;94℃变性30 s,54℃退火30 s,72℃延伸30 s。分别在反应循环数为14、17、20、23、26、29、32、35 时各取出一管。采用1.5%琼脂糖凝胶电泳检测PCR 产物。
用Actin基因作为内参(表1),反应条件:94℃预变性3 min;94℃变性30 s,55℃退火30 s,72℃延伸30 s;4℃保存。分别在反应循环14、17、20、23、26、29、32、35 时各取出一管。采用1.5%琼脂糖凝胶电泳检测PCR 产物。
1.2.7 TYLCV 相关基因表达检测 定量PCR 检测TYLCV 相关基因V1、V2、C1、C2、C3 和C4 的相对表达量,具体方法参考文献[38-39]。
2 结果与分析
2.1 RNAi 载体pFGC5941-rtCP-tCP 和pFGC5941-rtRep-tRep 的构建
用引物F-tCP/R-tCP、tRep-F/tRep-R 扩增得到基因片段tCP(420 bp)、tRep(300 bp),将目的片段tCP、tRep分别插入pFGC5941 内含子CHSA 两端,其中正向插入的片段为tCP、rtRep,反向插入的片段为rtCP、tRep。干扰载体pFGC5941-rtCP-tCP、pFGC5941-rtCPtCP示意图如图1 所示。
2.2 转基因植株的PCR 检测
图2 泳道1、2 分别为转基因植株No.2 和No.9 cDNA用引物CaMV35S′/CHSA-A 的PCR 产物,而泳道3、4 分别为阴性对照和阳性对照(pFGC5941-rtCP-tCP)。证明植株No.2、No.9 已转入tCP/rtCP并转录表达。
图3 泳道1、2 分别为转基因植株No.12 和No.16 cDNA 用引物CHSA-B/OCS3 的PCR 产物,而泳道3、4分别为阴性对照和阳性对照(pFGC5941-rtRep-tRep)。证明转基因植株No.12 和No.16 转入tRep/rtRep并转录表达。
2.3 转基因植株在田间的表型
将野生型(WT)、转基因株系RNAi-CP-2、RNAi-Rep-12 分别移栽于温室自然接种TYLCV,可以明显看到,野生型植株发育迟缓,叶片皱缩、黄化,感病症状显著,而转基因植株无明显症状,发病程度明显低于野生型植株(图4)。通过统计发病严重度,发现RNAi-CP-2 与RNAi-Rep-12 株系发病严重度分别为1.77和1.33,极显著低于WT(3.73)(表2)。
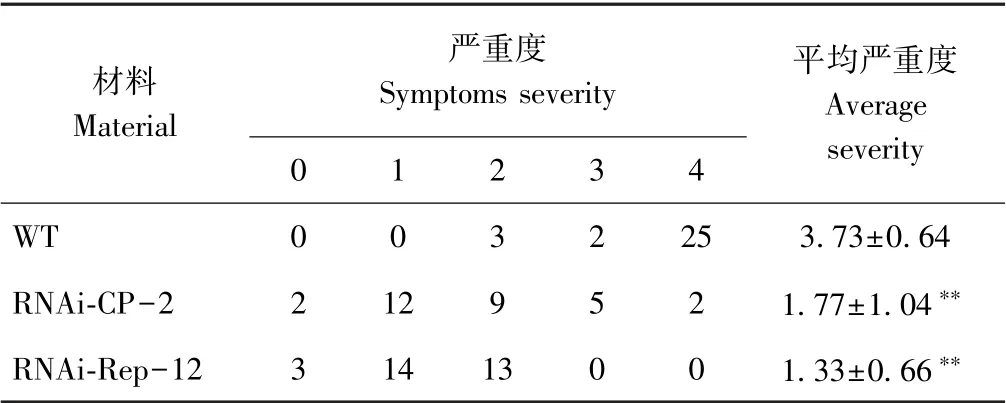
表2 RNAi 株系RNAi-CP-2 和RNAi-Rep-12 抗病性评价Table 2 The evaluation of disease resistance in the tomato plants of RNAi-CP-2 and RNAi-Rep-12
2.4 转基因植株体内病毒含量定性检测
通过半定量PCR 检测CP 编码基因V1 的含量,结果如图5 所示。无论是CP 干扰株系RNAi-CP-2 还是Rep 干扰株系RNAi-Rep-12 体内都存在病毒,但是CP、Rep 干扰株系体内病毒CP 模板V1 含量明显低于对照植株(WT)。RNAi-CP-2、RNAi-Rep-12 株系体内病毒含量低,所以直到26 个循环才检测到CP 基因V1,而对照WT 在14 个循环就可以检测到病毒,内参基因Actin在26 个循环时才能检测到,间接证明转基因植株可以抑制病毒模板数目的增加。
2.5 RNAi 干扰V1、C1 抑制TYLCV 病毒基因的表达
为了检测RNAi 干扰V1、C1 株系RNAi-CP-2 和RNAi-Rep-12 对TYLCV 病毒复制的抑制作用,通过定量PCR 技术检测了TYLCV 接种4 周后,6 个基因V1、V2、C1、C2、C3 和C4 的相对表达量,结果显示(图6),RNAi-CP-2 和RNAi-Rep-12 株系6 个基因的相对含量极显著低于WT,更重要的是RNAi-CP-2 株系不仅可以抑制V1 基因的表达,而且可以抑制TYLCV 其他5 个基因的表达,而RNAi-Rep-12 株系不仅可以抑制C1 基因的表达,同样可以抑制其他5 个基因的表达,表明RNAi 技术可以抑制病毒基因的表达,暗示RNAi的传递现象。
3 讨论
目前,在番茄抗TYLCV 研究领域主要通过化学方法防止粉虱传毒,或者常规育种将野生材料抗性标记渗透到栽培品种中[36],前者不仅会造成环境污染,而且会引起传毒介体的耐药性,后者耗时长,抗性不稳定。本研究通过RNAi 技术将编码CP 和Rep 的基因V1 和C1 作为靶标,农杆菌介导转入番茄,获得转基因番茄株系RNAi-CP-2 和RNAi-Rep-12。转基因株系RNAi-CP-2 和RNAi-Rep-12 前期均表现出一定的抗性,对病毒的复制和扩散有一定的抑制作用,延缓病症的发生,表明通过RNAi 技术干扰病毒V1 和C1 基因可以有效提高番茄植株的抗病性。目前RNAi 技术抗病毒已经应用于多种双生病毒[27,40-44]。虽然本研究分别单独干扰V1 或C1 基因,但转基因株系TYLCV其他基因的表达也会受到抑制,表明RNAi 技术可以在靶标基因附近传递干扰,这可能是因为RNAi 病毒的一个基因会影响病毒的完整性,从而影响其他基因的表达。Moissiard 等[45]研究发现拟南芥中RNAi 的传递现象需要DCL2 酶(Dicer-like 2,DCL 2)和DCL4酶(Dicer-like 4,DCL 4)参与,RNAi 沉默抑制子可以抑制RNAi 的传递现象。
本研究后期发现转基因株系也会表现出典型的TYLCV 病毒症状,推断可能是病毒复制的能力超过转基因植株的干扰能力。很多因素都会影响RNAi 干扰效果,如DNA 甲基化、干扰序列的不同以及RNAi 沉默抑制子等[41-42]。V2 属于TYLCV 重要基因之一,具有RNA 沉默抑制子功能,可以抑制RNAi[46]。Zrachya等[41]通过RNAi 技术干扰TYLCV CP 合成,发现该技术可以延迟病症的出现,但是后期仍会有病毒症状,这与本研究结果一致。
本研究还发现在无病症植株中可以检测到病毒的存在,这与前人研究发现几乎在所有的抗病材料中都存在病毒复制的结论一致[47],如西农2011 携带有抗性基因Ty-1/Ty-3,商业品种(3761,A.B.seeds,Ness Ziona,以色列)携带有抗性基因Ty-1,均可检测到TYLCV[46-47],但是病毒的相对含量比敏感番茄材料低,说明抗病材料中同样存在病毒的复制,可能病毒水平低不足以诱导植株病症出现。通过RNAi 技术可以抑制病毒在植株体内复制,降低病毒的相对含量,但如何提高RNAi 抗病毒效果,降低病毒复制水平,仍需要进一步研究。
4 结论
本研究通过RNAi 技术干扰TYLCVV1 和C1,可以在一定程度上抑制病毒的复制与表达,提高番茄植株对TYLCV 抗性。RNAi 技术不仅可以干扰病毒靶标基因V1 和C1 的表达,而且可以影响病毒其他4 个基因V2、C2、C3 和C4 的表达,暗示RNAi 技术可以在靶标基因附近传递蔓延。

