谷子黄叶色突变体光合特性研究
李君霞 秦 娜 朱灿灿 王春义 代书桃 宋迎辉 陈宇翔
(河南省农业科学院粮食作物研究所,河南郑州 450002)
叶片是植物进行光合作用的主要器官,其结构和功能与植物的光合作用十分密切。叶色突变是绿色植物一种非常重要的突变,会直接或间接影响叶绿素的合成和降解,因此,研究叶色突变对解析植物光合作用分子机理、叶绿素生物合成与降解机制等具有十分重要的作用[1-3]。
Wang 等[4]、Vytautas 等[5]研究发现,叶色突变是相关基因通过直接或间接作用影响叶绿素、类胡萝卜素等植物光合色素合成而产生的叶色变化[4-5]。也有研究表明,叶色突变导致光合酶活性降低引起光合作用减弱[6-8],如1,5 二磷酸核酮糖羧化酶(ribulose-1,5-bisphosphate carboxylase/oxygenase,RuBisCO)、磷酸烯醇式丙酮酸羧化酶 ( phosphoenolpyruvate carboxylase,PEPCase)、 苹果酸酶( NADP-Malate dehydrogenase,NADP-ME)等活性下降或失活,进而影响光合作用强度[9-11],使突变体在生产上的应用受到较大的限制。然而也有叶色突变引起光合特性增强的报道,欧立军[12]研究水稻淡黄绿叶自然突变体时发现,大田条件下突变体具有较高的光合速率和光合酶活性,进一步分析表明突变体呈现黄绿叶色是光合色素总量降低所致。Zhou 等[13]通过研究杂交水稻黄叶色突变体发现,突变体光合色素总含量降低,而光合作用和耐光抑制性明显增强,其中光系统Ⅱ(photosystemⅡ,PSⅡ)实际利用光量子产额、最大光能转换效率和原初光能转化效率显著提高。Tan 等[14]研究发现,自然条件下大麦黄叶色突变体光合色素含量和光合作用显著低于野生型,而在光饱和条件下其光合作用与野生型无显著差异,表明自然条件下黄叶色突变体光合作用减弱是其光合色素总量降低所致。Dai 等[15]研究叶绿素b 突变体发现,突变体截光率显著低于野生型,而其强光耐受性显著提高,表明叶绿素b 突变体截光能力降低时,其吸光与光能利用力显著提高,削弱了由强光产生的活性氧化物带给突变体叶片保护酶的破坏。林秋云等[16]分析水稻黄叶色突变体ylg3,发现孕穗期突变体叶绿体基粒数和叶绿素含量显著低于野生型,表现为总叶绿素含量和叶绿素b 含量显著下降,而光合速率、光饱和点、光补偿点、暗呼吸速率、表观羧化效 率、Fv/Fm、 PSⅡ和非光化学率灭系数(nonphotochemical quenching,NPQ)则显著高于野生型,表明突变体ylg3 具有较强的光合作用和较高的光能转换效率。
本研究以豫谷1 号的黄叶色突变株系ylm-1、ylm-2 为试验材料,分析其遗传性状、光合色素含量、光合速率日变化、光强度响应曲线、CO2浓度响应曲线、荧光特性、气孔特性、光合关键酶活性,解析突变体叶色变黄的机理,旨在阐明突变体光合作用增强的生理机制,为谷子高光效育种及分子标记辅助选择育种提供理论依据。
1 材料与方法
1.1 试验材料
ylm-1、ylm-2 是2013年河南省农业科学院粮食作物研究所通过甲基磺酸酯(ethy methysulforate,EMS)诱变常规谷子品种豫谷1 号筛选的两个黄叶色突变株(yellow leaf mutant)。其特点是植株在苗期为黄色,孕穗后期开始变为淡黄色。经连续筛选种植,已表现为稳定遗传。2018年6月和2019年6月分别以野生型豫谷1 号为对照,ylm-1、ylm-2 为试验材料,播种于河南省现代农业研发基地(河南新乡),每个材料种植小区面积为3.6 m2(3 m×1.2 m,长×宽),各小区随机排列种植,常规管理同大田种植。
1.2 试验方法
1.2.1 遗传表型分析 种植突变体ylm-1 与野生型豫谷1 号杂交的F2、ylm-2 与保谷22 杂交的F2,后代材料分别种植536 和572 株,开花期统计F2正常叶色与黄叶色分离比,χ2检验黄叶色突变体控制叶色基因的遗传分离模式。
1.2.2 叶片光合色素含量的测定 叶片光合色素含量采用分光光度法测定[17],计算公式参照Li 等[18]的方法。每个材料于开花期选取长势一致的植株各6株,取其旗叶叶片分别测定叶绿素a、叶绿素b、类胡萝卜素含量,每个材料测定时设3 次生物学重复。
1.2.3 光合速率日变化测定 在谷子开花期,选择晴朗无云的天气,于上午6:00 至下午18:00,采用LI-6400 便携式光合仪(美国LI-COR 公司)每隔1 h 测定旗叶光合速率1 次。光强、温湿度、CO2浓度均为自然条件,每个材料选取6 株旗叶叶片进行测定,连续测定2 d。
1.2.4 光强度和CO2响应光合曲线 谷子开花期,选择晴朗无云的天气,于上午9:30-11:30,利用LI-6400 便携式光合仪测定突变体与野生型植株在不同光强与不同CO2浓度下的光合速率。光响应曲线利用仪器内自带测定系统进行设定,CO2浓度设定为380 μmol·mol-1,叶室温度设为30℃,光强分别设定为0、200、400、600、800、1 000、1 200、1 400、1 600、1 800、2 000 μmol·m-2·s-1,不同光强由仪器自带LED 光源调节产生,根据不同光强度下光合速率和光强产生的斜率拟合光合速率-光响应曲线。CO2响应曲线制定时,光强设为1 500 μmol·m-2·s-1,叶室温度设为30℃,CO2由光合测定专用小钢瓶提供,浓度分别设置为0、100、200、300、400、500、600、700、800、900、1 000 μmol·mol-1,根据测定的光合速率结果,利用SPSS 20.0 软件进行统计分析并拟定光合速率-CO2响应曲线。
1.2.5 气孔导度及超微结构的测定 在谷子开花期,利用LI-6400 便携式光合仪测定突变体和野生型旗叶叶片的气孔导度。气孔超微结构参照邱义兰等[19]的方法,将叶片制成切片,在H-600 透射电镜(日本Hitachi 公司)下观察其超微结构并照相。
1.2.6 叶片荧光参数测定 荧光特性测定参照Xu等[20]的方法,采用便携式FMS-2 型脉冲调制荧光仪(英国Hansatech 公司)进行测定。选取自然光下生长的突变体与野生型谷子各6 株,于晴天6:00-18:00 测定荧光参数,重复3 次。首先将突变体与野生型暗适应15 min 的旗叶在弱调制测量光(0.05 μmol·m-2·s-1)诱导产生初始荧光(minimal flourescence,F0),随后用强饱和脉冲(700 μmol·m-2·s-1)激发产生最大荧光(maximal flourescence,Fm)。参照Zhong 等[21]的方法分别计算可变荧光(variable fluorescence,Fv)、PSⅡ最大光化学量子产量(optimal quantum yield of PSⅡ,Fv/Fm)、 非光化学猝灭系数( non - photochemical quenching,NPQ)、光合电子传递速率(electron transport rate,ETR)等参数。
1.2.7 光合相关酶活性测定 取开花期旗叶,称取0.5 g 叶片,放入液氮预冷的研钵中,加入2 mL 0.1 mol·L-1Tris-HCl 缓冲液(含1 mmol·L-1乙二胺四乙酸钠、7 mmol·L-1巯基乙醇、50%甘油、1% 聚乙烯吡咯烷酮,pH 值8.0),研磨成匀浆,于4℃、13 000 r·min-1条件下离心15 min,保留上清液。采用检测试剂盒(北京索莱宝科技有限公司)分别测定1,5-二磷酸核酮糖羧化酶( Rubisco)、 磷酸烯醇式丙酮酸羧化酶(Phosphoenolpyruvate carboxylase,PEPCase)、苹果酸酶(NADP-Malate dehydrogenase,NADP-ME)的活性,并计算酶活性值。
1.2.8 产量相关性状测定 谷子成熟后,突变体与野生型各取15 株分别调查株高、穗长、穗粗、单穗质量、穗粒质量、千粒重,并利用Microsoft Office Excel 2010和SPSS 20.0 软件对数据进行统计分析。
1.3 数据统计与分析
利用SPSS 20. 0 软件进行数据统计与分析,采用Excel 2010 和DPS 软件进行作图和差异显著性分析。
2 结果与分析
2.1 黄叶色突变体的遗传分析
ylm-1 与豫谷1 号(ylm-1/豫谷)和ylm-2 与保谷22(ylm-2/保谷22)杂交F1叶色均为正常绿色,表明黄叶色突变体性状为隐形基因控制。由表1 可知,F2表现出正常叶色与黄叶色性状的分离,χ2检验结果表明,2个组合均符合一对基因3 ∶1分离模式。
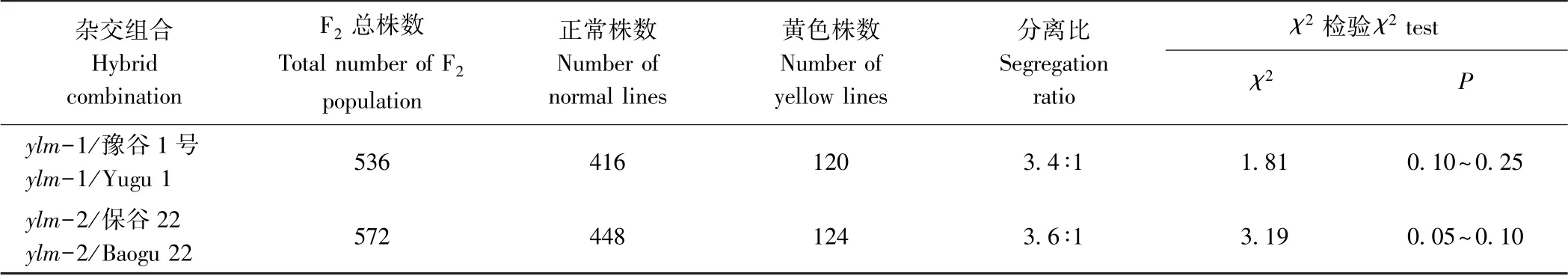
表1 F2 正常叶色与黄叶色性状分离比及χ2 检验Table 1 Segregation and χ2 test of normal and yellow leaf colour in F2 population
2.2 开花期光合色素含量分析
开花期突变体ylm-1、ylm-2 的叶绿素a、叶绿素b、类胡萝卜素和光合色素含量均显著低于野生型豫谷1号,约为野生型的50%~60%(表2)。突变体与野生型类胡萝卜素与光合色素的比值无显著差异。上述表明,突变体黄叶色是由于叶绿素、光合色素含量降低所致。
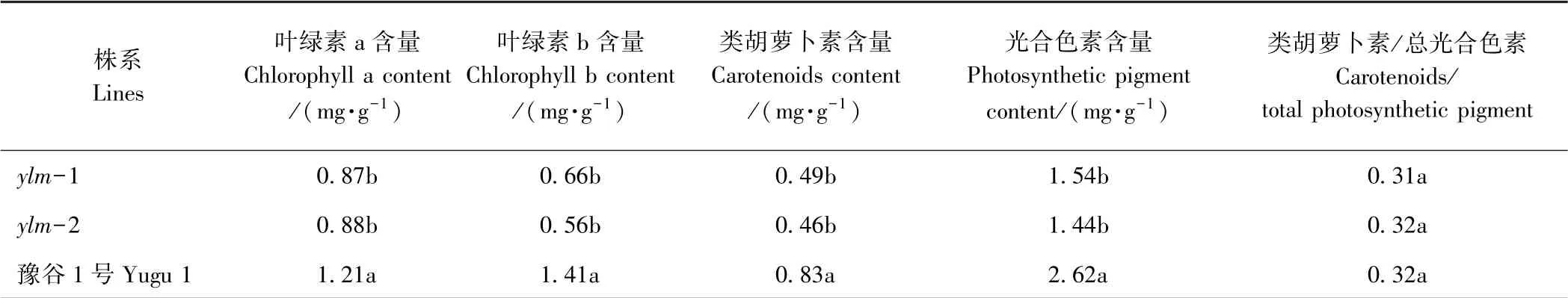
表2 黄叶色突变体与野生型叶片光合色素含量比较Table 2 Comparision of photosynthetic pigments content between mutants and wild type leaves
2.3 光合速率日变化分析
由图1 可知,ylm-1、ylm-2 和豫谷1 号的净光合速率日变化呈现不同的趋势。ylm-1、ylm-2 两突变株系净光合速率日变化只有单峰,净光合速率随着光强的增强和减弱分别呈现增强和降低趋势。豫谷1 号净光合速率日变化则有明显的“双峰现象”,表明豫谷1 号在正午强光条件下光合速率受到抑制,出现“午休睡眠现象”。豫谷1 号在弱光条件下(上午6:00—8:00 和下午16:00—18:00)的光合速率低于ylm-1、ylm-2 两突变株系速率,但差异不显著(P>0. 05)。
2.4 光强度响应曲线和CO2 浓度响应曲线分析
由图2-A 可知,在温度为30℃、光照强度为1 500 μmol·m-2·s-1条件下,ylm-1、ylm-2 和豫谷1 号的净光合速率随CO2浓度升高而上升,当CO2浓度达到800 μmol·m-2·s-1时,ylm-1、ylm-2 和豫谷1 号均达到CO2饱和点,CO2浓度继续增加但光合速率不再增加。同一CO2浓度下,ylm-1、ylm-2 净光合速率较豫谷1 号高。
由图2-B 可知,在380 μmol·mol-1CO2浓度下和一定光强范围内,突变体ylm-1、ylm-2 和野生型豫谷1 号的光合速率均随光强增加而上升。当光强达到1 600 μmol·m-2·s-1,豫谷1 号光合速率不再增加,处于平稳状态,而ylm-1、ylm-2 光合速率仍呈现缓慢增加趋势。表明突变体ylm-1、ylm-2 的CO2同化效率及光量子利用效率高于野生型豫谷1 号。
2.5 气孔特性分析
由表3 可知,突变体ylm-1、ylm-2 和野生型豫谷1 号气孔发育程度、结构、分布规律性均相同,ylm-1、ylm-2 和豫谷1 号气孔密度、气孔长度和气孔宽度无显著差异。而在光强为1 600 μmol·m-2·s-1条件下,ylm-1、ylm-2 气孔导度明显高于豫谷1 号,表现较高的光合速率,由此可见,气孔导度显著增加是突变体ylm-1、ylm-2 光合速率提高的主要原因之一。

表3 突变体与野生型叶片气孔特性比较Table 3 Comparision of stomatal traits between mutants and wild type leaves
2.6 荧光特性分析
突变体ylm-1、ylm-2 的F0显著低于野生型豫谷1 号,这与ylm-1、ylm-2 光合色素含量显著低于豫谷1 号结果一致,而Fv/Fm显著高于野生型,表明PSⅡ反应中心最大光能转换效率和原初光能转化效率较高;突变体ylm-1、ylm-2 的qN 显著低于野生型豫谷1号,表明其光合色素吸收的光能非光化学猝灭系数较低(表4)。综上所述,突变体ylm-1、ylm-2 的光能利用效率和转化效率明显高于野生型,这与ylm-1、ylm-2 具有较高的光合速率结果一致。
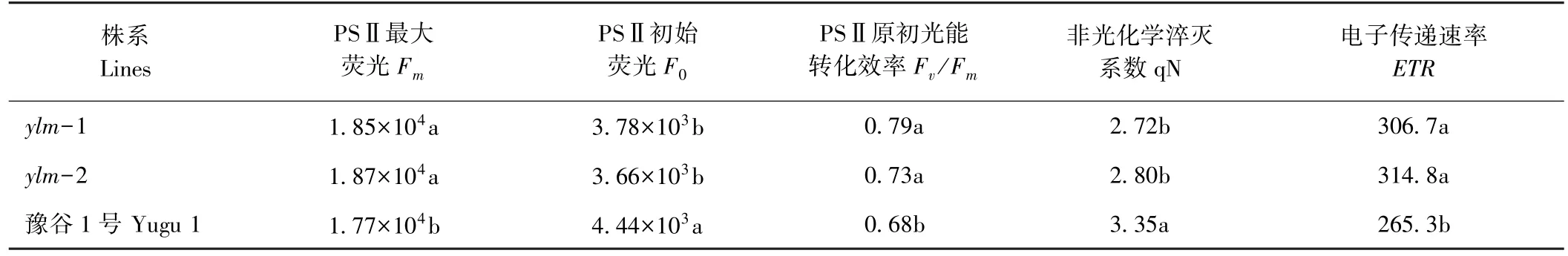
表4 开花期突变体与野生型叶片荧光特性比较Table 4 Comparision of fluorescence characteristics between mutants and wild type leaves at flowering stage
2.7 光合作用相关酶活性分析
突变体ylm-1、ylm-2 与野生型豫谷1 号旗叶中均存在C3和C4途径的光合相关酶。突变体中C3途径光合酶Rubisco 活性显著低于野生型豫谷1号,而C4途径关键酶PEPCase 和NADP-ME 活性显著高于豫谷1 号,分别较豫谷1 号增加了23. 3%、24. 4%和12. 9%、15. 5%(表5)。由此推测,突变体中C4途径光合相关酶PEPCase 和NADP-ME 活性的提高可能补偿了其光合色素含量的降低,从而增强了其光合特性。
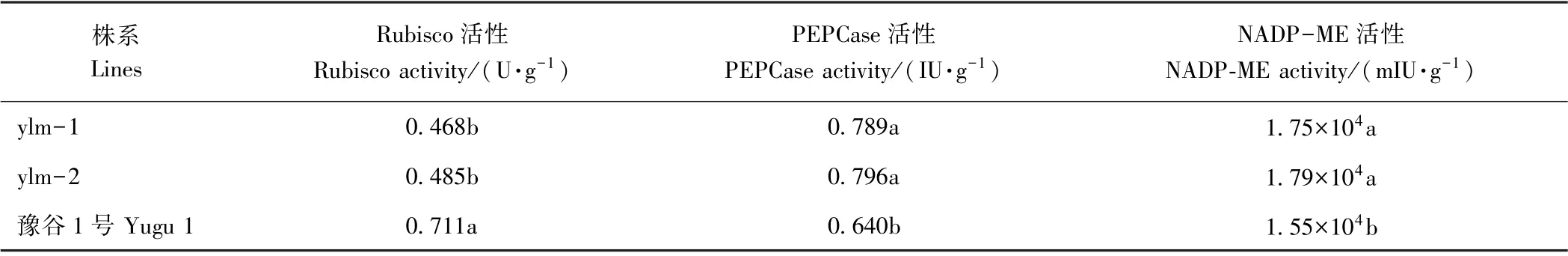
表5 开花期突变体与野生型叶片光合作用相关酶活性比较Table 5 Comparision of activity of photosynthetic key enzymes between mutants and wild type at flowering stage
2.8 单株产量性状分析
由表6 可知,成熟期突变体ylm-1、ylm-2 与野生型豫谷1 号产量性状有较大差异,突变体株高、穗长、穗粗、单穗质量、穗粒质量及千粒质量均显著高于野生型。结果表明,突变体具有较高的单株产量,主要表现为单穗质量、穗粒质量及千粒质量的显著增加。

表6 谷子突变体与野生型相关产量性状比较Table 6 Comparision of yield characteristics between mutants and wild type
3 讨论
关于植物叶色突变体中叶绿素含量与光合效率的关系,吴自明[22]通过研究水稻叶色突变体ygl-1 发现,随着突变体叶片逐渐成熟,叶绿素合成酶基因YGL1 编码区发生碱基突变,使得叶绿素合成酶活性下降,叶绿素合成与积累速率减缓,呈现出叶绿素含量降低的趋势,而突变体ygl-1 对光系统Ⅰ和光系统Ⅱ保持了较高效率的响应,表现出光合效率较野生型显著增加,此研究也表明,叶色突变体中叶绿素含量与光合效率无明显的相关性。本研究结果与以上研究报道一致,突变体在保持一定光合色素和叶绿素含量的基础上,其光合效率较野生型显著增加。
叶绿素荧光参数是用于描述植物光合作用机理和光合生理状况的变量或常数值,反映了植物“内在性”的特点,被视为研究植物光合作用与环境关系的内在探针,已逐渐应用于环境胁迫对作物光合作用的影响研究,具有快速、灵敏和无损伤的优点[23]。与光合参数“外在性”指标相比,叶绿素荧光参数主要反映叶片光合作用过程中光系统对光能的吸收、传递、耗散、分配等情况,与碳代谢密切相关[24]。Fv/Fm是PSⅡ最大光化学量子产量,揭示了PSⅡ光化学反映的热耗散过程[25]。本研究结果表明,谷子黄叶色突变体较低的光合色素含量限制了其对光能的捕获,而其较高的光电子传递速率减少了光能不足的不利效应,表现出较强的光合特性和较低的热耗散值。
气孔导度及气孔结构的变化对谷子光合特性的增强起着重要作用。陈吉玉等[26]通过分析不同光照下大豆苗期叶片气孔特征,揭示叶片气孔开放的增加可以提高大豆苗期净光合速率,增加碳水化合物积累量,进而提高大豆产量。叶片气孔是作物光合作用的重要组织结构,对光强有较强的适应性[27],其中气孔导度与细胞内CO2浓度有密切关系,因此,气孔开闭和气孔导度增加对作物光合特性和生物量的提高起着关键性作用。本研究中黄叶色突变体ylm-1、ylm-2 与野生型豫谷1 号的气孔密度与大小无显著性差异,所以气孔密度和大小不是突变体光合速率增加的原因。而气孔导度直接决定了细胞间隙CO2的供应,因此气孔导度的改变无疑可以显著促进光合的进行。
已有研究证明,C4植物光合关键酶对增强作物光合特性与耐胁迫能力具有重要的作用,且叶片保卫细胞上苹果酸酶活性与气孔导度有密切的正相关[28]。目前科学家们已成功将C4植物的光合关键酶基因PEPC、PPDK、NADP-ME 等导入C3植物水稻[29]、小麦[30]、拟南芥[31]等作物中。研究发现,转基因水稻、小麦、拟南芥等作物中的PEPCase、丙酮酸磷酸二激酶(pyruvate orthophosphate dikinase,PPDK) 和NADPME 活性显著增加,光合速率及气孔导度均显著提高。本试验中,突变体ylm-1、ylm-2 的PEPCase 和NADPME 活性分别较野生型豫谷1 号增加了23.3%、24.4%和12.9%、15.5%,初步推测突变体光合特性的增强及气孔导度的增加与C4光合酶活性的提高有一定关系。一般情况下,Rubisco 活性与羧化效率及光合速率呈显著正相关[28,32],本研究发现,突变体Rubisco 活性显著低于野生型,而光合速率高于野生型,二者呈负相关关系,表明黄叶色突变体中PEPCase 和NADP-ME 活性对光合作用的增强具有重要作用,这可能与植物中代偿生理机制有关。
4 结论
突变体ylm-1、ylm-2 在叶绿素降低后具有比野生型高的光合速率是多因素互作的结果。黄叶色突变体通过提高光能转换效率并降低光化学猝灭系数来提高暗反应同化能力,气孔导度及PEPCase 活性的增加使其积累和固定更多的CO2,促使光反应增强,从而提高突变体光合速率。黄叶色突变体ylm-1、ylm-2 不仅可作为叶色标记应用于杂交育种中后代纯度的鉴定,而且可以通过筛选高光效品系应用于生产。

