磁共振波谱在原发性帕金森病治疗效果评估中的应用价值
汤丹丹,张 勋,符益纲,陈松洁,孙鼎明,周 笑,朱明明,常永和,何国军
(1.徐州医科大学盐城临床学院神经内科,江苏 盐城 224000;2.盐城市第一人民医院磁共振室,江苏 盐城 224000;3.江苏省军区盐城离休干部休养所门诊部,江苏 盐城 224000)
帕金森病(Parkinson′s disease,PD)是常见于中老年人的慢性进行性中枢神经系统变性疾病,其发病率在全球中枢神经系统退变疾病中居第2位[1]。PD的运动症状以运动迟缓、静止性震颤、肌强直、姿势步态不平衡等为主要表现,非运动症状包括嗅觉减退、情绪不稳定、认知功能及睡眠障碍、自主神经功能障碍等[2];其病理特征主要为黑质多巴胺能神经元变性坏死及α-突触核蛋白聚集形成的路易小体的出现[3]。目前PD主要依据临床症状,尤其是运动症状来诊断,但早期PD患者的运动症状可能不明显或与其他运动障碍性疾病的早期运动症状相似,容易漏诊和误诊[4-5]。多巴胺是治疗PD的首选药物[6]。多巴丝肼为左旋多巴和苄丝肼的复合制剂,是目前PD的基础用药。药物治疗虽然不能治愈PD[7],但可以改善患者的症状;然而如果用药不恰当反而会加重患者病情。目前临床上尚无客观、有效评估药物疗效的工具。
氢质子磁共振波谱(proton magnetic resonance spectroscopy,1H-MRS)是唯一能够无创检测活体脑内代谢物及生物化学改变的技术。1H-MRS 主要定量的代谢物是N-乙酰天门冬氨酸(N-acetylaspartate,NAA)、肌酸(creatine,Cr)和胆碱(choline,Cho),可以反映神经元或胶质细胞功能[8]。NAA大多存在于神经元中,其水平降低表明有神经元损伤;Cho主要存在于胶质细胞中,其浓度增加表明胶质增生;体内Cr含量相对稳定,常作为内参[9-10]。目前临床上多采用 NAA/Cho、NAA/Cr及Cho/Cr比值来反映脑内生物化学代谢物的改变。
本研究应用1H-MRS观察多巴丝肼治疗前后早期PD患者豆状核、苍白球、丘脑、黑质中代谢物的变化,通过PD统一评分量表第三部分(unified Parkinson′s disease rating scale part Ⅲ,UPDRS-Ⅲ)评分分析患者运动症状与1H-MRS的相关性,旨在探讨1H-MRS对原发性PD治疗效果的评估价值。
1 资料与方法
1.1 一般资料选择2019年10月至2020年10月盐城市第一人民医院收治的双侧症状的原发性PD患者20例为研究对象,其中男9例,女11例;年龄47~82(67.15±9.83)岁,病程3~60(22.25±18.91)个月。纳入标准:(1)患者均符合中国帕金森病诊断标准(2016版)[11],Hoehn-Yahr 分级≤2.5[12];(2)能够配合并耐受头颅磁共振及1H-MRS检查;(3)能够配合 UPDRS-Ⅲ[13]等量表评估和检查。排除标准:(1)继发性帕金森综合征、PD叠加综合征;(2)严重心肺疾病、肝肾功能不全、内分泌及代谢性疾病;(3)脑梗死、脑出血等脑血管疾病;(4)对本研究中的药物有过敏史或对治疗方式有禁忌证者;(5)恶性肿瘤、癫痫患者。本研究获得盐城市第一人民医院伦理委员会批准。
1.2 治疗方法PD患者均口服多巴丝肼片(上海罗氏制药有限公司,国药准字H10930198)0.125 g,每日3次,饭前1 h服药,总疗程4周。
1.3 1H-MRS检查使用西门子MAGNETOM Verio 3.0T磁共振仪器进行常规磁共振成像和多体素1H-MRS检查。(1)常规扫描序列:T1-液体抑制反转恢复序列(fluid attenuated inrersion recovery,FLAIR)、T2-FLAIR、扩散加权成像(diffusion-weighted imaging,DWI)轴位,T2WI矢状位;T1-FLAIR相关参数:重复时间(repetition time,TR)2 000 ms,回波时间(echo time,TE) 9 ms;T2-FLAIR:TR 8 500 ms,TE 85 ms;DWI:TR 6 600 ms,TE 100 ms;T2WI:TR 6 300 ms,TE 86 ms。(2)1H-MRS检查的相关参数:选择化学移位成像序列,TR 1 700 ms,TE 135 ms,带宽50 Hz,视野160 mm×160 mm,层厚10 mm,矩阵16×16,扫描时间为6 min 53 s。扫描完毕由仪器自带的西门子syngo.via波谱学软件进行处理。用于波谱分析的感兴趣区(region of interest,ROI)是大脑两侧的豆状核、苍白球、丘脑、黑质。软件自动对波谱进行处理后记录治疗前后NAA、Cho和Cr的波峰。
1.4 观察指标(1)患者运动症状:分别于入院第2天(治疗前)和治疗4周后(治疗后)对20例患者进行UPDRS-Ⅲ评分,包括言语、面部表情、强直、手指拍打(对指试验)、手掌运动(握拳试验)、前臂回旋运动(轮替试验)、脚趾拍地运动、两脚灵敏度测试、起立、步态、步态冻结的评估、姿势平稳度(后拉试验)、姿势、全身自发性的动作评估(身体动作迟缓)、双手姿态性震颤、双手动作性震颤、静止性震颤幅度(肢体和嘴唇、下巴)以及静止性震颤持续性共18项,每项0~4分,累计分数越高,运动症状越重,病情也越重。(2)NAA/Cho、NAA/Cr、Cho/Cr比值:分别于治疗前和治疗后根据NAA、Cho和Cr的波峰(峰面积代表各种代谢物的浓度)计算NAA/Cho、NAA/Cr、Cho/Cr比值。
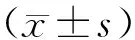
2 结果
2.1 PD患者治疗前后1H-MRS结果比较结果见表1。治疗后PD患者左右两侧豆状核、苍白球、丘脑及黑质中的NAA/Cho、NAA/Cr比值均显著高于治疗前,差异有统计学意义(P<0.05)。PD患者治疗后Cho/Cr比值与治疗前比较差异无统计学意义(P>0.05)。
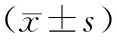
表1 治疗前后PD患者豆状核、苍白球、丘脑、黑质中各代谢物比值比较
2.2 PD患者治疗前后UPDRS-Ⅲ评分比较20例患者治疗前和治疗后UPDRS-Ⅲ评分分别为(21.95±8.90)、(15.65±5.18)分;患者治疗后UPDRS-Ⅲ评分显著低于治疗前,差异有统计学意义(P<0.05)。
2.3 UPDRS-Ⅲ评分与1H-MRS指标的相关性结果见表2。患者治疗前后的NAA/Cho、NAA/Cr比值变化值与UPDRS-Ⅲ评分变化值均呈显著负相关(P<0.05);在校正了年龄、性别和病程等因素后,治疗前后的NAA/Cho、NAA/Cr比值变化值与UPDRS-Ⅲ评分变化值仍呈显著负相关(P<0.05),Cho/Cr比值变化值与UPDRS-Ⅲ评分变化值无相关性(P>0.05)。
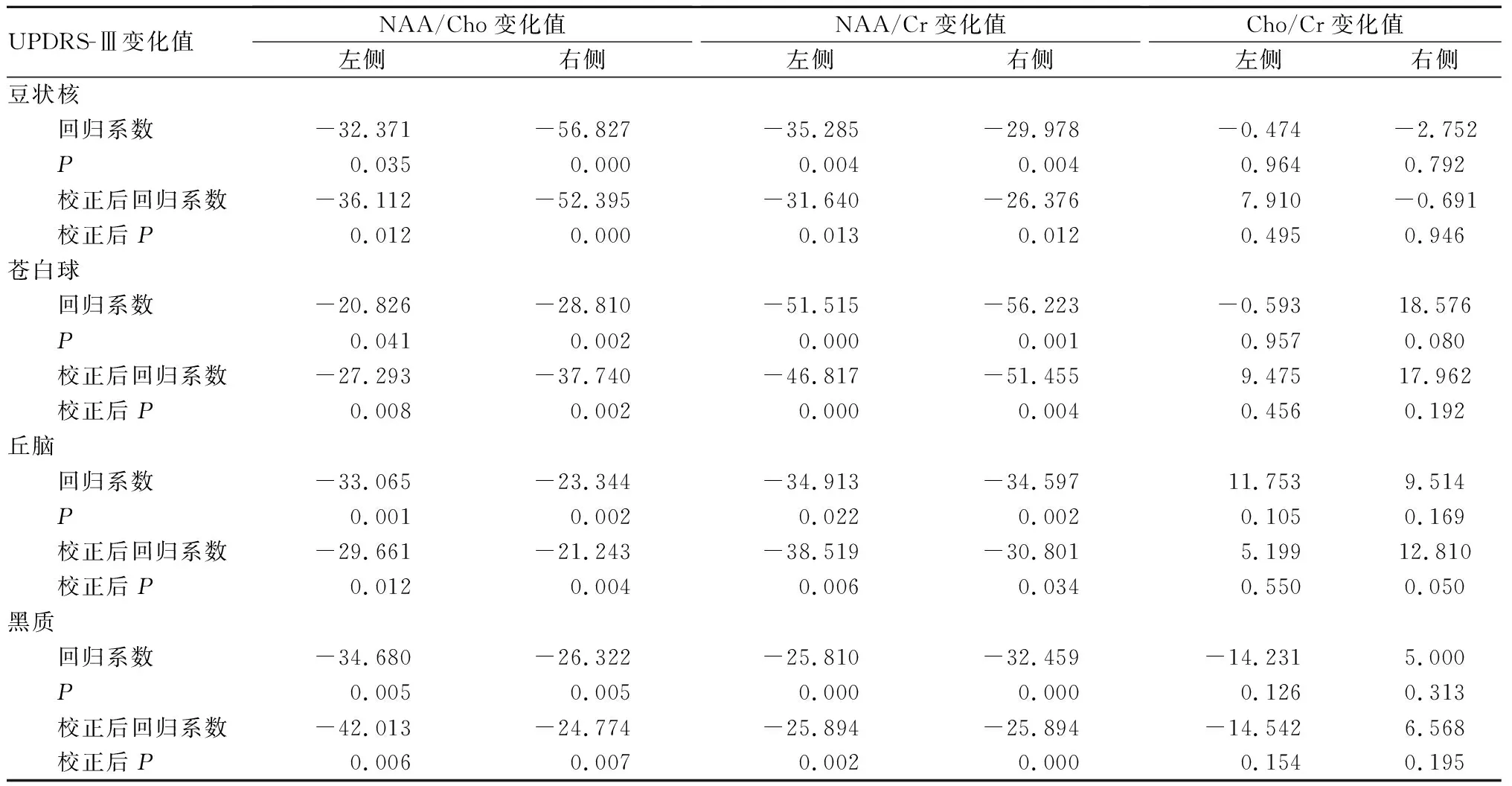
表2 治疗前后UPDRS-Ⅲ评分与1H-MRS检查指标的单因素和多因素线性回归分析
3 讨论
我国65岁以上人群PD的患病率为1 700/10万,且随年龄增长逐渐升高,给家庭和社会带来了沉重的负担[14]。目前尚无治愈PD的方法,药物治疗多以控制临床症状为主,不恰当的药物治疗可对患者造成不可逆的伤害,严重影响患者生活质量,因此,选择合适的药物尤为重要,而目前临床尚无客观的、可靠的药物疗效评价工具。1H-MRS是一种能够无创性定量分析人体内组织代谢物的影像学技术。目前1H-MRS已被用于定量多种神经系统疾病中的代谢物,例如肿瘤[15]、中风[16]、多发性硬化[17]、艾滋病及其相关疾病[18-19]、神经系统退行性病变如亨廷顿病及阿尔茨海默病[20-21]以及PD[22]。其主要定量的脑内代谢物为 NAA、Cr、Cho等[23-24]。1H-MRS有3个波峰,2.0×10-6处的NAA几乎只存在于神经元及其合成过程中,3.0×10-6处的Cr参与膜生物合成和分解,3.2×10-6处的Cho是细胞膜的组成部分[25]。NAA与神经元的代谢有关,其在脑组织中含量降低说明神经元被破坏且数量减少;Cho和Cr在胶质细胞中的含量远远大于神经元,Cho在脑组织中的含量增高说明有胶质细胞增生。基于此,本研究对多巴丝肼片治疗前后的PD患者分别进行1H-MRS检查和UPDRS-Ⅲ评分,对治疗前后波谱代谢物比值变化、UPDRS-Ⅲ评分变化以及波谱代谢物比值与UPDRS-Ⅲ两者之间的关系进行研究。
本研究对多巴丝肼治疗前后PD患者的左右侧豆状核、苍白球、丘脑、黑质分别行1H-MRS检查,结果显示,治疗后左右侧豆状核、苍白球、丘脑及黑质中的NAA/Cho、NAA/Cr比值均较治疗前显著增高,Cho/Cr比值变化不明显,说明多巴丝肼片治疗后PD患者这4个部位的多巴胺能神经元功能有所恢复,而神经胶质细胞功能恢复较慢或者难以恢复;提示治疗后PD患者的脑内代谢较治疗前有改善,而该代谢变化可通过1H-MRS检查来体现。本研究还对治疗前后PD患者分别进行UPDRS-Ⅲ评分,结果显示,治疗后的PD患者UPDRS-Ⅲ分值较治疗前显著降低,表明治疗后的PD患者的临床症状尤其是运动症状有明显改善。
本研究对治疗前后豆状核、苍白球、丘脑及黑质的1H-MRS比值变化值与UPDRS-Ⅲ评分变化值进行了单因素线性回归分析,且在校正年龄、性别和病程因素后对治疗前后1H-MRS比值及UPDRS-Ⅲ变化值进行了多因素线性回归分析,2个结果均表明NAA/Cho、NAA/Cr比值变化与UPDRS-Ⅲ评分变化呈显著负相关,且二者相关性不受性别、年龄及病程等因素的影响。以上结果提示,脑内这4个部位代谢越好的PD患者的运动症状的严重程度越低。这一结果也印证了PD病理改变部位的生物化学代谢与PD发生、发展的相关性。
综上所述,通过1H-MRS来观察多巴丝肼治疗前后早期PD患者脑组织中的NAA、Cho、Cr三者之间比值的变化,有助于PD药物疗效的评估,从而进行个体化、精准化治疗。

