HIF-1α/SHH信号通路在神经母细胞瘤中的表达及临床意义
陈 盛,严志龙,吴晔明,徐 敏,顾 松,马 靖
1.上海交通大学医学院附属上海儿童医学中心普外科,上海 2 0 0 1 2 7;2.上海交通大学医学院附属新华医院儿外科,上海 200092;3.上海交通大学医学院附属上海儿童医学中心病理科,上海 200127
神经母细胞瘤(neuroblastoma,NB)源于交感神经节的原始神经嵴细胞,是最常见的儿童恶性实体肿瘤之一。虽然有手术、化学治疗(化疗)、放射治疗(放疗)、自身造血干细胞移植等多种治疗方式,但由于进展期NB具有易转移、易复发、预后较差的特点,治疗效果均不理想。据文献[1-2]报道,国际神经母细胞瘤分期系统(International Neuroblastoma Staging System,INSS)3期的NB患儿5年生存率约为50%,4期NB的5年生存率仅为20%。因此,寻找NB发生、发展中的关键分子靶点,对提高该病的疗效、判断其预后具有重要意义。
实体肿瘤快速生长,而肿瘤滋养血管生长速度相对落后,并可能存在血管畸形,因此,肿瘤内部存在血液供应不足、缺氧是典型的微环境特征[3-4]。已知低氧导致NB具有更强的侵袭、转移能力,也使得NB细胞去分化,具备肿瘤干细胞特征,对放疗、化疗有更强的耐受性[5-6]。在缺氧过程中,NB的低氧诱导因子1α(hypoxia inducible factor-1α,HIF-1α)表达增加,HIF-1α在NB细胞适应缺氧环境、恶性程度增加的过程中发挥关键作用[7-8]。本课题组前期研究[7]首先发现,NB细胞中HIF-1α通过激活下游的音猬因子(sonic hedgehog,SHH)信号通路,促进NB细胞生长和侵袭。在前期研究的基础上,本研究通过测定HIF-1α/SHH通路在NB中的表达,报道该信号通路与NB临床特征的联系,以及对其预后的提示意义。
1 对象与方法
1.1 研究对象
选择2009年1月—2014年12月在上海交通大学医学院附属上海儿童医学中心、上海交通大学医学院附属新华医院住院行NB切除术,手术年龄为0~18岁的儿童患者作为研究对象,在2家医院的病理科调取NB石蜡切片。并选择相同时间段和年龄段、接受节细胞神经瘤(ganglioneuroma,GN)切除术的患儿作为对照组,同样调取其石蜡切片。NB患儿共101例,其中男性53例,女性48例;中位年龄为3岁(4个月~10岁);收集相关病史资料进行回顾性分析。GN患儿共20例,其中男性8例,女性12例;中位年龄为10岁(4~17岁)。本研究经上海交通大学医学院附属上海儿童医学中心和上海交通大学医学院附属新华医院伦理委员会批准(批件号分别为SCMCIRB-K2017024、XHEC-D-2036)。
1.2 主要试剂
免疫组织化学实验所需的HIF-1α一抗(工作浓度1∶200)购自美国Abcam公司,SHH一抗(工作浓度1∶200)购自美国Santa Cruz公司。辣根过氧化物酶标记的二抗(工作浓度1∶100)购自美国Santa Cruz公司。
1.3 免疫组织化学实验
采用免疫组织化学SP(streptavdin-peroxidase)法进行染色,在NB和GN石蜡切片中检测HIF-1α和SHH蛋白表达,实验步骤如参考文献[9]所述。
切片由2位病理科医师盲法阅片,对免疫组织化学结果进行半定量评分,如有意见不同则协商讨论达成一致。每张石蜡切片随机选5个高倍视野(×400),每个视野计数200个细胞。按照细胞着色百分比和着色强度分别评分,评分标准如参考文献[10]所述:着色细胞≤5%计0分,6%~25%计1分,26%~50%计2分,51%~75%计3分,>75%计4分;细胞无着色计0分,淡黄色计1分,黄色计2分,棕褐色计3分。2种分值的乘积为最终得分,≥6分为高表达,<6分为低表达。
1.4 统计学分析
采用SPSS 19.0软件进行统计分析。定量资料以中位数(全距)表示;定性资料以频数(百分比)表示,采用χ2检验。对HIF-1α和SHH在NB中的表达水平进行Spearman相关分析,采用Kaplan-Meier生存分析法进行预后分析。以P<0.05为差异有统计学意义。
2 结果
2.1 NB患儿的一般信息
将101例NB患儿按INSS分期标准,分为1期患者20例、2期患者23例、3期患者22例、4期患者36例(包括4s期4例)。肿瘤原发部位位于肾上腺49例、后腹膜39例、后纵隔12例、颈部1例。所有患儿均接受NB完全或部分切除术,61例术后接受正规化疗,其中8例接受自体干细胞移植。有5例因家庭原因或经济原因术后未接受或未完成正规化疗,均死亡。22例死于肿瘤进展或复发、转移,3例死于化疗后严重感染,失访9例。去除失访病例,本组病例5年总体生存(overall survival,OS)率为67.4%,5年无事件生存(event-free survival,EFS)率为62.0%。其中1期NB患儿OS率和EFS率均为100%,2期NB患儿OS率和EFS率均为95.7%,3期NB患儿OS率和EFS率分别为59.1%、45.5%,4期NB患儿OS率和EFS率分别为37.5%、31.2%。
2.2 HIF-1α、SHH在NB和GN中的表达差异
免疫组织化学显示HIF-1α表达于细胞核,SHH表达于细胞核和细胞质(图1)。HIF-1α在27例(26.7%)NB患儿中高表达,在74例(73.3%)例患儿中低表达;SHH在33例(32.7%)NB患儿中高表达,在68例(67.3%)例患儿中低表达;在GN中,只有1例高表达HIF-1α(5.0%),2例高表达SHH(10.0%)(表1、图1)。因此,HIF-1α、SHH在NB中的表达率高于GN,差异有统计学意义(均P<0.05)。Spearman相关分析显示,101例NB中HIF-1α、SHH表达水平呈显著正相关(r=0.41,P=0.000)。
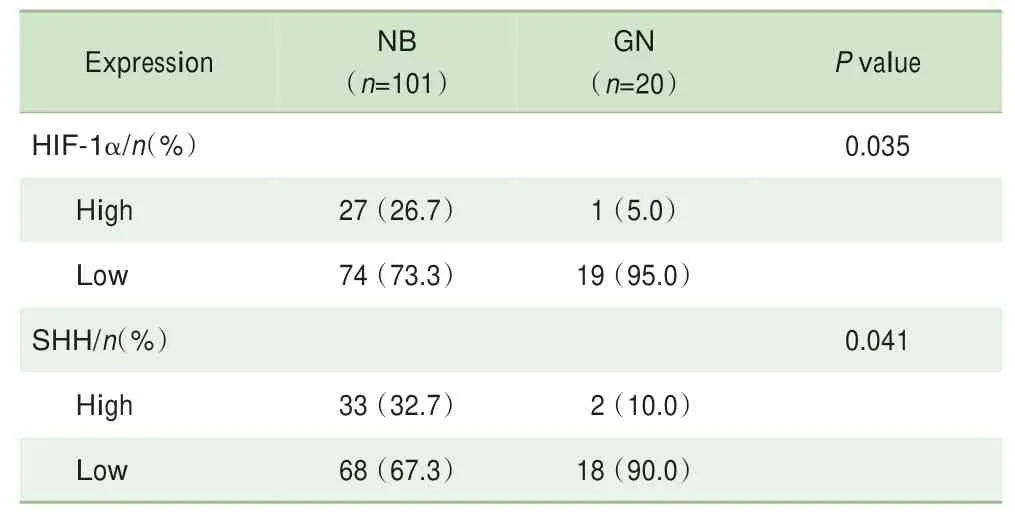
表1 HIF-1α、SHH在NB和GN中的表达水平Tab 1 Expression levels of HIF-1αand SHH in NBs and GNs
2.3 HIF-1α、SHH表达水平和NB临床病理特征的关系
3、4期NB中HIF-1α、SHH的高表达患者比例高于1、2期NB,差异有统计学意义(HIF-1α:38.6%vs11.4%,P=0.002;SHH:42.1%vs20.5%,P=0.021)(图1、表2)。病理分类为组织分化不良型(unfavorable histology,UFH)NB中HIF-1α、SHH的高表达患者比例也高于组织分化良好型(favorable histology,FH)NB,差异有统计学意义(HIF-1α:37.0%vs14.9%,P=0.012;SHH:44.4%vs19.1%,P=0.007)(图1、表2)。此外,HIF-1α、SHH的高表达也与局部淋巴结转移有关(HIF-1α:36.2%vs14.0%,P=0.012;SHH:46.6%vs14.0%,P=0.001),而与年龄、性别、MYCN proto-oncogene(MYCN)基因扩增、肿瘤远处转移等因素无关(均P>0.05)(表2)。
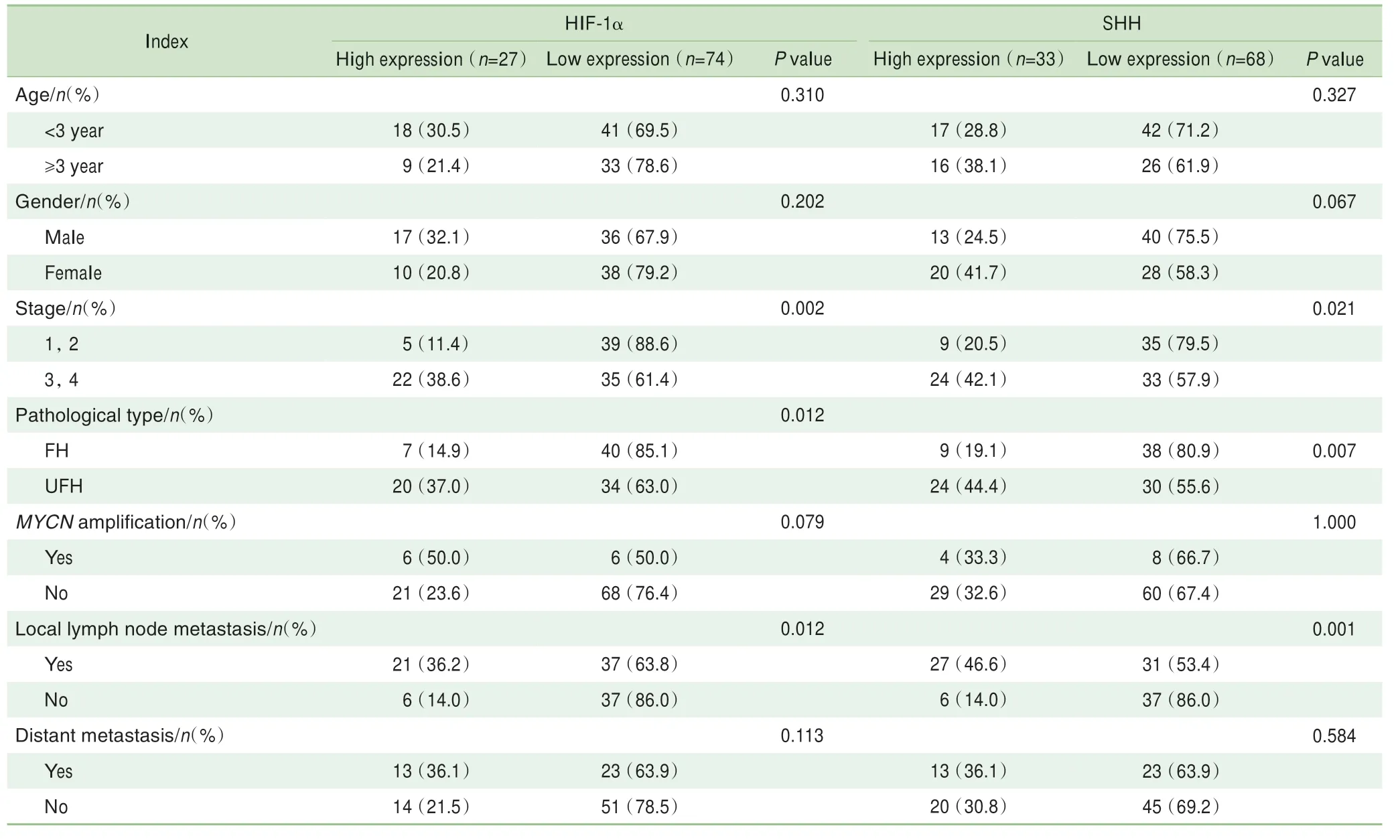
表2 HIF-1α、SHH表达水平和NB患儿临床病理特征的关系Tab 2 Relationship between expression levels of HIF-1α/SHH and clinicopathological characteristics of NB patients
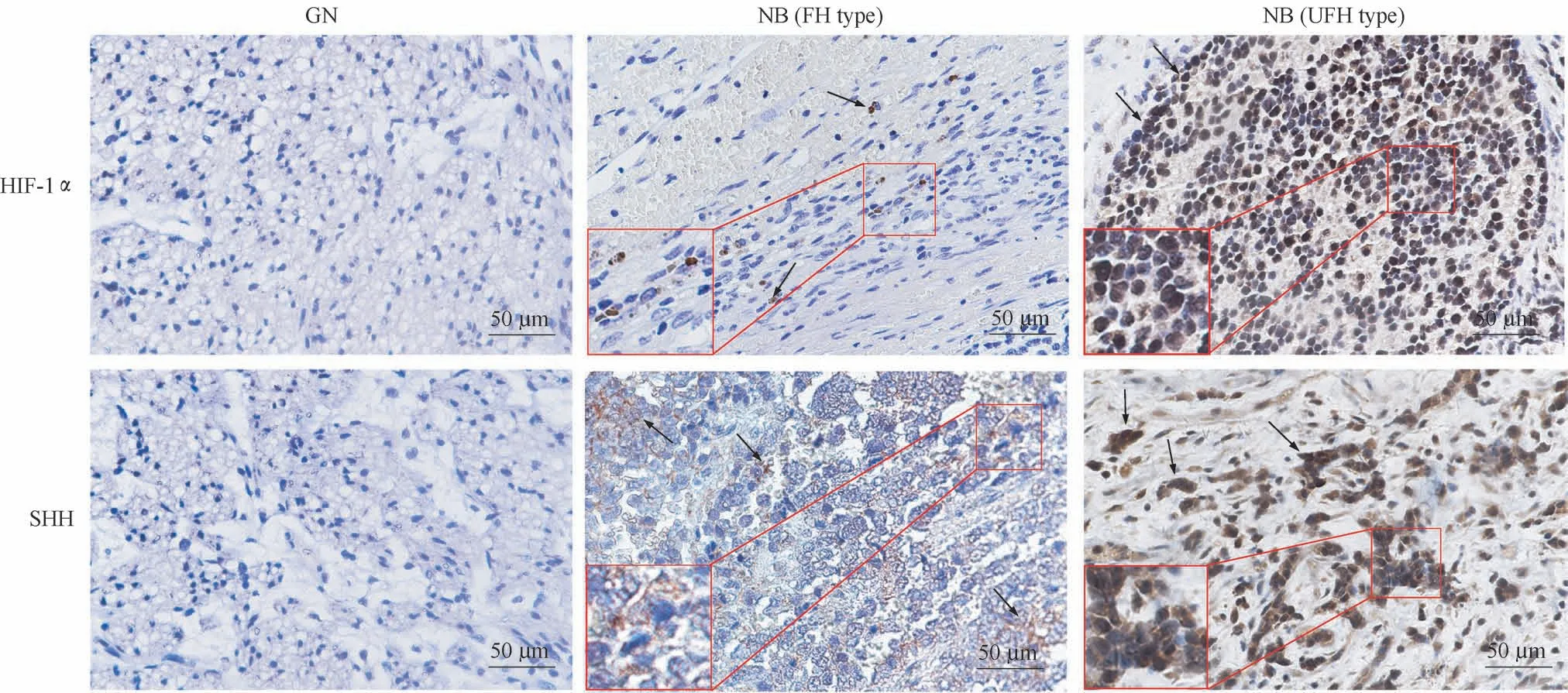
图1 HIF-1α、SHH在GN和NB中的典型表达Fig 1 Typical expression of HIF-1αand SHH in GN and NB
2.4 HIF-1α、SHH表达水平和NB预后相关
去除失访病例,92例NB患儿中位随访时间为7.1年(5.1年~11.4年)。Kaplan-Meier生存分析显示,HIF-1α高表达组的5年OS率和EFS率均低于HIF-1α低表达组,差异有统计学意义(OS率:40.9%vs75.7%,P=0.001;EFS率:40.9%vs70.0%,P=0.008)(图2)。SHH高表达组的5年OS率、EFS率也同样低于SHH低表达组,差异有统计学意义(OS率:42.9%vs78.1%,P=0.000;EFS率:39.3%vs73.4%,P=0.001)(图2)。
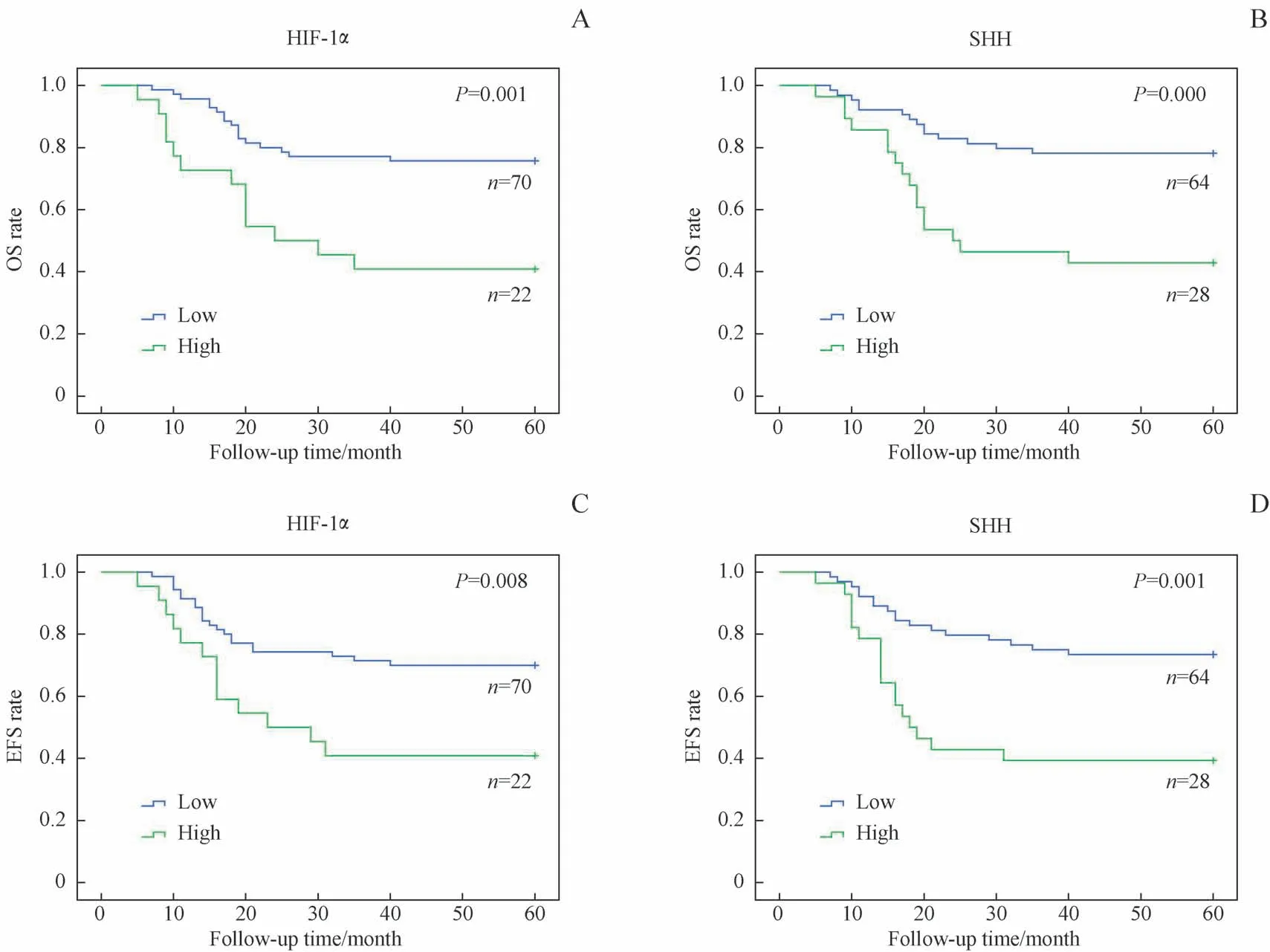
图2 NB患儿中HIF-1α、SHH的表达水平和预后的关系Fig 2 Relationship between theexpression levels of HIF-1α/SHH and theprognosis in NBpatients
3 讨论
肿瘤微环境中,低氧通过调节与细胞增殖、凋亡、黏附、代谢、血管生成等相关基因的转录,使肿瘤细胞增殖性、耐药性、侵袭力增加[11-12]。HIF-1是细胞在低氧下调节生理功能的重要转录因子,可调节与氧气输送、利用,以及葡萄糖代谢有关的1 000多种人类基因的表达[13-14]。HIF-1是一个异二聚体,由氧调节性表达的α-亚基和组成性表达的β-亚基构成。常氧下α-亚基中的2个关键脯氨酸残基会被羟化,在von Hippel-Lindau肿瘤抑制蛋白的作用下,HIF-1α被泛素化,随后被蛋白酶体降解;低氧下α-亚基的降解被阻断,其表达升高,并促进下游靶基因转录[13-14]。有文献[7,15-16]报道,在包括NB在内的一些恶性肿瘤中,HIF-1α高表达可增加肿瘤细胞的恶性程度,促进其生长侵袭,并提示不良预后。
SHH信号通路在胚胎发育和组织分化中起到重要作用,但是该通路的异常激活会导致细胞过度增殖,有产生肿瘤的风险[17]。研究[18]证明,NB中该信号通路存在异常激活,阻断该通路后可有效抑制NB生长,促进凋亡,降低MYCN的表达水平。本课题组前期研究[7]发现,在NB中HIF-1α可正向调控SHH信号通路,通过激活该通路实现HIF-1α促NB生长的效应。本研究在较大样本量的NB病例中测定HIF-1α/SHH信号通路的表达,并将其和患者的临床特征、远期预后相联系,探索该通路的临床意义。
HIF-1α在NB中的作用仍有争议。Dungwa等[19]发现NB中HIF-1α高表达与高的INSS分期、UFH病理类型、高危分组等临床特征密切相关,并提示患儿的不良预后。但也有研究[20]结论与之相反,即HIF-1α高表达的NB患儿倾向于有更低的INSS分期、更高的5年OS率。GN同样起源于交感神经节的原始神经嵴细胞,和NB是同一家族的肿瘤,但GN组织分化成熟,是良性肿瘤。本研究发现HIF-1α、SHH在GN中均低表达,而在NB中表达升高,尤其在进展期NB中表达更高;说明HIF-1α/SHH信号通路激活和NB的恶性表型相关,也可能在NB的发生、发展以及组织分化中起到重要作用。3、4期以及UFH型NB的HIF-1α、SHH表达水平高于1、2期以及FH型NB,有局部淋巴结转移的NB中HIF-1α、SHH表达水平同样升高,这进一步说明HIF-1α/SHH信号通路激活可能是NB进展、转移、去分化的分子机制。在本研究中,NB的HIF-1α和SHH表达水平呈正相关,也证实HIF-1α对SHH通路的正向调控作用。我们也发现HIF-1α、SHH高表达组的5年OS率、EFS率均降低,提示HIF-1α/SHH信号通路激活可能预示NB患儿的不良预后,可作为年龄、分期、MYCN基因扩增、病理类型等已知的NB预后因素的补充条件,进一步增加判断NB预后的准确性。
原癌基因MYCN扩增在促进NB生长、侵袭、转移、血管生成等方面发挥重要作用,强烈提示NB的不良预后[21-22]。MYCN在NB中的扩增率为10%~25%,在进展期NB中扩增率更高[23]。HIF-1α/SHH信号通路和MYCN扩增之间的关系尚不明确,需进一步研究。本研究中MYCN的扩增率为11.9%(12/101),我们未发现MYCN扩增组和非扩增组之间HIF-1α和SHH的表达差异,无法提示HIF-1α/SHH信号通路和MYCN之间的调控关系,这也可能和NB中MYCN的扩增率较低有关。
综上所述,HIF-1α、SHH表达升高和NB高的INSS分期、局部淋巴结转移、UFH病理分型等临床特征密切相关,并预示NB患儿的不良预后。因此,HIF-1α/SHH信号通路激活可能在NB发生发展中起到重要作用,该信号通路可能是NB潜在的生物标志物和治疗靶点。
参·考·文·献
[1] Tas ML,Reedijk AMJ,Karim-Kos HE,et al.Neuroblastoma between 1990 and 2014 in the netherlands:increased incidence and improved survival of high-risk neuroblastoma[J].Eur JCancer,2020,124:47-55.
[2] 张安安,潘慈,叶启东,等.4期神经母细胞瘤综合治疗的远期随访观察[J].中华医学杂志,2014,94(20):1547-1552.
[3] 连烜晔,崔晶.低氧对肿瘤转移的促进作用[J].癌症进展,2019,17(10):1139-1142.
[4] Hapke RY,Haake SM. Hypoxia-induced epithelial to mesenchymal transition in cancer[J].Cancer Lett,2020,487:10-20.
[5] Zhang L,Marrano P,Wu B,et al.Combined antitumor therapy with metronomic topotecan and hypoxia-activated prodrug,evofosfamide,in neuroblastoma and rhabdomyosarcoma preclinical models[J].Clin Cancer Res,2016,22(11):2697-2708.
[6] Yu T,Li L,Liu W,et al.Silencing of NADPH oxidase 4 attenuates hypoxia resistance in neuroblastoma cells SH-SY5Y by inhibiting PI3K/Aktdependent glycolysis[J].Oncol Res,2019,27(5):525-532.
[7] Chen S,Zhang M,Xing L,et al.HIF-1αcontributes to proliferation and invasiveness of neuroblastoma cellsviaSHH signaling[J].PLoSOne,2015,10(3):e0121115.
[8] Sun W,Zhang L,Hou L,et al.Isatin inhibits SH-SY5Y neuroblastoma cell invasion and metastasis through MAO/HIF-1α/CXCR4 signaling[J].Anticancer Drugs,2017,28(6):645-653.
[9] Xiao Y,Qu C,Ge W,et al.Depletion of thymosinβ4 promotes the proliferation,migration,and activation of human hepatic stellate cells[J].Cell Physiol Biochem,2014,34(2):356-367.
[10] 陈康,荚卫东,葛勇胜,等.KLK7在肝细胞癌中的表达及其意义[J].安徽医科大学学报,2019,54(10):1637-1641.
[11] Miranda-Galvis M, Teng Y. Targeting hypoxia-driven metabolic reprogramming to constrain tumor progression and metastasis[J].Int JMol Sci,2020,21(15):5487.
[12] Xiong Q,Liu B,Ding M,et al.Hypoxia and cancer related pathology[J].Cancer Lett,2020,486:1-7.
[13] Koyasu S,Kobayashi M,Goto Y,et al.Regulatory mechanisms of hypoxiainducible factor 1 activity:two decades of knowledge[J].Cancer Sci,2018,109(3):560-571.
[14] Sousa Fialho MDL,Abd Jamil AH,Stannard GA,et al.Hypoxia-inducible factor 1 signalling, metabolism and its therapeutic potential in cardiovascular disease[J].Biochim Biophys Acta Mol Basis Dis,2019,1865(4):831-843.
[15] Lin CS,Liu TC,Lee MT,et al.Independent prognostic value of hypoxiainducible factor 1-αexpression in small cell lung cancer[J].Int JMed Sci,2017,14(8):785-790.
[16] Sowa T,Menju T,Chen-Yoshikawa TF,et al.Hypoxia-inducible factor 1 promotes chemoresistance of lung cancer by inducing carbonic anhydraseⅨexpression[J].Cancer Med,2017,6(1):288-297.
[17] Doheny D,Manore SG,Wong GL,et al.Hedgehog signaling and truncated GLI1 in cancer[J].Cells,2020,9(9):2114.
[18] Wickström M,Dyberg C,Shimokawa T,et al.Targeting the hedgehog signal transduction pathway at the level of GLI inhibits neuroblastoma cell growthin vitroandin vivo[J].Int JCancer,2013,132(7):1516-1524.
[19] Dungwa JV,Hunt LP,Ramani P.HIF-1αup-regulation is associated with adverse clinicopathological and biological factors in neuroblastomas[J].Histopathology,2012,61(3):417-427.
[20] Noguera R,Fredlund E,Piqueras M,et al.HIF-1αand HIF-2αare differentially regulatedin vivoin neuroblastoma:high HIF-1αcorrelates negatively to advanced clinical stage and tumor vascularization[J].Clin Cancer Res,2009,15(23):7130-7136.
[21] Dzieran J,Rodriguez Garcia A,Westermark UK,et al.MYCN-amplified neuroblastoma maintains an aggressive and undifferentiated phenotype by deregulation of estrogen and NGF signaling[J].Proc Natl Acad Sci U SA,2018,115(6):E1229-E1238.
[22] 汤梦婕,袁晓军,安霞,等.转移性神经母细胞瘤伴骨和骨髓转移的治疗疗效及预后分析[J].中华转移性肿瘤杂志,2019(03):18-24.
[23] Lee JW,Son MH,Cho HW,et al.Clinical significance of MYCN amplification in patients with high-risk neuroblastoma[J].Pediatr Blood Cancer,2018,65(10):e27257.

