MRPL12在肺腺癌中的表达和预后分析
熊 雷,易 茜,许明芳,陈 健
1.重庆市渝北区人民医院门诊手术室,重庆 401120;2.重庆佑佑宝贝妇儿医院儿内科,重庆 401120;3.陆军特色医疗中心肿瘤科,重庆 400042
在中国乃至全世界肺癌都是发病率最高的癌症,2018年全球新增肺癌病例约210万例,死亡约176万例[1-2]。因此,寻找有效的早期检测和预后判断的生物标志物对于肺癌的预防和治疗有着重要的意义[3]。线粒体功能障碍是大多数肿瘤的特征之一,近年来以线粒体核糖体为靶点治疗癌症已成为研究热点[4-7]。线粒体核糖体蛋白L12(mitochondrial ribosomal protein L12,MRPL12)是线粒体核糖体39S大亚基的一个组成蛋白,调节核糖体mRNA的翻译[8]。另外,它还能直接与线粒体RNA聚合酶结合调节线粒体基因表达,并且与细胞增殖密切相关[9-10]。MRPL12蛋白的编码基因位于染色体17q25[8],并且此区域的基因在肺腺癌(lung adenocarcinoma,LUAD)中转录普遍增强[11]。关于MRPL12表达与癌症的关系目前罕见文献报道。本研究主要分析MRPL12在LUAD中的表达和与预后的关系,并探讨MRPL12在LUAD中可能参与的生物学过程,为临床治疗和药物研发提供理论依据。
1 材料与方法
1.1 差异表达分析
通过肿瘤浸润性免疫细胞分析数据库TIMER2.0(https://cistrome.shinyapps.io/timer/)的Gene_DE模块分析癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库中MRPL12在肿瘤和相邻正常组织之间的差异表达,采用Wilcoxon秩和检验计算统计显著性[12]。再利用GEPIA(gene expression profiling and interactive analyses)交互式网站服务器(http://gepia2.cancer-pku.cn/#index)验证,差异基因检验方法选择方差分析(analysis of variance,ANOVA)[13]。综 合2个 分 析 平 台,筛 选MRPL12差异表达可能性高的癌症类型。
1.2 生存分析
利用Sangerbox生物信息分析平台[13](http://sangerbox.com/Gene?search1=MRPL12&page=1)对MRPL12差异表达的癌症类型进行预后生存分析,采用Cox回归模型和Kaplan-Meier生存分析模型2种方法相互印证,并评估了风险比(hazard ratio,HR)、95%置信区间(confidenceinterval,CI)和LogrankP值,P<0.05表示差异具有统计学意义。
1.3 蛋白表达分析
在UALCAN数据分析平台(http://ualcan.path.uab.edu/analysis-prot.html)中,根据患者的样本类型(sample type)、肿瘤分级(tumor grade)、肿瘤分期(individual cancer stage)分析MRPL12的蛋白表达[14],差异评估方法采用t检验,P<0.05表示差异具有统计学意义。
1.4 相关基因筛选
LinkedOmics(http://www.linkedomics.org/admin.php)能在线分析32种癌症的多组学数据[15]。基于TCGA_LUAD数据集,利用LinkedOmics分析与MRPL12表达呈正相关和负相关的基因。统计方法选择Pearson相关性分析,以相关系数和P值衡量相关性,P<0.05表示结果有统计学意义。
1.5 KEGG通路富集分析
采用DAVID数据库(https://david.ncifcrf.gov/home.jsp)对与MRPL12表达呈正相关或负相关的前1 000个基因进行京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析[16]。P<0.05表示相关的通路有统计学意义。
1.6 细胞培养和定量聚合酶链反应实验
实验所用细胞均购自上海酶研生物科技有限公司,并已通过短串联重复序列(short tandem repeat,STR)鉴定。人正常肺上皮细胞Beas-2B用含有10%胎牛血清和1%青霉素-链霉素的DMEM培养液,置于37℃、5%CO2的孵箱中培养。人LUAD细胞(H1395、H1975、PC-9和HCC827)用含有10%胎牛血清和1%青霉素-链霉素的RPMI-1640培养液,置于37℃、5%CO2的孵箱中培养。收集处于对数生长期的细胞,用TRIzol法提取总RNA,紫外分光光度仪测定RNA浓度和纯度,GoScript Reverse Transcription System试剂盒对提取的总RNA反转录,以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参,2-ΔΔCT法计算MRPL12的相对表达量。定量聚合酶链反应(quantitative PCR,qPCR)引物如下:5′-CTGGGCTACACTGAGCACC-3′和5′-AAGTGGTCGTTGAGGGCATG-3′(GAPDH);5′-TGTGGGGGCCTTGCCTTGGGCTT-3′和5′-ATGGCCGC TGCTCCTCATATGTCGCA-3′(MRPL12)。统计学方法为独立样本t检验,P<0.05表示差异具有统计学意义。
2 结果
2.1 MRPL12的mRNA表达水平
根据TCGA数据库中恶性肿瘤的转录组测序(RNA sequence,RNA-seq)数据,我们研究了MRPL12在不同恶性肿瘤和正常组织中的表达水平。综合TIMER和GEPIA的统计结果,MRPL12在以下6种癌症类型中显著高表达(图1):膀胱尿路上皮癌(bladder urothelial carcinoma,BLCA)、宫颈鳞状细胞癌(cervical squamous cell carcinoma,CESC)、结 肠 腺 癌(colon adenocarcinoma,COAD)、LUAD、肺鳞状细胞癌(lung squamous cell carcinoma,LUSC)、子宫内膜癌(uterine corpus endometrial carcinoma,UCEC)。
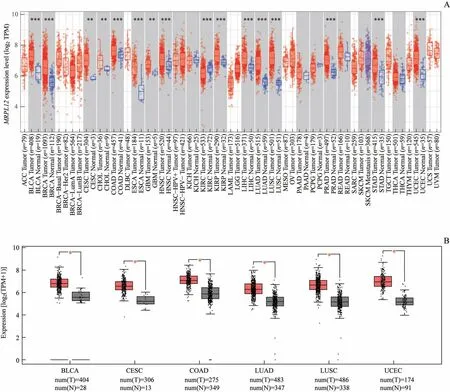
图1 MRPL12在不同癌症中的转录水平Fig.Expression levelsof MRPL12 in different cancers
2.2 MRPL12对LUAD患者生存的影响
根据恶性肿瘤组织中MRPL12的mRNA表达的差异,我们进一步分析了这些组织中MRPL12表达与预后的关系。通过Cox回归模型分析MRPL12与这6种癌症预后的关系,在LUAD中MRPL12表达变化与预后总体生存期(overall suivival,OS)和疾病特异性生存期(disease-specific survival,DSS)的相关性有统计学意义(图2A、B)。Kaplan-Meier曲线与Cox回归分析结果一致,LUAD患者MRPL12高表达组的OS以及DSS均较低(图2C、D)。MRPL12的表达与BLCA、CESC、COAD、LUSC、UCEC患者OS和DSS的关系无统计学意义。
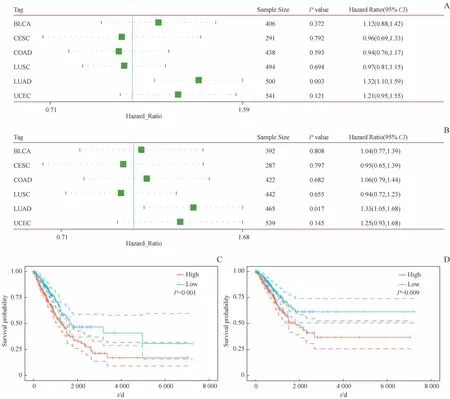
图2 LUAD患者MRPL12表达与OS和DSS的关系Fig 2 Relationship between MRPL12 expression and OSand DSSin LUAD patients
2.3 MRPL12的蛋白表达水平
为了验证MRPL12在LUAD组织中的蛋白表达水平及与临床病理参数的关系,我们从UALCAN数据分析平台下载美国临床蛋白质组肿瘤分析协会(Clinical Proteomic Tumor Analysis Consortium,CPTAC)的蛋白表达数据进行分析发现:MRPL12在LUAD组织中的蛋白表达水平显著高于正常组织(图3A);肿瘤分级越高,MRPL12蛋白表达水平越高(图3B);不同肿瘤分期的MRPL12蛋白表达水平也均显著高于正常组织(图3C)。

图3 LUAD组织中MRPL12的蛋白表达水平与临床病理参数的关系Fig 3 Relationship between protein expression of MRPL12 and clinicopathological parametersin LUAD tissues
2.4 MRPL12相关基因分析
通过LinkedOmics数据库分析LUAD组织中与MRPL12表达相关的基因,以P<0.01、r>0.4或r<-0.4为界限,共检索到1 091个正相关基因和1 126个负相关基因(图4A)。MRPL12的表达与MYC结合蛋白2(MYC binding protein 2,MYCBP2)呈负相关(r=-0.695,P=0.000,图4B),与ANAPC11(anaphase-promoting complex subunit 11)呈 正 相 关(r=0.840,P=0.000,图4C)。为了分析MRPL12的功能,我们用DAVID数据库进行KEGG通路富集分析。其中,与MRPL12表达负相关的基因富集到癌症通路(P=0.000)、癌症蛋白聚糖(P=0.000)、非小细胞肺癌(P=0.000)等癌症相关的通路(图5),与MRPL12表达正相关的基因KEGG通路富集分析结果无统计学意义。

图4 基于Linked Omics数据库的LUAD组织MRPL12相关基因分析Fig 4 MRPL12 co-expression genes in LUAD tissuesbased on LinkedOmicsdatabase
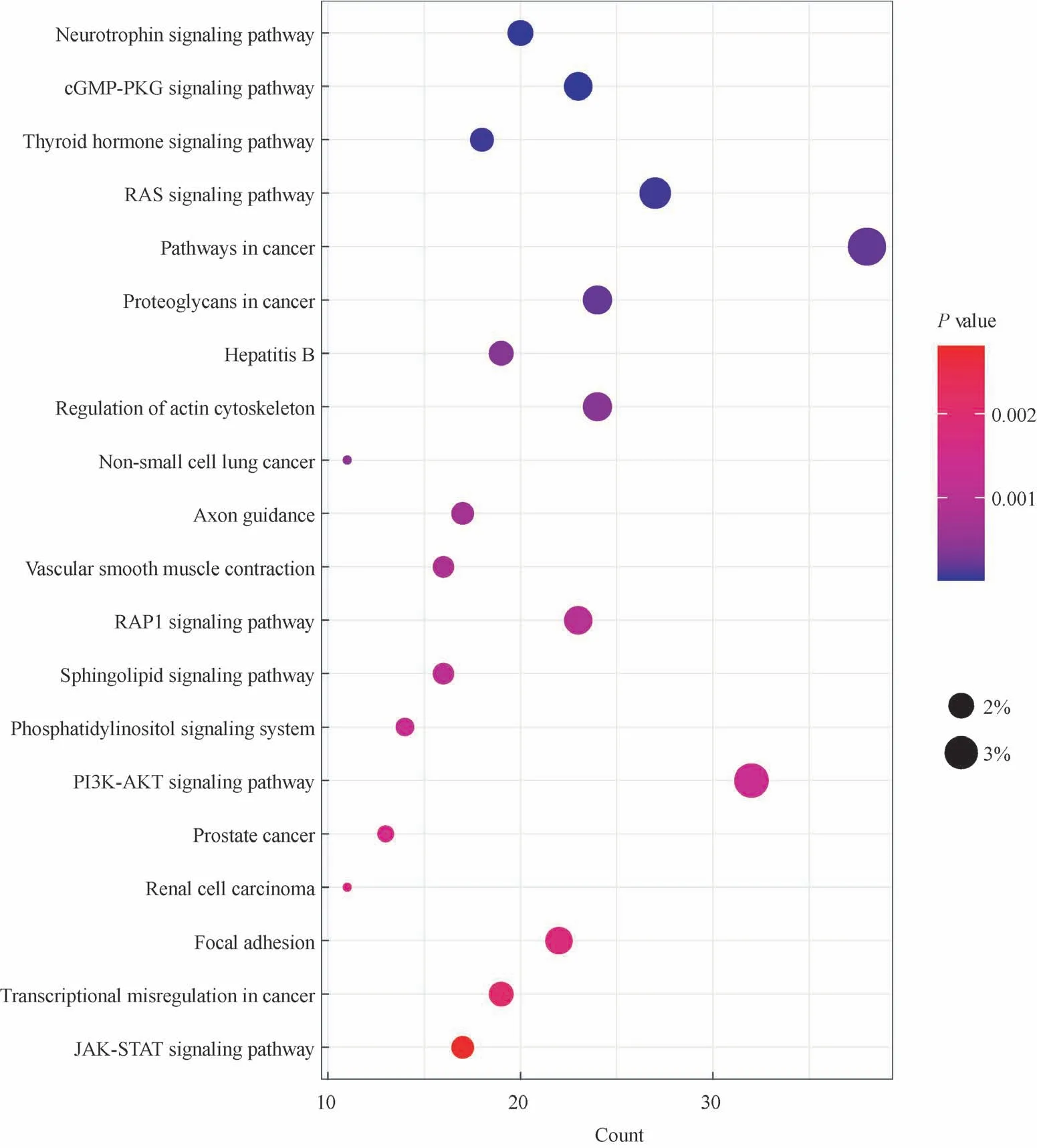
图5 LUAD组织中与MRPL12负相关基因的KEGG通路富集分析Fig 5 KEGG enrichment analysis of MRPL12-negatively-correlated genesin LUAD tissues
2.5 qPCR验证MRPL12在细胞中的表达
利用qPCR方法检测MRPL12在人正常肺上皮细胞(Beas-2B)和人LUAD细胞(H1395、H1975、PC-9和HCC827)中的表达。结果显示(图6),MRPL12在LUAD细胞(H1395、H1975和HCC827)中的mRNA转录水平高于正常细胞(Beas-2B),差异具有统计学意义。
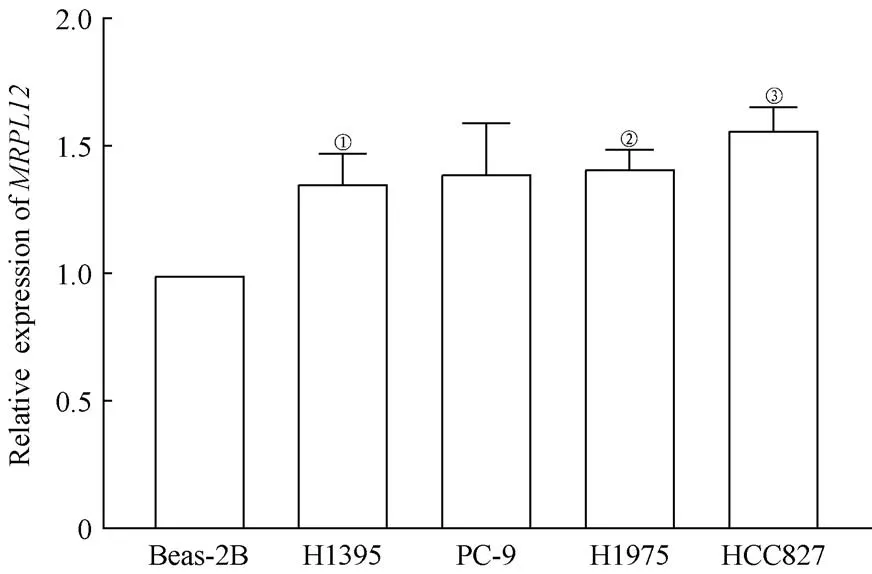
图6 MRPL12在细胞系中的mRNA表达水平Fig 6 ThemRNA expression levels of MRPL12 in cell lines
3 讨论
肺癌最常见的亚型是非小细胞肺癌(non-small cell lung carcinoma,NSCLC),NSCLC又分为鳞状细胞癌、大细胞癌和腺癌,临床上约50%的肺癌患者被诊断为LUAD[17]。由于大多数患者都是在癌症晚期被诊断出来,经过手术、放射治疗和化学治疗(化疗)等综合治疗后,其5年生存率也很难超过15%[18-19]。近年来,新的分子靶点的发现,推动了靶向治疗和免疫治疗等新疗法的发展。NSCLC亚型的治疗进展很大程度上得益于下一代测序(next generation sequencing,NGS)技术对分子知识的积累。例如,表皮生长因子受体(epidermal growth factor receptor,EGFR)酪氨酸激酶在62%的NSCLC中过表达,并且与较差的预后相关。以奥斯替尼(osimertinib)为代表的EGFR靶向抑制剂已在晚期NSCLC患者的治疗中占据重要地位,奥斯替尼将患者的中位无进展生存期(median progression-free survival,mPFS)延长到了18.9个月[20]。另外,美国食品药品监督管理局(Food and Drug Administration,FDA)在2017年批准间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)抑制剂色瑞替尼(ceritinib)用于治疗ALK阳性的转移NSCLC患者,治疗客观缓解率达到73%,是传统化疗的2倍以上[21]。因此,治疗靶点的发现对药物开发和肺癌治疗具有重要作用。使用高通量测序的全基因组分子研究,将基因的表达、突变、重排等特征与临床样本的病理参数结合将会发现更多的癌症生物标志物和治疗靶点。TCGA数据库收录了人类各种癌症及其亚型的基因组变异、mRNA表达、miRNA表达、甲基化和临床数据,是癌症研究很重要的数据来源。我们根据TCGA的LUAD数据集评估了MRPL12的表达和对预后生存的影响,提出MRPL12是潜在的LUAD预后的生物标志物和治疗靶点。
MRPL12是由核基因编码的一种MRPs,被认为是线粒体mRNA翻译的调节因子[9,22]。哺乳动物线粒体核糖体由28S小亚基和39S大亚基组成,大小亚基分别包含29个MRPs和50个MRPs[6,23]。据报道[6],部分MRPs可能在肿瘤发生过程中发挥功能性作用。由于线粒体和细菌核糖体相似,利用阿奇霉素(azithromycin)和强力霉素(doxycycline)等抗生素靶向线粒体核糖体在多种癌症中表现出抑制肿瘤球形成的作用[24]。其中,阿奇霉素直接与细菌核糖体的50S亚基结合,并特异性抑制线粒体mRNA翻译,而50S的细菌核糖体与39S的线粒体核糖体同源,这证明了靶向线粒体核糖体可能是对抗特定肿瘤的一种新方法。MRPL12基因编码线粒体核糖体39S大亚基的一个组成蛋白,与叶绿体和细菌的L12核糖体蛋白同源[25]。MRPL12除了调控线粒体mRNA翻译的功能,还被证实直接绑定并激活线粒体RNA聚合酶(mitochondrial RNA polymerase,POLRMT),因此其在线粒体转录和翻译中都发挥了作用[26]。MRPL12突变导致成纤维细胞生长阻滞,线粒体翻译缺陷,环氧化酶1(cyclooxygenase-1,COX-1)、COX-2和COX-3合成显著减少[10]。在乳腺癌细胞中,MRPL12、DNA聚合酶γ(DNA polymerase gamma,POLG)和核糖核酸酶H1(ribonuclease H1,RNASEH1)上调可能导致线粒体增加,促进细胞增殖[27]。然而,MRPL12与其他癌症的关系还没有研究报道,具体机制尚不清楚。
LUAD组织和正常组织中MRPL12表达量比较分析发现,MRPL12在LUAD组织中明显高表达,提示MRPL12可能是LUAD中的一个重要的促癌基因。进一步分析MRPL12蛋白与LUAD患者临床病理参数的关系,结果表明MRPL12表达水平与LUAD分期以及分级呈正相关,说明肿瘤分化和扩散程度越高,MRPL12表达水平越高。另外,Cox回归和Kaplan-Meier 2种生存分析都表明,MRPL12高表达的LUAD患者预后OS和DSS都较差。综合以上结果表明,MRPL12基因高表达可能是LUAD预后的一种不利因素。为了进一步探索MRPL12在LUAD中可能的作用机制,我们通过LinkedOmics数据库分析与MRPL12密切相关的基因,并分为正相关和负相关2组。有趣的是,与MRPL12呈负相关,并且相关性较高的基因富集到许多癌症相关的通路,直接和NSCLC相关的通路也在其中,更加确认了MRPL12与LUAD的相关性。值得注意的是,MYCBP2是与MRPL12负相关最显著的基因(r=-0.695,P=0.000)。MYCBP2可能是一个E3泛素连接酶,特异性地与MYC原癌基因(MYC proto-oncogene,MYC)蛋白结合,促进MYC降解[28-29]。MYC癌基因家族的激活或扩增是癌症的特征之一[30]。我们可以假设MRPL12的高表达抑制MYCBP2,从而使MYC累积,促进癌症发展,这将是我们下一步需要验证的问题。
本研究主要通过TCGA数据库数据分析MRPL12在LUAD中的表达及临床意义,提出MRPL12基因具有作为LUAD临床预后指标和治疗靶点的潜力,并且初步探讨了MRPL12在LUAD中可能的分子机制与信号通路。本研究结果为下一步细胞和动物水平的实验提供了理论基础。
参·考·文·献
[1] Bray F,Ferlay J,Soerjomataram I,et al.Global cancer statistics 2018:globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J].CACancer JClin,2018,68(6):394-424.
[2] Wu C,Li M,Meng H,et al.Analysis of status and countermeasures of cancer incidence and mortality in China[J].Sci China Life Sci,2019,62(5):640-647.
[3] Villalobos P,Wistuba II.Lung cancer biomarkers[J].Hematol Oncol Clin North Am,2017,31(1):13-29.
[4] Lennon FE,Salgia R.Mitochondrial dynamics:biology and therapy in lung cancer[J].Expert Opin Investig Drugs,2014,23(5):675-692.
[5] Porporato PE,Filigheddu N,Pedro JMB,et al.Mitochondrial metabolism and cancer[J].Cell Res,2018,28(3):265-280.
[6] Kim HJ,Maiti P,Barrientos A.Mitochondrial ribosomes in cancer[J].Semin Cancer Biol,2017,47:67-81.
[7] Senft D,Ronai ZA.Regulators of mitochondrial dynamics in cancer[J].Curr Opin Cell Biol,2016,39:43-52.
[8] Marty L,Taviaux S,Fort P. Expression and human chromosomal localization to 17q25 of the growth-regulated gene encoding the mitochondrial ribosomal protein MRPL12[J].Genomics,1997,41(3):453-457.
[9] Wang ZB,Cotney J,Shadel GS.Human mitochondrial ribosomal protein MRPL12 interacts directly with mitochondrial RNA polymerase to modulate mitochondrial gene expression[J].J Biol Chem,2007,282(17):12610-12618.
[10] Serre V,Rozanska A,Beinat M,et al.Mutations in mitochondrial ribosomal protein MRPL12 leads to growth retardation,neurological deterioration and mitochondrial translation deficiency[J].Biochim Biophys Acta,2013,1832(8):1304-1312.
[11] Sy SM,Wong N,Mok TS,et al.Genetic alterations of lung adenocarcinoma in relation to smoking and ethnicity[J].Lung Cancer,2003,41(1):91-99.
[12] Li T,Fu J,Zeng Z,et al.TIMER2.0 for analysis of tumor-infiltrating immune cells[J].Nucleic Acids Res,2020,48(w1):W509-W514.
[13] Tang ZF,Li CW,Kang BX,et al.GEPIA:a web server for cancer and normal gene expression profiling and interactive analyses[J].Nucleic Acids Res,2017,45(W1):W98-W102.
[14] Chandrashekar DS,Bashel B,Balasubramanya SAH,et al.UALCAN:a portal for facilitating tumor subgroup gene expression and survival analyses[J].Neoplasia,2017,19(8):649-658.
[15] Vasaikar SV,Straub P,Wang J,et al.LinkedOmics:analyzing multi-omics data within and across 32 cancer types[J].Nucleic Acids Res,2018,46(d1):D956-D963.
[16] Huang DW,Sherman BT,Lempicki RA.Systematic and integrative analysis of large gene lists using DAVID bioinformatics resources[J].Nat Protoc,2009,4(1):44-57.
[17] Pao W,Girard N.New driver mutations in non-small-cell lung cancer[J].Lancet Oncol,2011,12(2):175-180.
[18] Cagle PT,Allen TC,Olsen RJ.Lung cancer biomarkers:present status and future developments[J].Arch Pathol Lab Med,2013,137(9):1191-1198.
[19] 邓垒,张文珏,周宗玫,等.327例广泛期小细胞肺癌综合治疗的疗效分析[J].国际放射医学核医学杂志,2018,42(1):1-8.
[20] Soria JC,Ohe Y,Vansteenkiste J,et al.Osimertinib in untreatedEGFR-mutated advanced non-small-cell lung cancer[J].N Engl JMed,2018,378(2):113-125.
[21] Soria JC,Tan DSW,Chiari R,et al.First-line ceritinibversusplatinumbased chemotherapy in advanced ALK-rearranged non-small-cell lung cancer(ASCEND-4):a randomised,open-label,phase 3 study[J].Lancet,2017,389(10072):917-929.
[22] Surovtseva YV,Shutt TE,Cotney J,et al.Mitochondrial ribosomal protein L12 selectively associates with human mitochondrial RNA polymerase to activate transcription[J].PNAS,2011,108(44):17921-17926.
[23] Amunts A,Brown A,Toots J,et al.Ribosome.The structure of the human mitochondrial ribosome[J].Science,2015,348(6230):95-98.
[24] Lamb R,Ozsvari B,Lisanti CL,et al.Antibiotics that target mitochondria effectively eradicate cancer stem cells,across multiple tumor types:treating cancer likean infectiousdisease[J].Oncotarget,2015,6(7):4569-4584.
[25] Marty L,Fort P.A delayed-early response nuclear gene encoding MRPL12,the mitochondrial homologue to the bacterial translational regulator L7/L12 protein[J].JBiol Chem,1996,271(19):11468-11476.
[26] Nouws J,Goswami AV,Bestwick M,et al.Mitochondrial ribosomal protein L12 is required for POLRMT stability and exists as two forms generated by alternative proteolysis during import[J].J Biol Chem,2016,291(2):989-997.
[27]Zhang QL,Liang Z,Gao YX,et al.Differentially expressed mitochondrial genes in breast cancer cells:potential new targets for anti-cancer therapies[J].Gene,2017,596:45-52.
[28] Vatapalli R,Sagar V,Rodriguez Y,et al.Histone methyltransferase DOT1L coordinates AR and MYC stability in prostate cancer[J].Nat Commun,2020,11(1):4153.
[29] Ge Z,Guo X,Li JY,et al.Clinical significance of highc-MYCand lowMYCBP2expression and their association withIkarosdysfunction in adult acute lymphoblastic leukemia[J].Oncotarget,2015,6(39):42300-42311.
[30] Müller J,Eilers M.Ubiquitination of Myc:proteasomal degradation and beyond[J].Ernst Schering Found Symp Proc,2008(1):99-113.

