恒定性外斜视视网膜微血流及厚度初步分析
罗丽颖,唐 敏,项潇琼,傅 扬
上海交通大学附属第一人民医院眼科,上海市眼底病重点实验室,上海 200080
恒定性斜视是儿童和成人外斜视中常见的一种类型,常常伴随视疲劳、复视、恶心、头痛等症状,严重影响患者的外观及生活质量[1]。恒定性外斜视是恒定性斜视中最常见的斜视类型,临床上对于该病的治疗以手术矫正为主。目前关于该病的确切病因尚不清楚,部分患者术后效果不理想,需要多次手术矫正[2],因此探讨恒定性斜视的发病机制对于疾病的诊治有重要意义。目前认为恒定性外斜视的发病原因可能与先天发育异常、眼部解剖结构异常、屈光与调节异常、神经支配异常等因素相关。
光学相干断层扫描血管造影(optical coherence tomography angiography,OCTA)技术作为一种全新的无创可量化分析的新型血管成像技术[3],能够识别浅层、深层血管丛以及脉络膜等多层结构[4-5]并定量分析视网膜血流状态,同时可以避免因注射血管造影剂荧光素钠引起的一系列不良反应。OCTA技术还具有快捷、可重复的优点,具有较好的临床应用前景。分频幅去相干血管成像(split spectrum amplitude decorrelation angiography,SSADA)技术是一种应用于OCTA提高信噪比的计算方法,可提高各层血管形态的成像质量[6]。与其他算法相比,SSADA可以显著提高检测血流的信噪比和微血管网络的连贯性,并提高各层血管的成像质量[7]。
目前,应用OCTA检测恒定性外斜视患者视网膜微循环及黄斑区厚度分析的相关报告相对较少。基于此,本研究采用OCTA技术,对恒定性外斜视患者视网膜浅层和深层血流密度、黄斑中心凹无灌注区(foveal avascular zone,FAZ)面积、内层以及全层视网膜厚度进行定量分析,以探讨患者黄斑区微循环及微结构的改变,并对OCTA对恒定性外斜视的应用价值进行探讨。
1 对象与方法
1.1 研究对象
纳入2019年1月—12月于上海交通大学附属第一人民医院眼科就诊的恒定性外斜视患者29例,作为试验组。选取同期就诊于医院眼科门诊,双眼矫正视力正常,眼位未出现异常,排除其他眼部疾病或外伤史的成年患者27例作为对照组。纳入标准:①患者确诊为恒定性外斜视,斜视度数范围35△~50△。②年龄≥18岁。③患者依从性较好。④患者双眼矫正视力≥1.0。排除标准:①有神经系统疾病及其他可能导致斜视的器质性病变(包括眼眶肿瘤、眼肌麻痹等)。②有眼眶外伤史、眼部手术史。③有其他眼部疾病,如视网膜脱落、黄斑病变、屈光参差及屈光介质浑浊等。④合并可能改变视网膜微血管血流的系统性疾病(包括高血压、糖尿病、心血管疾病等)。⑤患者依从性较差。研究经医院伦理委员会审批(伦理编号:2020113)。所有研究对象均签署知情同意书。
1.2 方法
1.2.1 一般检查 所有患者进行常规眼科检查,包括屈光度、验光、眼压、眼球运动及眼位情况、眼轴测量、裂隙灯下眼前节和眼后段检查等。采用IOLMaster(德国ZEISS公司)对患者眼轴进行测量。采用非接触眼压计(日本Canon公司)测量患者眼压。采用遮盖与去遮盖法观察患者眼位情况。在诊室内通过裂隙灯对患者双眼的眼前段及眼后段进行检查自然瞳孔下验光,得到屈光度及最佳矫正视力(best corrected visual acuity,BCVA),计算等效球镜度数(Spherical equivalent,SE)。
1.2.2 OCTA检查 由同一位经验丰富的医师对所有患者进行OCTA检查。本研究采用RTVue-XRAvanti(美国Optovue公司)自带的AngioVue软件对浅层视网膜毛细血管层(superficial capillary plexus,SCP)、深层视网膜毛细血管层(deep capillary plexus,DCP)、FAZ及视网膜厚度进行检测,选择3 mm×3 mm黄斑区域进行扫描并对上述扫描结果进行分析。SCP图像扫描区域为内边界低于内界膜3μm,以及外边界低于内丛状层15μm的范围。DCP图像扫描区域为内边界低于内丛状层下方15μm,以及外边界低于内丛状层下方71μm的范围(图1)。视网膜厚度图显示中心凹及各方向的内层、全层视网膜的厚度值(图2)。内层视网膜厚度为内界膜(internal limiting membrane,ILM)到内丛状层(inner plexiform layer,IPL)之间的距离,全层视网膜厚度为内界膜到视网膜色素上皮层(retinal pigment epithelium,RPE)之间的距离。OCTA扫描质量指数(scan quality index,SQI)<7或者>7但有明显伪影则被剔除。
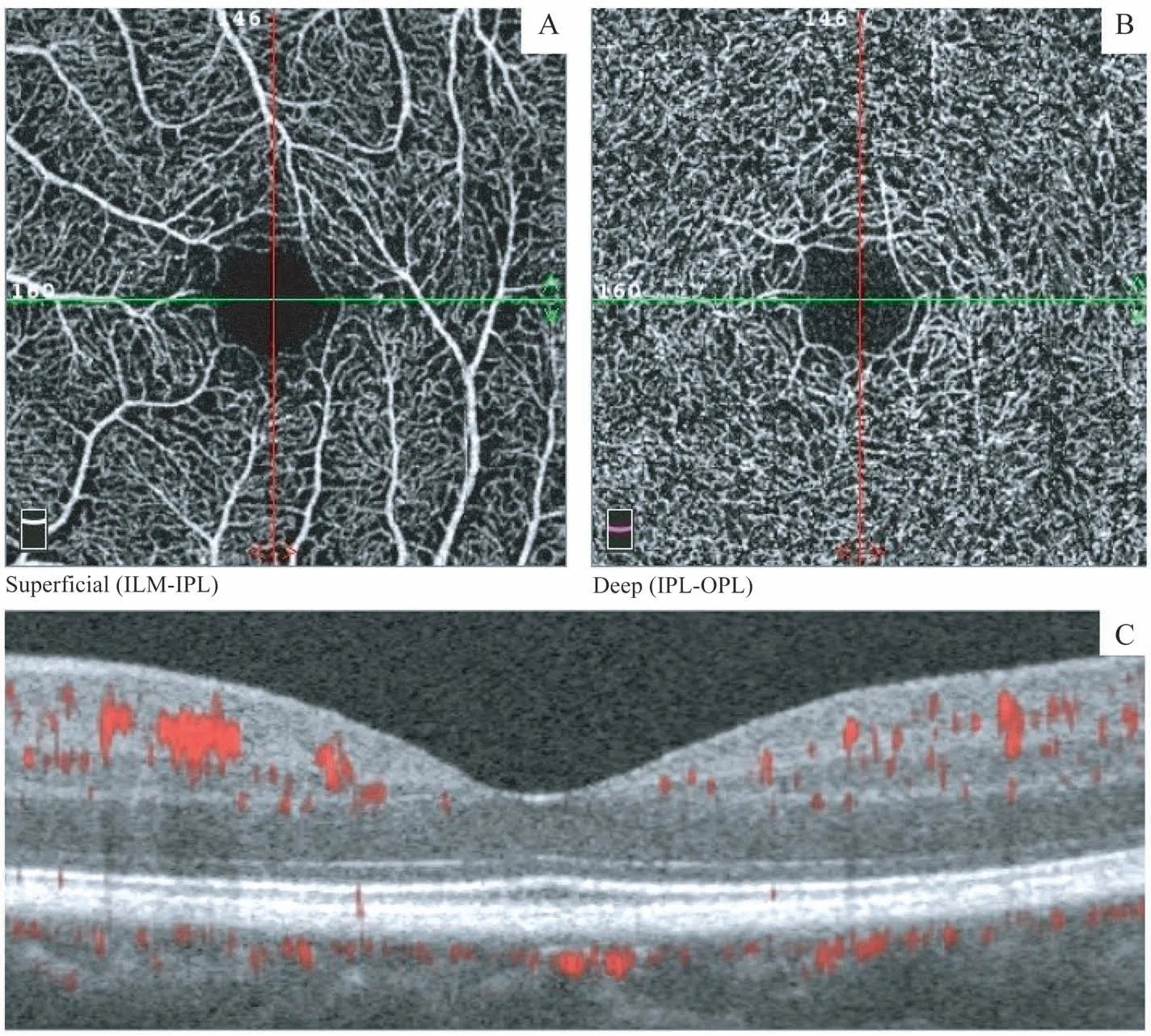
图1 黄斑区血管丛扫描示例(3 mm×3 mm)Fig 1 An example of macular scan(3 mm×3 mm)
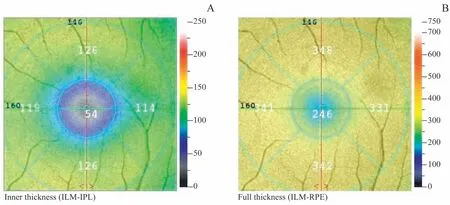
图2 视网膜厚度Fig 2 An example of retina thickness map
1.3 统计学分析
采用SPSS 21.0软件进行统计学分析。符合正态分布的定量资料以±s表示,主导眼、非主导眼与对照组间视网膜SCP血流密度、DCP血流密度、FAZ、内层及全层视网膜厚度比较采用t检验或Mann-WhitneyU检验。定性资料以n(%)表示,采用χ2检验比较各组间差异。采用Littmann’s公式以调整屈光不正及眼轴对OCTA数据的影响。为保证AngioVue软件提供及分析的OCTA扫描图像的质量,本研究排除了SQI小于7或者高于7但有明显伪影的图像。P<0.05表示差异有统计学意义。
2 结果
2.1 患者基本信息
本研究共纳入29例恒定性外斜视患者(男性12例,女性17例),平均年龄(25.6±5.7)岁;对照组共27例(男性16例,女性11例),平均年龄(23.8±6.9)岁。试验组与对照组的年龄、性别之间差异无统计学意义。所有患者眼球运动正常,眼前段和眼后段检查亦均正常。本研究对斜视患者主导眼、非主导眼以及正常眼的等效球镜度数、BCVA、眼压、眼轴等进行对比,结果见表1,2组的各指标间差异均无统计学意义。
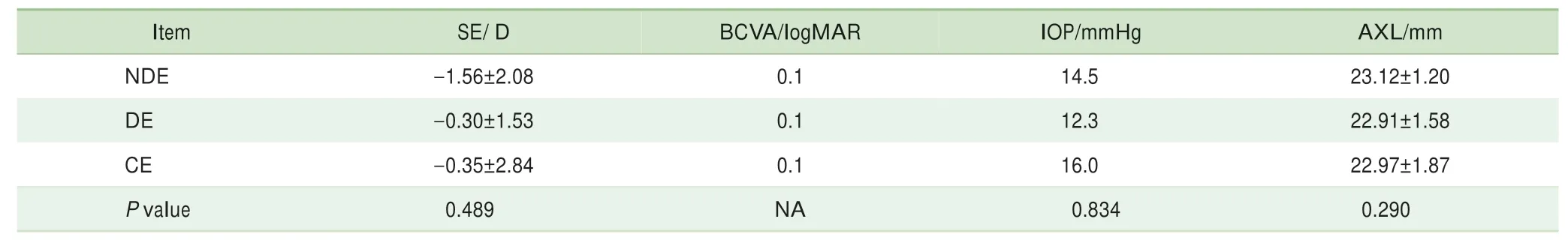
表1 恒定性外斜视患者的基本信息(N=29)Tab 1 Basic information of constant exotropic patients(N=29)
2.2 毛细血管丛血流密度及FAZ分析
患者与正常人黄斑区3 mm×3 mm区域毛细血管丛血流密度及FAZ分析,应用OCTA设备对恒定性外斜视患者的黄斑3 mm×3 mm区域进行扫描(图1),采用t检验对比所获血流密度数据,结果显示:斜视患者的两眼间的SCP与DCP比较差异无统计学意义,主导眼和非主导眼分别与正常眼相比,差异均无统计学意义。此外,比较三者OCTA图像的FAZ平均面积,差异无统计学意义(表2)。
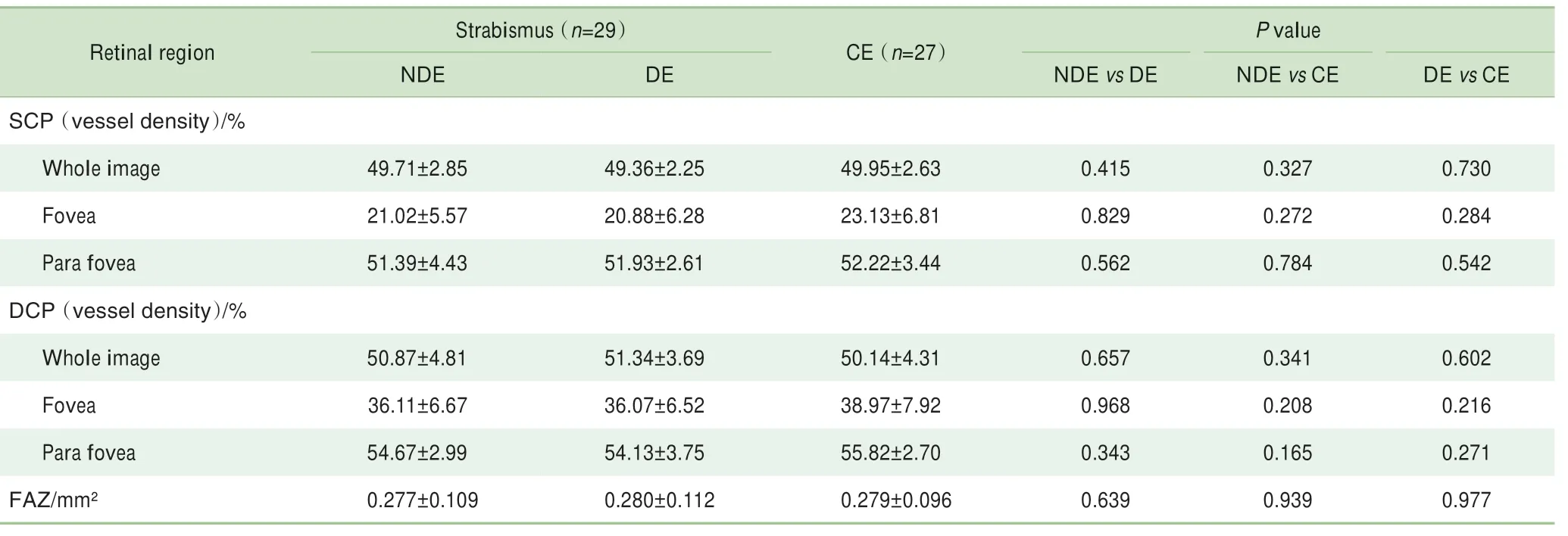
表2 2组黄斑区血流密度分析Tab 2 Analysisof macular microvasculaturein thestrabismusgroup and control group
2.3 斜视患者与正常人视网膜厚度分析
2组视网膜厚度比较见表3。斜视患者非主导眼的中心凹全层视网膜厚度显著低于主导眼,差异有统计学意义(P=0.018);此外,非主导眼颞侧黄斑区视网膜厚度低于主导眼,差异有统计学意义(P=0.018)。主导眼、非主导眼和正常眼其余区域视网膜厚度之间的差异无统计学意义。
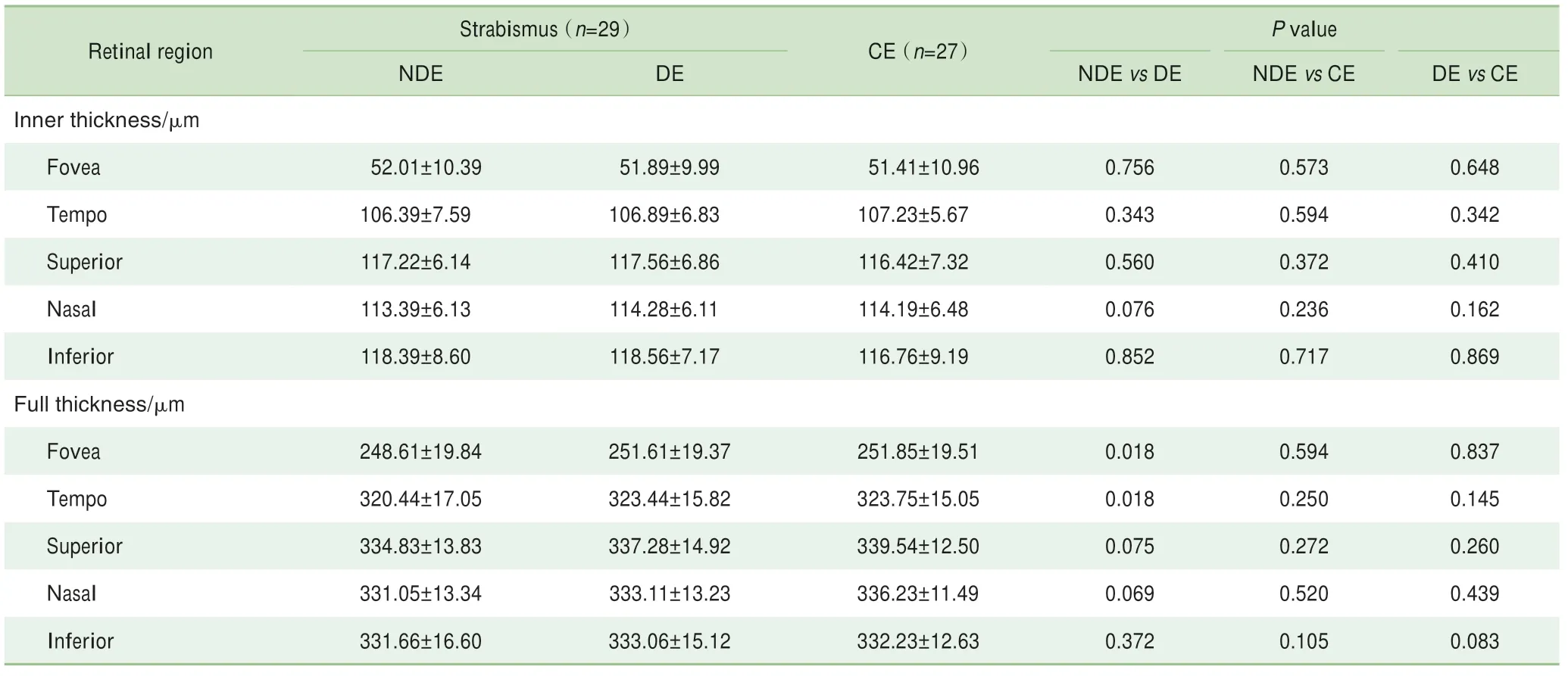
表3 2组视网膜厚度分析Tab 3 Analysis of retinal thickness in the strabismus group and control group
3 讨论
正常人眼的活动主要由脑神经支配,使双眼运动协调,各方向视轴平行。斜视双眼的视轴发生偏斜且不能被双眼的融合功能所克服。既往研究[8-9]表明,斜视的形成可能会对视路带来一定影响,包括初级视皮质眼优势柱的改变、上丘神经元的异常反应、突触的退变和萎缩等。以往对斜视患者视网膜的研究主要应用光学相干断层扫描(optical coherence tomography,OCT)技术,但无法定量检测出血流密度的变化。随着医学影像技术的不断发展,尤其是OCTA的出现,定量检测血流信号及视网膜厚度的微小变化成为可能。
OCT能够直接显示视网膜和视网膜神经纤维层(retinal nerve fiber layer,RNFL)的实时图像,可以识别视网膜的多层结构,为斜视发病机制提供新的线索。以往有关斜视患者的OCT检查结果表明黄斑及RNFL出现显著改变。Oka等[10]应用OCT设备发现斜视患者非主导眼的上方/下方黄斑区视网膜总厚度比值及上方及颞侧神经节细胞复合物厚度明显低于主导眼,这种改变可能与视觉通路中传出神经的退行性改变有关。Mintz等[11]应用OCT设备对30名斜视患者进行分析,发现黄斑及黄斑周边视网膜厚度在斜视术后明显增加,认为这一改变可能与眼外肌移位导致机械张力变化,术后炎症反应和血-视网膜屏障的改变有关。Wen等的研究[12]纳入了138例不同类型的斜视患者和正常人,OCT结果表明:共同性外斜视患者的鼻侧内层视网膜厚度显著增加;在恒定性外斜视患者中,颞侧外层视网膜的厚度明显增加。韩姬等[13]应用OCT比较了80名儿童斜视患者的RNFL厚度,结果显示:轻、中、重度斜视患儿各区及全周的RNFL厚度均显著高于健康儿童,RNFL厚度与疾病程度无明显相关性,等效球镜度数和眼轴长度对RNFL厚度有明显影响。
本研究结果显示,恒定性外斜视患者非主导眼中心凹及颞侧全层视网膜厚度变薄。目前尚无斜视血流密度及视网膜厚度改变相关的机制研究,但可能与斜视患者双眼的异常视觉刺激有关。视觉系统的异常刺激可能会影响视网膜神经节细胞的正常凋亡,进一步导致视网膜厚度的异常改变。本文与既往研究不完全一致,可能与较小的统计样本、不同的统计学方法,以及地区人种差异相关。
本研究发现,恒定性外斜视患者SCP、DCP血流密度及FAZ面积,主导眼及正常眼相比均未发生明显改变。目前,有关OCTA设备及SSADA算法的可重复性及可靠性已经获得证实[14-16]。少数研究已证实斜视术后术眼虹膜及黄斑区血流发生改变:Inal等[17]利用OCTA对16例斜视患者进行研究,结果表明斜视术后术眼SCP和DCP显著增加,而FAZ面积显著下降,非术眼OCTA参数无明显变化。OCTA的合理应用及统计分析可能会对斜视的发病机制有一定的探索意义,有望成为临床诊治的辅助工具。
综上,本研究表明,恒定性外斜视患者中心凹及颞侧全层视网膜厚度下降,且差异具有统计学意义。但由于研究受到样本量相对较小等条件的限制,未来还需更大的样本量对结果加以证实。例如,采用OCTA技术对不同类型斜视患者的黄斑及ONH进行分析,或应用OCTA技术测量比较斜视患者术前及术后视网膜血流密度及厚度的变化情况等。
参·考·文·献
[1] Tidbury LP,Brooks KR,O'Connor AR,et al.A systematic comparison of static and dynamic cues for depth perception[J].Invest Ophthalmol Vis Sci,2016,57(8):3545-3553.
[2] Ha SG,Kim SH.Early postoperative overcorrection in recurrent exotropia[J].Can JOphthalmol,2017,52(6):611-615.
[3] Uji A,Balasubramanian S,Lei JQ,et al.Multiple enface image averaging for enhanced optical coherence tomography angiography imaging[J].Acta Ophthalmol,2018,96(7):e820-e827.
[4] Chalam KV,Sambhav K.Optical coherence tomography angiography in retinal diseases[J].JOphthalmic Vis Res,2016,11(1):84-92.
[5] Iafe NA,Phasukkijwatana N,Chen XJ,et al.Retinal capillary density and foveal avascular zone area are age-dependent:quantitative analysis using optical coherence tomography angiography[J].Invest Ophthalmol Vis Sci,2016,57(13):5780-5787.
[6] Gao SS,Liu G,Huang D,et al.Optimization of the split-spectrum amplitude-decorrelation angiography algorithm on a spectral optical coherence tomography system[J].Opt Lett,2015,40(10):2305-2308.
[7] Conti FF,Young JM,Silva FQ,et al.Repeatability of split-spectrum amplitude-decorrelation angiography to assess capillary perfusion density within optical coherence tomography[J].Ophthalmic Surg Lasers Imaging Retina,2018,49(9):e9-e19.
[8] Scholl B,Tan AY,Priebe NJ.Strabismus disrupts binocular synaptic integration in primary visual cortex[J].J Neurosci,2013,33(43):17108-17122.
[9] Upadhyaya S,Das VE.Response properties of cells within the rostral superior colliculus of strabismic monkeys[J].Invest Ophthalmol Vis Sci,2019,60(13):4292-4302.
[10] Oka M,Yamashita T,Ono S,et al.Quadrantal macular retinal thickness changes in strabismus subjects with abnormal binocular vision development[J].Jpn J Ophthalmol,2013,57(2):225-232.
[11] Mintz HR,Waisbourd M,Kessner R,et al.Macular thickness following strabismus surgery as determined by optical coherence tomography[J].JPediatr Ophthalmol Strabismus,2016,53(1):11-15.
[12] Wen Y,Yan JH,Wang ZH,et al.Topographical profiles of macula and optic nerve head in concomitant strabismus patients as measured using OCT and CSLO[J].Albrecht Von Graefes Arch Fur Klinische Und Exp Ophthalmol,2020,258(3):675-682.
[13] 韩姬,王玲,刘伟仙,等.斜视患儿视网膜神经纤维层厚度不同分区变化特点[J].眼科新进展,2015,35(4):355-358.
[14] Carpineto P,Mastropasqua R,Marchini G,et al.Reproducibility and repeatability of foveal avascular zone measurements in healthy subjects by optical coherence tomography angiography[J].Br JOphthalmol,2016,100(5):671-676.
[15] Corvi F,Pellegrini M,Erba S,et al.Reproducibility of vessel density,fractal dimension,and foveal avascular zone using 7 different optical coherence tomography angiography devices[J].Am JOphthalmol,2018,186:25-31.
[16] Alnawaiseh M,Brand C,Bormann E,et al.Quantification of macular perfusion using optical coherence tomography angiography:repeatability and impact of an eye-tracking system[J].BMCOphthalmol,2018,18(1):123.
[17] Inal A,Yilmaz I,Ocak OB,et al. Optical coherence tomography angiography:are there any changes in measurements after strabismus surgery?[J].JPediatr Ophthalmol Strabismus,2019,56(2):95-100.

