Ⅲ~Ⅳ期神经母细胞瘤患儿放射治疗预后因素分析
周珺珺,赵 洁,汤静燕,蒋马伟,马秀梅,白永瑞
1.上海交通大学医学院附属仁济医院放射诊疗科,上海 200127;2.上海交通大学医学院附属上海儿童医学中心血液肿瘤科,上海 200127;3.上海交通大学医学院附属新华医院放射诊疗科,上海 200092
神经母细胞瘤(neuroblastoma,NB)是儿童最高发的颅外实体肿瘤。NB患者群体间存在广泛的异质性,预后也随着分期和危险因素不同有明显差别。NB引起的症状多取决于肿瘤所侵犯的相应器官。对于低危NB,年幼者可自行消退,单纯手术也可以取得很好的疗效。对于高危NB,目前国内外多采用手术切除联合化学治疗(化疗)及自体骨髓移植(autologous bone marrow transplantation,ABMT)或放射治疗(放疗)的综合治疗方式。即使采用了高强度的综合治疗,Ⅲ~Ⅳ期的高危及极高危患儿5年生存率仍仅为30%~50%[1]。放疗作为局部治疗手段,在提高局部控制率及减轻晚期患儿肿瘤压迫、出血、疼痛等症状方面的作用已明确,但接受放疗患儿的临床特征是否与预后相关仍不明确。本研究回顾性分析影响高危NB患儿放疗效果的相关因素,探讨高危NB患儿中放疗的可能获益人群,为规范多学科诊疗流程提供依据。
1 对象与方法
1.1 研究对象
纳入2008年9月—2018年8月在上海交通大学医学院附属上海儿童医学中心血液肿瘤科、附属仁济医院,以及附属新华医院放射诊疗科接受放疗的Ⅲ~Ⅳ期NB患儿共132例。纳入标准:①病理按1999年国际神经母细胞瘤病理学分类系统(The International Neuroblastoma Pathology Classification the Shimada System)或骨髓细胞学诊断确诊。②通过X线检查、B超、CT或MRI、PET-CT以明确肿瘤的原发部位、周围组织受累程度,以及肿瘤转移情况,且根据国际神经母细胞瘤分期系统(International Neuroblastoma Staging System,INSS)判定为Ⅲ期或Ⅳ期。排除标准:①年龄小于18个月。②病例合并心、肝、肾等重要器官严重损害或严重的全身感染、败血症或脓毒血症且未控制者。③晚期病例合并贫血、消瘦或处于恶病质状态或肿瘤所在脏器有穿孔可能或已经穿孔者。本研究经上海交通大学医学院附属上海儿童医学中心伦理委员会批准,所有研究对象均签署了知情同意书。
1.2 诊断及分期方法
首先根据神经母细胞瘤病理组织学分类系统(the Shimada System)进行病理形态学分类;然后参照影像学定义的危险因素(image-defined risk factor,IDRF)评估疾病的危险程度:无IDRF的为L1,存在1项或多项IDRF的为L2;M为任何原发肿瘤伴有远处淋巴结、骨髓、肝、皮肤和(或)其他器官播散(除Ms期),Ms为转移仅限于皮肤、肝和(或)骨髓转移(仅限于年龄小于18个月的婴儿)。其中IDRF危险因子划分的标准有:①单侧病变,延伸到2个体腔,包括颈部-胸腔、胸腔-腹腔、腹腔-盆腔。②肿瘤包绕血管神经、压迫气管、肿瘤侵及椎管。③邻近器官/组织受累:包括心包、横膈、肾脏、肝脏、胰-十二指肠和肠系膜。结合肿瘤可通过手术切除的程度,按INSS进行分期,可分为Ⅰ、ⅡA、ⅡB、Ⅲ、Ⅳ、Ⅳs期。最后综合肿瘤分期、年龄、IDRF、MYCN原癌基因情况将病例危险度分为低、中、高、超高危4组[1]。并按照危险度的情况制定不同的治疗方案。
1.3 治疗方案
1.3.1 中危组方案 化疗前或化疗中(约4个疗程)择期手术,术后化疗至部分缓解(partial response,PR)后进行4个疗程,总疗程不超过8个,必要时进行二次手术。化疗结束后用13-顺式-视黄酸(13-cis-RA)160 mg/m2维持治疗,14 d/月,共6个月。
1.3.2 高危和超高危组治疗方案 治疗包括3个阶段,即诱导期(包括化疗和手术)、巩固期(序贯移植及针对原发肿瘤以及残余转移部位的放疗),以及巩固期后维持治疗(免疫治疗和13-cis-RA)。具体实施:先化疗2个疗程后,进行自体骨髓干细胞采集,然后继续化疗2个疗程后择期手术;术后再化疗2个疗程,总疗程不超过6个。常规化疗结束后行ABMT和瘤床区放疗(推荐行序贯ABMT,瘤床放疗在2次ABMT之间进行);之后进行免疫治疗联合13-cis-RA治疗。
1.3.3 放疗适应证 大于18月龄高危及超高危患儿需接受原发部位及转移病灶的放疗。姑息放疗则适用于患儿病情进展危及生命器官,或肿瘤短时间内明显增大而影响呼吸系统或导致消化系统梗阻,或患儿存在骨和软组织转移灶的疼痛、压迫、出血等症状时。
1.4 放疗实施流程
1.4.1 放疗前定位准备 运用负压成型真空垫或热塑膜固定体位,Philips Brilliance大孔径四维CT模拟定位机进行治疗位CT扫描,层厚3~5 mm。幼儿如不能配合,需常规麻醉。
1.4.2 放疗靶区的设定 肿瘤靶区(grosstumor volume,GTV),包括术前CT、MRI和PET等影像资料显示的肿瘤,以及术中发现的肿瘤组织或转移淋巴结,并需要考虑在化疗和手术治疗后影像检查提示的残留肿瘤组织。临床靶区(clinical target volume,CTV)是指亚临床肿瘤区域,参考不同的解剖结构和肿瘤生长方式界定。计划靶区(planning target volume,PTV),一般由CTV外放0.5 cm。
1.4.3 放疗范围和剂量的界定 放疗范围包括化疗前原发肿瘤、累及转移淋巴结和转移灶。如果照射野包括了椎体,则必须包括该脊椎椎体的全部宽度,避免发生严重的脊柱侧弯畸形。靶区内也包括了相邻淋巴结区,以减少淋巴结区复发。对椎旁哑铃形病灶,若为中线部位原发肿瘤,靶区包括脊柱内外(髓内部分及椎体外部分)。对于巩固化疗后达到完全缓解(completeresponse,CR)的病灶瘤床给予21.6 Gy照射剂量,而PR患者需在治疗21.6 Gy后,选择性对残留病灶缩野加量14.4 Gy,总量为36 Gy。另外对需要骨髓移植的患者实施移植前全身照射(total body irradiation,TBI)。TBI采用2 Gy/次,2次/d,总量12 Gy的照射方法;对骨转移及腹部或颈部软组织转移灶有疼痛压迫等症状的患者则加用姑息减症放疗,放疗剂量为30~36 Gy。
1.5 疗效评估
无事件生存期(event-free survival,EFS)指从入组开始到发生任何事件的时间,包括死亡、疾病进展、加用其他治疗、发生致死性或不耐受的副作用等事件。疾病进展定义为出现新病灶或原有病灶在影像学中评判增加>25%。总生存期(overall survival,OS)指从入组至因任何原因引起死亡的时间。随访时间截至2019年6月31日,终点事件为无事件发生情况和生存状态。
1.6 统计学分析
2 结果
2.1 患者一般资料
NB患儿共132例,其中男76例、女56例;诊断时年龄≤24个月有21例,>24~120个月的105例,>120个月的6例。肿瘤分期为Ⅲ期48例、Ⅳ期83例、Ⅳs期1例;其中中危组6例(4.54%)、高危组48例(36.36%)、极高危组78例(59.10%),因此本组病例中多为预后不良的高危及极高危患儿。原发灶位于腹部81例、胸部15例、头颈部3例、盆腔1例、多体腔累及32例。初诊时骨髓浸润68例、中枢神经系统转移10例、肝脏转移6例。接受ABMT 26例(19.69%),MYC N基因检测阴性16例(12.12%)、突变81例(61.36%)、扩增35例(26.52%);MYC N基因扩增病例中,放疗后局部复发病例为15例,局部复发率为42.85%。本组资料中接受姑息放疗的患儿46例,其中骨转移灶姑息放疗35例,剂量为30 Gy,疗效评价PR+CR为24例,缓解率达到68.57%;给予腹部及颈部转移灶软组织压迫的患者姑息放疗11例,剂量为30~36 Gy,5例疗效评价为PR+CR,缓解率为45.45%。
2.2 生存结果
全组接受放疗的患儿132例,至随访结束时死亡34例,其中4例因并发重症感染或多器官衰竭导致死亡。69例出现疾病进展,其中40例出现远处转移,29例同时出现局部复发(包括靶区内和靶区外)和远处转移;靶区外复发的有2例,出现在相邻淋巴结区。中位随访时间为40.3个月,整组患儿1年、2年、3年、5年EFS率分别为87.41%、55.25%、45.02%、38.67%,OS率分别为96.02%、83.54.%、72.15%、57.79%(图1)。
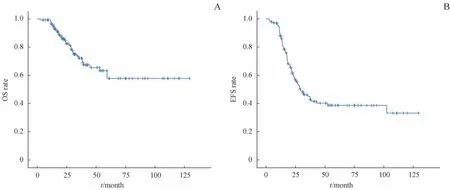
图1 Ⅲ~Ⅳ期NB患儿OS(A)及EFS(B)曲线Fig 1 OS(A)and EFS(B)curves of the NB patients withⅢ-Ⅳstage
2.3 预后因素分析
单因素分析结果见表1。结果显示:患儿疾病分期[EFS(P=0.002)和OS(P=0.024)]、危险度分组[EFS(P=0.002)和OS(P=0.036)]及有无脑转移[EFS(P=0.000)和OS(P=0.001)]、血液乳酸脱氢酶(lactate dehydrogenase,LDH)水 平[EFS(P=0.005)和OS(P=0.037)]及血清铁蛋白水平[EFS(P=0.014)和OS(P=0.048)]与EFS和OS有关;有无骨髓浸润[EFS(P=0.007)和OS(P=0.091)]影响EFS,但不影响患儿OS;病例性别、是否接受ABMT治疗、M YCN基因扩增情况、有无肝脏浸润等与EFS和OS均不相关。多因素分析提示,仅无脑转移这1个因素为放疗后OS[HR(95%CI)=0.179(0.027~0.891),P=0.029]和EFS[HR(95%CI)=0.246(0.069~0.885),P=0.032]的独立预测因素。
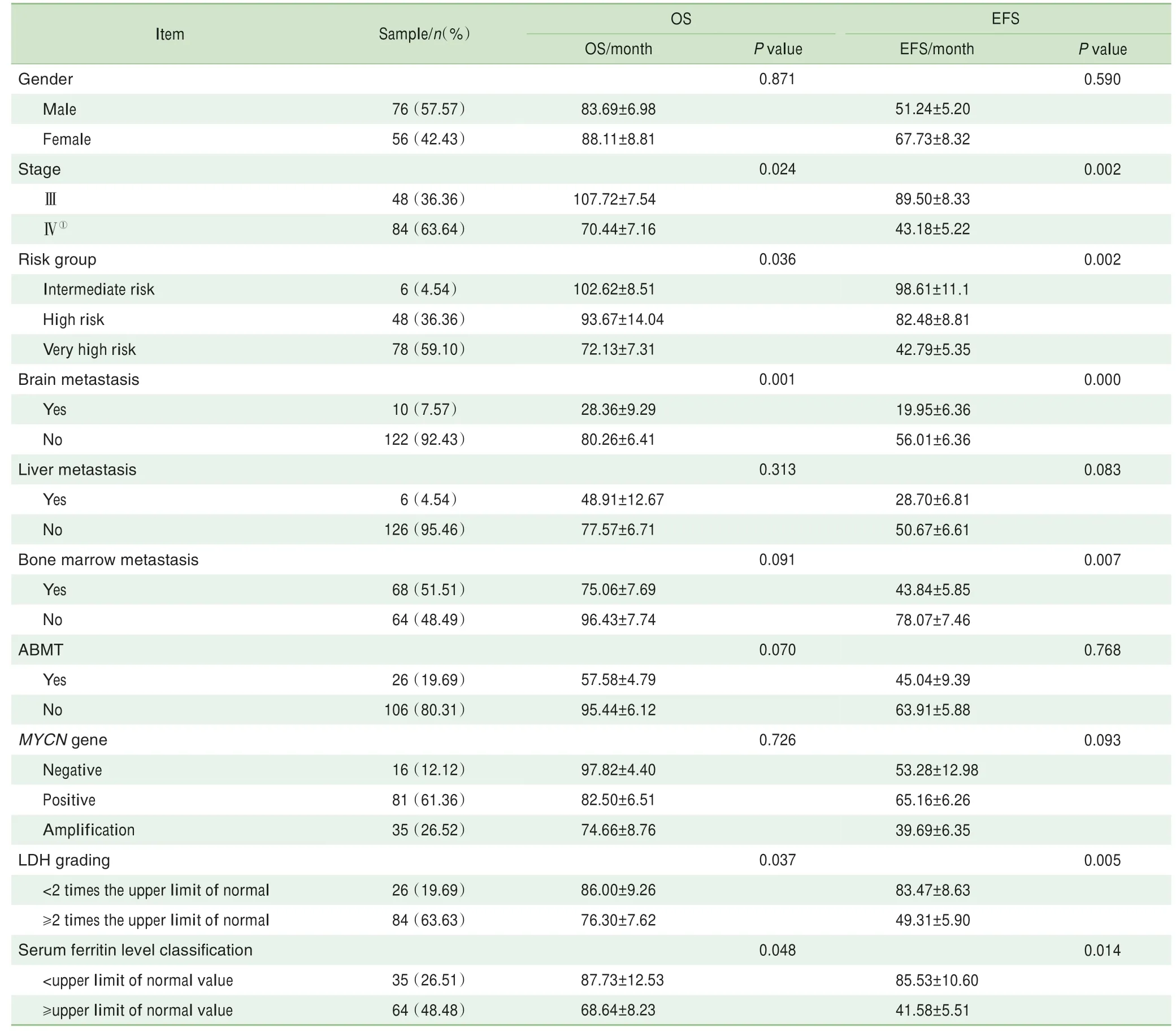
表1 影响Ⅲ~Ⅳ期NB患儿EFS及OS的单因素分析Tab 1 Uni-variate analysisof OSand EFSin the NB patientswithⅢ-Ⅳstage
3 讨论
NB是一类严重威胁儿童健康的恶性肿瘤,死亡人数占儿童肿瘤相关死亡总人数的15%左右[2],多原发于肾上腺、后腹膜区域,易累及骨、骨髓、肝脏、淋巴结、皮肤及脑等。治疗方案包括化疗、手术、自体造血干细胞移植和放疗等方式,后续辅以维甲酸或免疫治疗加以维持。高危NB患者5年生存率一般为50%左右[1]。本研究分析结果显示5年生存率为57.79%,略高于既往文献报道数据。
Ⅲ~Ⅳ期患儿因肿瘤巨大、包绕血管或诱导化疗效果欠佳等因素导致手术未能全切。有研究[1]显示不完整切除术后辅以局部放疗的局部控制率和生存情况与完整切除患者之间无明显差异。高危NB的局部复发率为17%~74%,CCG3891研究[2]报告原发灶复发是主要的复发部位,提示加用外照射能够提高局部控制率。对于NB的局部控制主要在于手术结合放疗的模式应用。CCG3891研究中539病例的放疗与原发灶控制率及生存期之间有明显正相关性[2]。同样,NB97试验亦表明无论在局部失败率还是总生存期上,加用外照射的Ⅳ期NB患者均较未放疗患者明显得到获益[3]。对于放疗剂量的加量与生存的相关性也有研究探讨过。COGANBL0532研究探索瘤床区加至36 Gy的高剂量放疗,与COGA3973研究做历史对照;后者所有病例均接受21.6 Gy放疗。COGANBL0532研究组5年EFS率和OS率分别为56.2%和68.4%,而COGA3973组则分别为47.0%(P=0.009)和57.4%(P=0.009),可见加量放疗对NB患者的EFS和OS均有所改善[4]。另一项研究[5]也提出了相同的结论,但对于转移灶的姑息放疗是否对预后有价值尚不能肯定。另外放疗也会引起患儿长期不良反应,如生长发育障碍、神经认知问题、慢性肾功能不全或内分泌紊乱等异常;尤其在全身系统化疗后,TBI和外照射同时应用的情况下,更有可能增加第二原发肿瘤的危险。
本组患儿采用的放疗照射范围和剂量模式显示了良好的疾病控制效果。若有转移病灶引起压迫梗阻或疼痛的症状则加用姑息放疗。对于骨和软组织转移灶,放疗可有效止痛和改善压迫或出血症状。研究[6]提示对于NB患儿骨转移等部位放疗后疼痛有缓解,PR+CR率为65%,软组织转移灶PR+CR率为67%。而本组患儿骨转移灶姑息放疗后疼痛PR+CR率达到69%;转移灶姑息放疗后PR+CR率为46%,因此姑息放疗对患儿的临床症状的减轻及生活质量的提高有帮助。
既往研究[7]表明MYCN基因扩增会造成NB侵袭性增加,且多与较短的生存期相关。一项针对35例MYCN基因扩增NB患者的研究[8]中,97%为转移性病变(24例为Ⅳ期,10例为Ⅳs期),所有患者都接受了21 Gy的局部放疗;中位生存期为12个月,2年OS率为30%,2年EFS率为29%,较未扩增患者预后情况更差。另有一项回顾性研究[9]分析了58例NB患者,接受放疗的患儿5年EFS和OS分别为36%和46%,而未接受放疗者仅为22%和27%(P=0.026),其中多因素分析显示存在MYCN扩增患者疗效更差。MYCN基因扩增患者的局部复发率为(70±10)%[2]。而本组MYCN基因检测扩增病例放疗后局部复发率为43%,可见放疗可减少局部区域复发,但此部分患者生存率与无MYCN基因扩增组无差异。一些与NB疾病相关的血液指标,如LDH、铁蛋白等,与预后是否相关在多项研究中无明确一致性结果。本研究发现这些血液指标在单因素分析中与EFS和OS都有统计学意义,但多因素分析中未表现出具有统计学意义的相关性。
NB易出现多部位侵犯,且多预后不佳。本研究分析了骨髓、肝脏及脑转移患者的生存状况发现,初诊时肝转移与否不影响放疗患者预后,但有无脑转移为独立预后因素。有研究者分析203例骨髓转移的NB患儿给予放疗联合移植可进一步提高生存率[10],该研究单因素分析显示,LDH≥1 500 U/L及MYCN基因扩增者生存更差。而在本研究中骨髓浸润的NB患儿与无浸润患者相比,预后差异无统计学意义;LDH分组及MYCN基因扩增与否、是否进行过ABMT也未呈现出预后差异,可能临床数据的欠缺导致缺乏了统计学效力。
综上,本研究为针对Ⅲ~Ⅳ期患儿的回顾性分析,患儿多为高危及极高危患者,从总体生存情况看本年龄组OS率较以往文献略高,提示包括放疗在内的综合治疗的必要性。多因素生存分析得出脑转移为独立预后指标,提示存在脑转移的患儿预后不良。目前临床应充分利用各医疗单位的医疗资源,实施多学科联合治疗才能为病患取得最大的临床获益。但NB患儿多因远端转移未控而死亡,因此放疗是否对所有Ⅲ~Ⅳ期患儿都有提高生存的作用仍无明确定论[5]。NB放疗的研究目前多为回顾性分析,对高危获益人群尚缺乏前瞻性、大样本研究验证。因此尚需大样本研究和前瞻性随机对照试验的更多结果来指导临床进行精准治疗。
参·考·文·献
[1] MacFarland S,Bagatell R.Advances in neuroblastoma therapy[J].Curr Opin Pediatr,2019,31(1):14-20.
[2] Haas-Kogan DA,Swift PS,Selch M,et al.Impact of radiotherapy for highrisk neuroblastoma:a Children's Cancer Group study[J].Int JRadiat Oncol Biol Phys,2003,56(1):28-39.
[3] Valteau-Couanet D,Michon J,Boneu A,et al.Results of induction chemotherapy in children older than 1 year with a stage 4 neuroblastoma treated with the NB 97 French Society of Pediatric Oncology(SFOP)protocol[J].JClin Oncol,2005,23(3):532-540.
[4] Liu KX,Naranjo A,Zhang FF,et al.Prospective evaluation of radiation dose escalation in patients with high-risk neuroblastoma and gross residual disease after surgery:a report from the children′s oncology group ANBL0532 study[J].JClin Oncol,2020,38(24):2741-2752.
[5] Arumugam S,Manning-Cork NJ,Gains JE,et al.The evidence for external beam radiotherapy in high-risk neuroblastoma of childhood:a systematic review[J].Clin Oncol(RColl Radiol),2019,31(3):182-190.
[6] Matthay KK,Haas-Kogan D,Constine LS.Neuroblastoma[M]//Halperin EC,Constien LS,Tarbell NJ,et al.Pediatric radiation oncology.5th ed.Philadelphia:Lippincott Williams&Wilkins,2011:108-136.
[7] Oberthuer A,Berthold F,Warnat P,et al.Customized oligonucleotidemicroarray gene expression-based classification of neuroblastoma patients outperforms current clinical risk stratification[J].JClin Oncol,2006,24(31):5070-5078.
[8] Canete A,Gerrard M,Rubie H,et al.Poor survival for infants with MYCNamplified metastatic neuroblastoma despite intensified treatment:the International Society of Paediatric Oncology European Neuroblastoma Experience[J].JClin Oncol,2009,27(7):1014-1019.
[9] de Ioris MA,Crocoli A,Contoli B,et al.Local control in metastatic neuroblastoma in children over 1 year of age[J].BMC Cancer,2015,15:79.
[10] 范洪君,黄程,苏雁,等.伴骨髓转移的高危神经母细胞瘤患儿临床特征及预后分析[J].中华儿科杂志,2019,57(11):863-869.

