简化整体抗磷脂抗体综合征评分在系统性红斑狼疮患者新发血栓栓塞事件风险评估中的应用研究
李 佳,王 然,鲍春德,沈 南,扶 琼
上海交通大学医学院附属仁济医院风湿科,上海 200001
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种以多系统累及和多种自身抗体产生为特征的自身免疫性疾病,主要累及育龄期女性。研究[1-2]显示,SLE患者的肺栓塞、深静脉血栓、心脑血管意外等事件的发病率及致残率均高于正常人群,且这些事件的发生极大地影响其预后和生活质量。该类患者的免疫紊乱可影响其血管内皮系统和出凝血系统,并造成炎症和代谢通路等的异常,参与血栓栓塞事件的发生发展。在SLE的自身抗体中,抗磷脂抗体已被证明与SLE患者血栓栓塞的发生密切相关[3]。2013年,Sciascia等[4]对英国SLE患者进行了一项横断面研究,构建了整体抗磷脂抗体综合征评分(global antiphospholipid syndrome score,GAPSS)系统;该系统包含抗心磷脂抗体(anticardiolipin antibody,ACA)IgG和IgM、抗β2-糖蛋白1(anti-β2 glycoprotein 1,a-β2GP1)抗体IgG和IgM、狼疮抗凝物(lupus anticoagulant,LA)、抗磷脂酰丝氨酸/凝血酶原复合物抗体(anti-phosphatidylserine/prothrombin antibody,aPS/PT)、高脂血症和高血压等6个风险因素,对SLE患者血栓形成和不良妊娠的风险进行量化评估。由于在国内多数医疗机构中aPS/PT的检测并未常规开展,因此给GAPSS的应用带来了一定的困难。国外曾有研究者使用不包含aPS/PT的简化GAPSS(adjusted GAPSS,aGAPSS)对SLE和抗磷脂抗体综合征(antiphospholipid syndrome,APS)等疾病进行评估,发现较高的aGAPSS和患者的血栓栓塞史以及血栓复发风险呈正相关[5-6]。因此,本研究采用aGAPSS对中国SLE患者新发血栓栓塞事件进行评估,以探讨aGAPSS在该类患者血栓风险评价和临床决策中的应用价值。
1 对象与方法
1.1 研究对象、资料收集及分组
本研究为单中心回顾性研究。选择2012年12月—2016年3月于上海交通大学医学院附属仁济医院住院的SLE患者330例。纳入标准:符合2012年系统性红斑狼疮国际临床协作组(Systemic Lupus International Collaborating Clinics,SLICC)分类标准中SLE诊断标准[7]。排除标准:①合并有其他系统性自身免疫病。②未检测抗磷脂抗体。本研究遵循赫尔辛基宣言,由上海交通大学医学院附属仁济医院伦理委员会审核批准。
根据仁济医院的电子医疗记录,收集SLE患者的人口统计学数据包括年龄、性别,记录患者的临床资料,包括住院期间新发血栓栓塞事件、SLE病程、是否合并高血压、是否合并高脂血症、是否存在狼疮肾炎或APS、抗磷脂抗体阳性率、是否使用抗疟药和改善病情的抗风湿 药 物 (disease-modifying anti-rheumatic drug,DMARD)、血栓史和不良妊娠史等。根据患者住院期间是否存在新发动静脉血栓栓塞事件,将其分为血栓组和对照组。
1.2 血栓栓塞事件的定义及诊断
血栓栓塞事件包括动脉血栓栓塞事件和静脉血栓栓塞事件。动脉血栓栓塞事件包括心绞痛、急性心肌梗死、脑血管意外、短暂性脑缺血发作、手指或脚趾坏疽、视网膜动脉闭塞和间歇性跛行。静脉血栓栓塞事件包括下肢静脉血栓、肺栓塞、视网膜静脉闭塞、肝静脉血栓形成。根据SLE患者的临床症状,结合影像学检查如多普勒超声检查、血管造影(包括CT血管造影和磁共振血管造影)和肺通气/灌注扫描,对其血栓栓塞情况进行诊断。
1.3 抗磷脂抗体检测和aGAPSS计算
抗磷脂抗体检测包括ACA IgG和IgM、a-β2GP1抗体IgG和IgM、LA。ACA和a-β2GP1抗体检测使用欧蒙抗心磷脂抗体和抗β2-糖蛋白1抗体检测试剂盒。LA检测使用西门子狼疮抗凝物检测试剂盒。高血压定义为使用水银血压计测量患者坐位左上肢血压2次以上,结果均高于正常值上限;高脂血症定义为血浆胆固醇或三酰甘油水平高于正常值上限[8]。aGAPSS根据文献[4]对5项风险指标进行计算,即高脂血症为3分,高血压为1分,ACA IgG和IgM阳性为5分,a-β2GP1抗体IgG和IgM阳性和LA阳性分别为4分;评分最高为17分,未存在以上情况则记为0分。
1.4 统计学方法
采用SPSS 22.0和MedCalc 15.2软件对研究数据进行统计分析。采用Shapiro-Wilk法进行正态性检验,符合正态分布的定量资料以±s表示,采用独立样本t检验进行分析;不符合正态分布的定量资料以M(Q1,Q3)表示,采用Mann-WhitneyU检验进行分析。定性资料以频数(百分比)表示,采用χ2检验或Fisher确切概率法进行分析。采用受试者操作特征曲线(receiver operator characteristic curve,ROC curve,ROC曲线)分析aGAPSS诊断新发血栓栓塞事件的灵敏度和特异度。P<0.05认为差异具有统计学意义。
2 结果
2.1 2组SLE患者人口统计学数据、临床资料及血栓栓塞事件分析
在330例SLE患者中,60例(18.2%)患者入组时存在新发的动静脉血栓栓塞,设为血栓组,其中动脉血栓和静脉血栓事件各31例;270例患者入组时未合并血栓栓塞事件,设为对照组。对2组SLE患者的人口统计学数据和临床资料进行分析,结果(表1)显示,患者在年龄、是否合并高血压、是否合并APS、抗磷脂抗体阳性率、是否使用DMARD、不良妊娠史的组间差异均具有统计学意义(均P=0.000)。
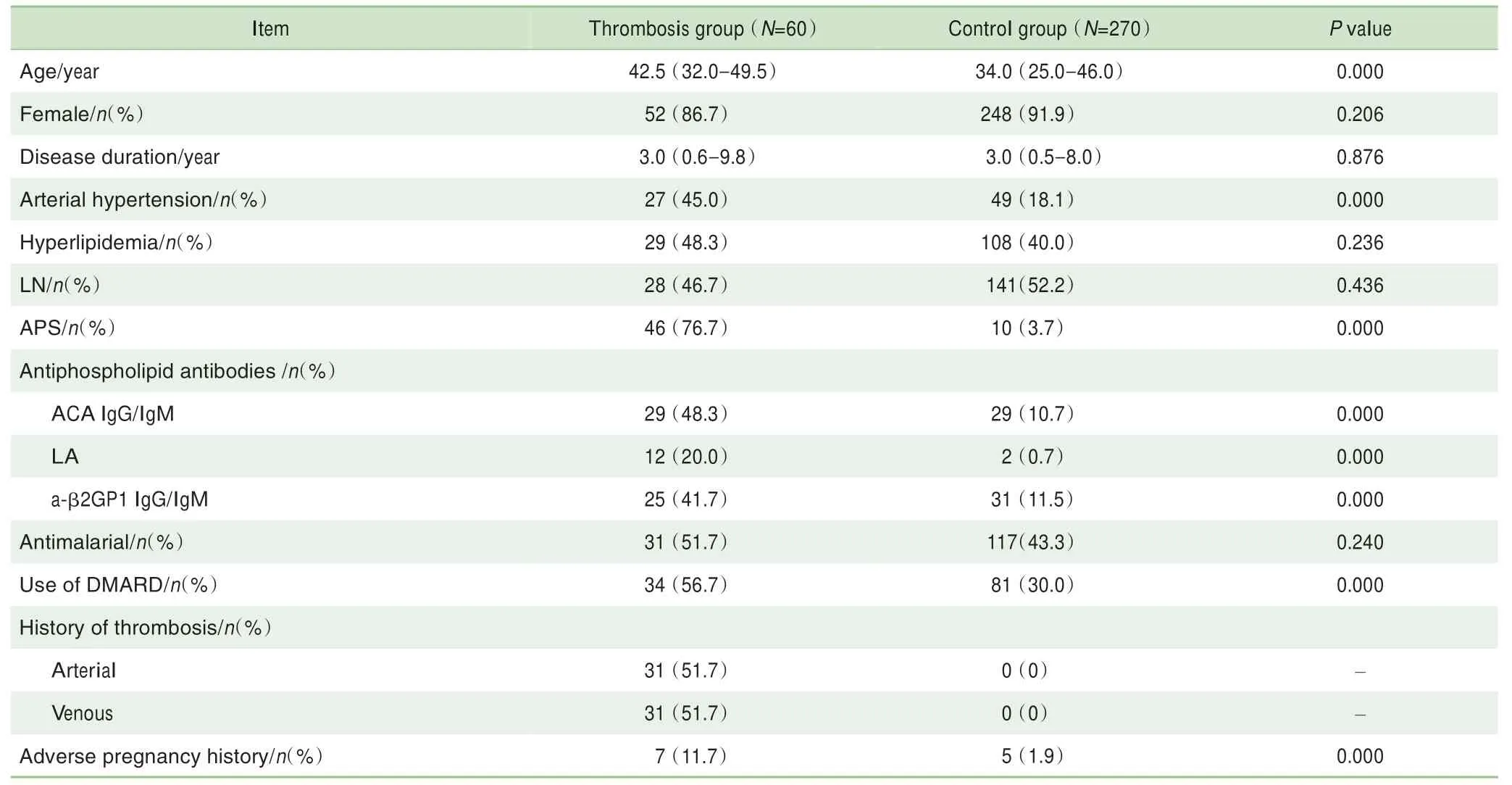
表1 2组SLE患者的人口统计学数据及临床资料分析Tab 1 Analysis of demographic data and clinical data of the two groups
2.2 SLE患者的aGAPSS分析
根据5项风险指标计算2组SLE患者的aGAPSS,结果(图1A)显示血栓组患者的aGAPSS高于对照组(P=0.000)。随后,对不同aGAPSS的患者进行分组,即0~5分组、6~10分组、11~15分组和16~17分组,并对其发生血栓栓塞事件的比例进行分析。结果(图1B)显示,随着aGAPSS的增加,发生血栓栓塞事件的患者比例逐渐增加(4组比较的总体差异,P=0.000),比例依次为10.8%、46.2%、66.7%和100%。
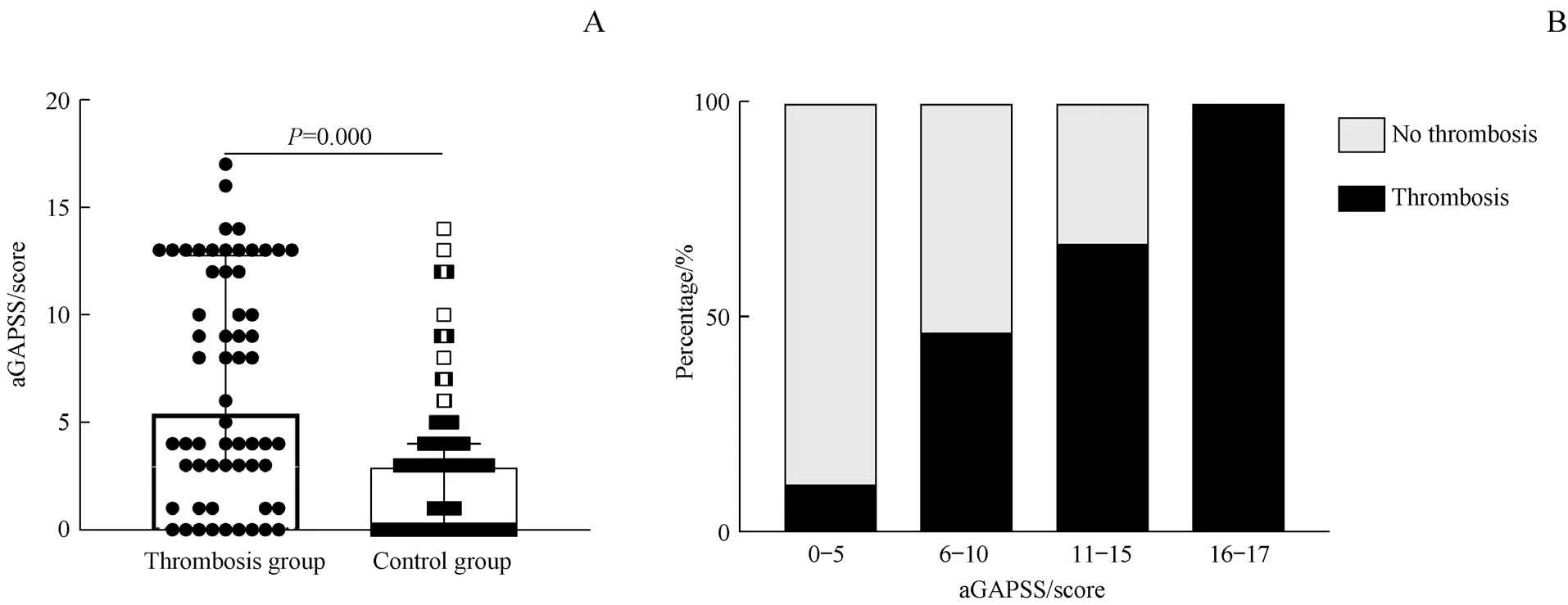
图1 SLE患者的aGAPSS分析Fig 1 aGAPSSanalysisof SLEpatients
对患者的累积血栓栓塞事件进行分析,结果(图2)显示有68例患者发生过血栓栓塞[其中21例(6.4%)存在复发性血栓栓塞事件,47例(14.2%)发生过1次血栓栓塞事件],262例(79.4%)未发生过血栓栓塞事件;且对该3类患者的aGAPSS进行比较发现,与发生1次血栓栓塞事件及未发生过血栓栓塞事件的患者相比,发生复发性血栓栓塞事件患者具有更高的aGAPSS评分(P=0.009,P=0.000)。
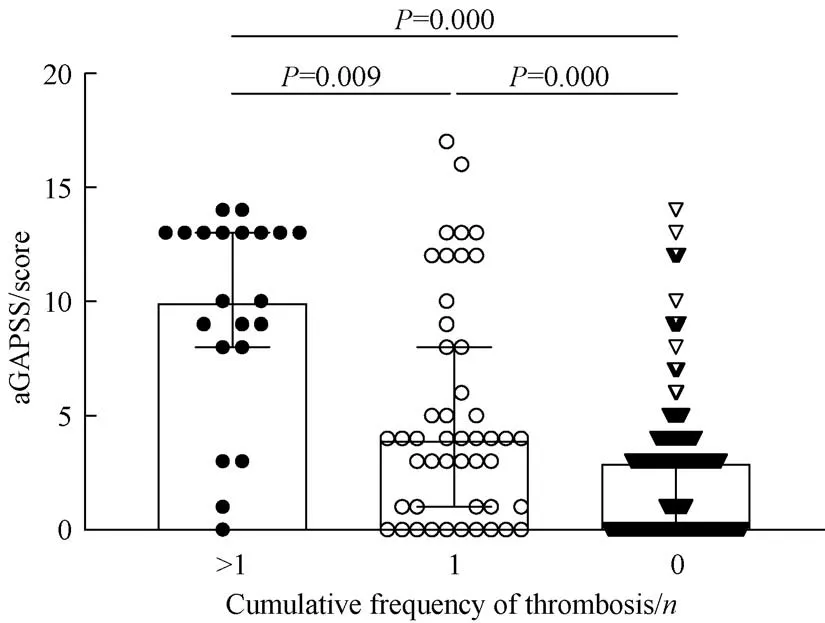
图2 累积发生不同次数血栓栓塞事件的患者间aGAPSS比较Fig 2 Comparison of aGAPSSamong patients with different times of cumulative thromboembolic events
2.3 aGAPSS对SLE患者新发血栓栓塞事件的诊断价值
利用ROC曲线对aGAPSS的诊断效能进行分析,结果(图3)显示当aGAPSS大于7分时,其诊断新发血栓栓塞的曲线下面积(area under the curve,AUC)为0.752(95%CI0.702~0.797),诊断灵敏度和特异度分别为48.33%和94.07%,提示aGAPSS为7分以上的患者存在较高的新发血栓栓塞的风险。
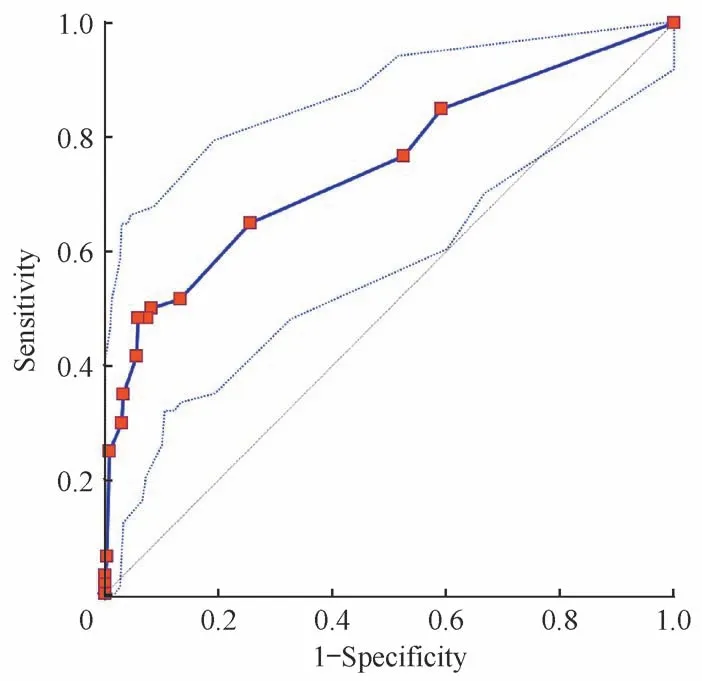
图3 aGAPSS>7分时诊断新发血栓栓塞事件的ROC曲线Fig 3 ROC curve of aGAPSS(>7 scores)in diagnosis of new thromboembolic events
3 讨论
动静脉血栓栓塞是SLE患者常见的并发症之一,且该类患者因血栓栓塞事件导致的心脑血管意外发生率明显高于健康对照[1]。目前,临床上针对SLE患者血栓栓塞风险的评估尚缺乏有效的手段。本研究在中国SLE患者中验证了aGAPSS对新发血栓栓塞的风险评估效能。在我们的队列中有18.2%的患者新发血栓栓塞事件,且在新发血栓事件的患者中,合并APS的患者比例明显高于无血栓事件的患者;同时,我们还观察到2组患者在合并高血压及3种经典抗磷脂抗体的阳性率间差异均具有统计学意义。这些结果提示,传统风险因素和抗磷脂抗体阳性与SLE患者的血栓栓塞密切相关,积极的治疗(如DMARD的使用)可能减少患者血栓栓塞的风险。此外,本研究发现新发血栓栓塞的SLE患者的aGAPSS高于对照组,且存在复发性血栓栓塞事件患者的aGAPSS也显著高于发生1次血栓栓塞的患者,继而表明了aGAPSS在SLE患者血栓负荷评估中的价值。Garcia等[9]研究显示,有血栓事件史的SLE患者的aGAPSS明显高于没有血栓事件的患者,和本研究结果相一致。Radin等[10]则发现,aGAPSS亦可用于年轻APS患者心肌梗死的危险性分层分析。
本研究发现,当aGAPSS>7分时,ROC曲线具有最大的曲线下面积,灵敏度为48.33%,特异度为94.07%。Garcia等[9]以历史血栓事件和不良妊娠作为结局,对266例SLE患者的aGAPSS进行验证,结果显示患者的aGAPSS与结局相关,且当其阈值为4时的诊断灵敏度和特异度均为62.8%。在临床工作中,aGAPSS是否能预测未来血栓事件发生的风险也是一个值得探索的问题。我们对本队列的患者进行了平均24个月的随访,结果显示仅有6例患者出现了新发的血栓栓塞事件,因此未评估aGAPSS或者其动态变化对于未来血栓发生风险的预测能力。
目前,临床常用的血栓风险评估工具为Caprini血栓风险量表,其纳入了38项传统的风险因素和抗磷脂抗体等指标,多用于外科手术患者静脉血栓栓塞风险的评估[11]。有研究[12]显示,在自身免疫病的人群中抗磷脂抗体与血栓发生密切相关。目前,研究者们已建立了3种抗磷脂抗体相关的风险模型,用于量化APS患者发生血栓栓塞的风险;其中,抗磷脂抗体评分(antiphospholipid score)和部分抗磷脂抗体评分对于SLE的血栓诊断有一定的预测能力[13-14]。但是上述评分未纳入血栓形成的传统风险因素,而这些因素在SLE患者中广泛存在。2013年,Sciascia等[4]在一项纳入211例SLE患者的队列研究中,通过多变量权重积分建立了GAPSS系统;该系统纳入了血栓事件的传统风险因素和疾病相关的风险因素,筛选了高血压、高脂血症和抗磷脂抗体等6项危险因素,并根据权重进行赋值,总分为20分。Zuily等[15]在一项前瞻性研究中,对137例SLE患者和抗磷脂抗体阳性的自身免疫病患者进行随访(平均时间为43.1个月),结果发现GAPSS大于16是血栓形成的唯一预测因子(HR=6.17,95%CI1.70~22.40)。在另一项前瞻性验证研究[16]中,研究者对51例SLE患者随访(32.94±12.06)个月并计算每年的GAPSS,结果显示GAPSS增加和血栓事件发生风险相关。上述结果均表明,GAPSS可以用作SLE患者血栓风险分层的新工具。同时,在SLE和APS患者的研究中发现,去除aPS/PT的aGAPSS亦可以用于患者的血栓风险评估,且操作更为便捷[6,9]。
本研究显示aGAPSS可用于SLE患者新发血栓栓塞风险的评估,有利于识别高危人群,开展早期防治,以降低SLE患者血栓事件的发生及相关危害,改善预后。后续,在SLE患者的长期随访中,我们还将对aGAPSS进行进一步的验证及修正,并尝试构建更加有效的血栓风险分层模型,从而指导SLE患者血栓栓塞事件的预防、诊断及治疗的临床实践。
参·考·文·献
[1] Arkema EV,Svenungsson E,von Euler M,et al.Stroke in systemic lupus erythematosus:a Swedish population-based cohort study[J].Ann Rheum Dis,2017,76(9):1544-1549.
[2] Aviña-Zubieta JA,Vostretsova K,De Vera MA,et al.The risk of pulmonary embolism and deep venous thrombosis in systemic lupus erythematosus:a general population-based study[J].Semin Arthritis Rheum,2015,45(2):195-201.
[3] Guraieb-Chahín P,Cantú-Brito C,Soto-Mota A,et al.Stroke in systemic lupus erythematosus:epidemiology,mechanism,and long-term outcome[J].Lupus,2020,29(5):437-445.
[4] Sciascia S,Sanna G,Murru V,et al.GAPSS:the global anti-phospholipid syndrome score[J].Rheumatology(Oxford),2013,52(8):1397-1403.
[5] Sciascia S,Radin M,Sanna G,et al.Clinical utility of the global antiphospholipid syndrome score for risk stratification:a pooled analysis[J].Rheumatology(Oxford),2018,57(4):661-665.
[6] Radin M,Sciascia S,Erkan D,et al.The adjusted global antiphospholipid syndrome score(aGAPSS)and the risk of recurrent thrombosis:results from the APSACTION cohort[J].Semin Arthritis Rheum,2019,49(3):464-468.
[7] Petri M,Orbai AM,Alarcón GS,et al.Derivation and validation of the Systemic Lupus International Collaborating Clinics classification criteria for systemic lupuserythematosus[J].Arthritis Rheum,2012,64(8):2677-2686.
[8] D'Agostino RB,Vasan RS,Pencina MJ,et al.General cardiovascular risk profile for use in primary care:the Framingham Heart Study[J].Circulation,2008,117(6):743-753.
[9] Garcia L,Velloso MS,Martire MV,et al.Validation of the adjusted global antiphospholipid syndrome score in systemic lupus erythematosus patients in Argentina[J].Lupus,2020,29(14):1866-1872.
[10] Radin M,Schreiber K,Costanzo P,et al. The adjusted global antiphospholipid syndrome score(aGAPSS)for risk stratification in young APS patients with acute myocardial infarction[J].Int JCardiol,2017,240:72-77.
[11] Bahl V,Hu HM,Henke PK,et al.A validation study of a retrospective venous thromboembolism risk scoring method[J].Ann Surg,2010,251(2):344-350.
[12] Hernández-Molina G,Espericueta-Arriola G,Cabral AR.The role of lupus anticoagulant and triple marker positivity as risk factors for rethrombosis in patients with primary antiphospholipid syndrome[J].Clin Exp Rheumatol,2013,31(3):382-388.
[13] Otomo K,Atsumi T,Amengual O,et al.Efficacy of the antiphospholipid score for the diagnosis of antiphospholipid syndrome and its predictive value for thrombotic events[J].Arthritis Rheum,2012,64(2):504-512.
[14] Chen J,Sun S,Yan Q,et al.Elevated partial antiphospholipid score is a strong risk factor for thrombosis in patients with systemic lupus erythematosus:a validation study[J]. Clin Rheumatol,2016,35(2):333-340.
[15] Zuily S,de Laat B,Mohamed S,et al.Validity of theglobal anti-phospholipid syndromescoreto predict thrombosis:aprospectivemulticentrecohort study[J].Rheumatology(Oxford),2015,54(11):2071-2075.
[16] Sciascia S,Cuadrado MJ,Sanna G,et al.Thrombotic risk assessment in systemic lupus erythematosus:validation of the global antiphospholipid syndrome score in a prospective cohort[J].Arthritis Care Res(Hoboken),2014,66(12):1915-1920.

