炭疽病胁迫下采后香蕉的膜脂
代谢 吴小建 陈茜 梁朋光 赵承刚 栾会燕 谢祖强 冯小青 向昱 杨兆杏 何雪梅


摘要:【目的】從细胞膜降解角度研究芭蕉炭疽菌(Colletotrichum musae)采后侵染香蕉果实的机制,为进一步研究香蕉炭疽病及其防控措施提供理论依据。【方法】以桂蕉6号香蕉为试验材料,采用喷雾接种芭蕉炭疽菌侵染香蕉果实,以果实喷雾蒸馏水作对照,每3 d取样1次,通过测定采后贮藏过程中香蕉果实的病情指数、果实硬度及果皮电导率、细胞膜降解关键酶活性、细胞膜磷脂和脂肪酸组分与含量的变化规律,明确炭疽菌侵染对香蕉果皮膜脂代谢的影响。【结果】接种芭蕉炭疽菌可促进香蕉果实炭疽病的发生,病情指数随贮藏时间的延长而增加,同时果实硬度下降、果皮电导率升高,贮藏至第15 d,炭疽菌侵染组与对照组相比,果实的病情指数显著增加61.31%(P<0.05,下同)、果实硬度显著下降35.79%、果皮电导率显著升高27.94%。炭疽菌侵染促进香蕉果皮膜脂代谢相关酶[磷脂酶C(PLC)、磷脂酶D(PLD)和脂氧合酶(LOX)]活性增强,贮藏至第15 d,炭疽菌侵染组的果皮PLC、PLD和LOX活性较对照组分别显著提高31.21%、63.72%和26.24%;同时炭疽菌侵染加速果皮细胞膜磷脂[磷脂酰胆碱(PC)、磷脂酰肌醇(PI)和磷脂酰乙醇胺(PE)]降解为磷脂酸(PA)、不饱和脂肪酸(油酸、亚油酸和亚麻酸等)氧化为饱和脂肪酸(棕榈酸和硬脂酸等),贮藏至第15 d,与对照组相比,炭疽菌侵染组的果皮不饱和脂肪酸总量降低12.97%,饱和脂肪酸总量则提高17.77%。炭疽菌侵染促进香蕉果皮氧化,贮藏至第15 d,炭疽菌侵染组的丙二醛(MDA)和过氧化氢(H2O2)含量较对照组分别提高17.23%和13.58%。【结论】炭疽病菌侵染与贮藏期间香蕉果皮细胞膜脂代谢有关,炭疽菌侵染加剧细胞膜水解,导致细胞膜结构破坏和功能丧失,从而促使炭疽病发生。
关键词: 香蕉;炭疽病;果皮;膜脂降解酶;膜脂组分;脂肪酸
中图分类号: S668.1 文献标志码: A 文章编号:2095-1191(2021)05-1325-09
Abstract:【Objective】The mechanism of Colletotrichum musae infection in banana fruits after harvest was studied from the perspective of cell membrane degradation,which provided theoretical basis for further study of banana anthracnose and its prevention and control measures. 【Method】The banana variety Guijiao 6 was used as the raw material, banana fruits were inoculated with C. musae by spray, and spraying distilled water was control, and sampled once every 3 d. The effects of C. musae infection on lipid metabolism of banana peel membrane were studied by measuring the disease index,fruit hardness, conductivity rate, distilled water rate,the activities of key enzymes in cell membrane metabolism,the composition and content of phospholipids and fatty acids in cell membrane during postharvest storage of banana fruits. 【Result】Inoculation of C. musae could promote the occurrence of anthracnose,and the disease index increased with the prolonging of storage time,while the fruit hardness decreased and conductivity rate increased. On day 15 of storage,the disease index of the anthrax infected group significantly increased by 61.31%(P<0.05, the same below),the fruit hardness decreased by 35.79%,and the peel conductivity rate increased by 27.94% compared with the control group. C. musae infection promoted the banana peel membrane lipid metabolism related enzymes phospholipase C(PLC),phospholipase D(PLD),lipoxygenase(LOX) activities. On the day 15 of storage, the activities of PLC, PLD and LOX in banana peel were 31.21%, 63.72% and 26.24% higher than those in the control group respectively. At the same time,C. musae infection accelerated peel cell membrane phospholipid [phosphatidylcholine(PC), phosphatidylinositol(PI) and phosphatidylethanolamines(PE)] degradation to phosphatidic acid(PA), and accelerated unsaturated fatty acids(oleic acid,linoleic acid and linolenic acid) oxidation to saturated fatty acid(palmitic acid and stearic acid). On the day 15 of storage,the total amount of unsaturated fatty acids in banana peel decreased by 12.97% and the total amount of saturated fatty acids increased by 17.77% compared with the control group. Anthracnose infection promoted oxidation of banana peel. The contents of malonaldehyde(MDA) and hydrogen peroxide (H2O2) in anthracnose infection group were 17.23% and 13.58% higher than those in control group,respectively. 【Conclusion】Anthracnose infection is related to lipid metabolism of pericarp membrane during banana storage. The cell membrane hydrolysis is enhanced and lead to cell membrane structure destruction and function loss,prompting anthracnose.
Key words: banana; anthracnose; peel; membrane lipid degrading enzyme; membrane lipid component; fatty acids
Foundation item: Guangxi Natural Science Foundation(2019GXNSFAA185027, 2017GXNSFAA198177)
0 引言
【研究意义】香蕉为芭蕉科(Musaceae)芭蕉属(Musa)单子叶植物,是热带和亚热带地区的一种重要经济作物,也是全球鲜销量最大的水果(王芳等,2016)。香蕉炭疽病是由芭蕉炭疽菌(Colletotrichum musae)引起的真菌性病害,是香蕉采后保鲜过程中的主要病害之一。青果期炭疽菌以附着胞侵入,并以休眠状态潜伏于青果果皮上,待果实黄熟后才表现症状,且果实成熟度越高病害越严重,给香蕉采后贮藏和运输带来极大挑战(Huang et al.,2012;Zhu et al.,2016)。因此,探明香蕉采后炭疽病发生的作用机制及其调控机理对延长香蕉采后贮藏保鲜具有重要意义。【前人研究进展】目前,香蕉炭疽病的研究主要集中在采前炭疽菌侵染规律及采后发病机理方面。学者们对香蕉炭疽病的侵染来源有不同观点,有的认为侵染源是携菌的花器和苞片(王壁生,1989;Bellaire and Mourichon,1997),而有的学者认为携菌量高的假茎和叶(病残体)才是真正的侵染源(古瑞琼,1986;解修超,2004)。芭蕉炭疽菌的侵染过程存在潜伏侵染的特点,解修超(2004)从组织病理学方面证实了香蕉炭疽病菌具有该特性,深色附着胞是香蕉炭疽菌的主要潜伏形式;Zhu等(2016)在青果期果实表皮细胞壁检测到芭蕉炭疽菌的侵染丝,但深入侵染需等果实成熟才能完成。芭蕉炭疽菌潜伏侵染发生的生理基础可归纳为三方面:寄主生理生化因素如营养不足和存在抑制病菌的有毒物质等,真菌侵入寄主后产生抗菌化合物植保素的影响,寄主内物理因素如病菌侵入后受到寄主组织木质部等阻碍停止扩展(Bazie et al.,2014;Zhu et al.,2016;Zhimo et al.,2017)。采后香蕉炭疽病的发病机理与果实后熟的生理生化进程密切相关,学者们认为病原菌从潜伏状态转变为致病状态的原因有2个方面:一是因为随着香蕉成熟,炭疽菌可利用的营养物质增加(可溶性糖和可溶性果胶),而多巴胺等抗菌物质含量明显下降(刘惠怡等,1990;谢春艳等,1999);二是由于果实的成熟和衰老导致生理代谢失衡,大量活性氧(ROS)累积造成细胞膜结构破坏和功能丧失,同时过氧化物酶(POD)和多酚氧化酶(PPO)活性降低,导致果实的抗氧化能力减弱(Unnithan et al.,2018;Madjouko et al.,2019);细胞膜降解导致液泡中几丁酶和β-1,3-葡聚糖酶释放,降解炭疽菌细胞壁,引起病原菌从潜伏状态成为致病状态(Darvill and Albershim,1984;蒋跃明,1997)。【本研究切入点】目前对炭疽病侵染的发病机制尚不明确,但前人研究表明细胞膜结构的破坏和功能丧失是重要的原因之一(Zhu et al.,2016;Zhimo et al.,2017),本研究以膜脂降解途徑为关注点,从细胞膜降解角度研究芭蕉炭疽菌在采后香蕉果实中的发病机制。【拟解决的关键问题】研究芭蕉炭疽菌侵染过程中香蕉果皮细胞膜脂代谢相关酶及细胞膜组成物质的变化规律,明确细胞膜系统对炭疽病的响应机制,为进一步研究香蕉炭疽病及制定防控措施提供理论依据。
1 材料与方法
1. 1 试验材料
香蕉品种选取广西主栽的桂蕉6号,于2019年9月27日摘自广西南宁市坛洛镇果园,当天运回实验室,挑选成熟期一致、大小均一、无机械伤、无病害的果实进行试验。芭蕉炭疽菌由广西农业科学院植物保护研究所提供。蔗糖、二硫代苏糖醇、苯甲基磺酰氟、乙二醇双(2-氨基乙基醚)四乙酸(EGTA)、氯化钠、氯化钙、四硼酸钠、硼酸和磷酸钠等试剂购自生工生物工程(上海)股份有限公司;巯基乙醇购自北京鼎国昌盛生物技术有限公司;磷脂酶C(PLC)、磷脂酶D(PLD)和脂氧合酶(LOX)活性测定试剂盒及磷脂酸(PA)、磷脂酰胆碱(PC)、磷脂酰肌醇(PI)和磷脂酰乙醇胺(PE)含量测定试剂盒均购自上海江莱生物科技有限公司。
主要仪器设备:Beckman J-301高速冷冻离心机(德国Beckman公司)、BioTek Epoch全波长酶标仪(美国BioTek公司)、RS232C分光光度计(德国Eppendorf公司)、GY-4型果实硬度计(乐清市艾德堡仪器有限公司)、GC-2010 Plus气相色谱仪(日本岛津有限公司)、DDS-IIA型电导率仪(上海盛磁仪器有限公司)、BIC-300人工气候箱(上海博迅实业有限公司)和JY6002电子天平(上海良平仪器仪表有限公司)。
1. 2 试验方法
1. 2. 1 炭疽菌侵染香蕉样品处理 感染炭疽病香蕉果实是采用人工喷雾接种芭蕉炭疽菌分生孢子悬液(106个孢子/mL)获得,以喷雾蒸馏水作对照。喷雾处理后用0.03 mm厚聚乙烯薄膜袋包装,于20 ℃下贮藏,观察炭疽病发生情况,接种后每3 d取样1次。
1. 2. 2 病情指数测定 参照郑永华等(2001)的方法并加以改进,根据香蕉果实表面腐烂面积分为0级果(无病斑)、1级果(<1/10病斑)、2级果(1/10~1/4病斑)、3级果(1/4~1/2病斑)和4级果(>1/2病斑)。取样后每天测量病斑大小,病情指数(%)=Σ(腐烂级别×该级别样品数量)/(最高级别×样品总数量)×100。
1. 2. 3 香蕉果实硬度测定 采用GY-4型果实硬度计测定香蕉果肉硬度,硬度计针头为圆筒型,直径5 mm,长度10 mm。每次随机取3个果实,去皮后固定在硬度计托盘上,测定中段果实硬度,每个果实测定3个点,3个值的平均值为该果实硬度。
1. 2. 4 电导率测定 取香蕉果皮2 g,蒸馏水冲洗3次并用滤纸吸干,放入50 mL离心管中,加20 mL蒸馏水,振荡1 h后测电导率;煮沸20 min后,冷却至室温再测电导率。细胞膜透性为前后2次电导率之比所得的相对电导率。试验重复3次。
1. 2. 5 膜脂代谢相关酶活性测定 取0.5 g冷冻果皮粉末,加入4.5 mL预冷的HEPES缓冲液(pH 7.0,含0.32 mol/L蔗糖、1 mmol/L二硫代苏糖醇、1 mmol/L苯甲基磺酰氟和1 mmol/L EGTA),振荡混匀,在4 ℃下3000×g离心15 min,收集上清液待测。膜脂代谢相关酶PLC、PLD和LOX活性参照酶联免疫分析试剂盒说明进行测定。
1. 2. 6 膜磷脂组分含量测定 取0.1 g冷冻果皮粉末,加入1.0 mL氯仿/甲醇溶液(2∶1,v/v)超声波提取30 min后,室温下静置30 min,在4 ℃下3000×g离心20 min,收集上清液待测。膜磷脂组分PA、PC、PI和PE含量参照酶联免疫分析试剂盒说明进行测定。
1. 2. 7 果皮细胞膜脂脂肪酸组分和含量测定 取0.1 g冷冻果皮粉末,于100 ℃下钝化处理10 min后加入氯仿—甲醇溶液(1∶2)研磨,提取果皮总脂肪,采用石油醚反复萃取,去除总脂肪提取液中的中性脂,得到极性脂。极性脂甲酯化处理后,参照林毅雄等(2019)的方法,采用气相色谱仪测定香蕉果皮细胞膜脂脂肪酸组分含量,并计算香蕉果皮细胞膜脂脂肪酸相对含量。气相色谱测定参数:层析柱长2 m,直径4 mm,固定液为30% DEGS,柱槽温度190~195 ℃,进样器温度250 ℃,H2火焰温度210 ℃,载气N2流量50 mL/s。使用归一法计算各脂肪酸相对含量。
1. 2. 8 果皮丙二醛(MDA)含量测定 参照曹建康等(2007)的方法,取0.1 g冷冻果皮粉末,加入9.0 mL磷酸盐缓冲液(含0.1 mol/L Na2HPO4·12H2O和0.1 mol/L NaH2PO4·2H2O,pH 7.4)研磨至匀浆,在20 ℃下3000×g离心20 min,收集上清液,按照植物MDA ELISA试剂盒说明测定MDA含量。
1. 2. 9 过氧化氢(H2O2)含量测定 参照许佳妮等(2016)的方法并加以改进。
1. 3 统计分析
采用SPSS 13.0对试验数据进行统计分析,利用Duncans新复极差法进行因素水平间的显著性方差分析,采用Origin 2018制图。
2 结果与分析
2. 1 炭疽菌侵染对香蕉果实病情指数的影响
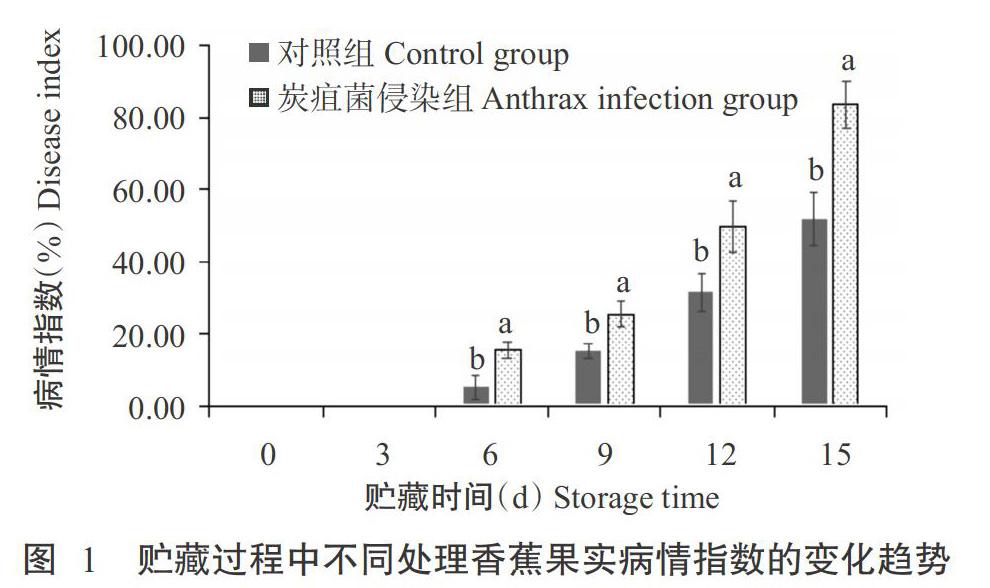
病情指数是反映果蔬贮藏期间病害发生程度的一个重要指标。由图1可知,随着贮藏时间的延长和果实的不断成熟,香蕉果实病情指数呈上升趋势,炭疽菌侵染组的果实病情指数在贮藏6 d后开始显著高于对照组(P<0.05,下同);贮藏至第15 d,对照组的病情指数从0升至51.90%,而炭疽菌侵染组的病情指数从0升至83.72%,较对照组提高61.31%。说明随着香蕉果实的成熟,病菌对果实的侵染逐渐加深,促使果实病斑扩大和增加,病情指数呈上升趋势。
2. 2 炭疽病胁迫下香蕉果实硬度的变化
果实硬度是评价香蕉采后耐贮性的重要品质指标之一。由图2可知,随着贮藏时间的延长,香蕉果实逐渐成熟,果实硬度呈下降趋势,其中对照组硬度从贮藏0 d最高的325.14 N/cm2下降到贮藏15 d的最低值(52.44 N/cm2);从第6 d开始炭疽菌侵染组香蕉果实硬度下降速度较对照组快,且二者间显著差异,从贮藏0 d最高的318.02 N/cm2下降到贮藏15 d的最低值(33.67 N/cm2),贮藏15 d后,炭疽菌侵染组果实的硬度较对照组下降35.79%。可见,接种炭疽菌处理致使香蕉果实的成熟度提前、果实硬度下降。
2. 3 炭疽病胁迫下香蕉果皮电导率的变化
炭疽菌侵染会破坏果皮细胞膜的完整性,电导率是反映果皮细胞膜完整性的重要指标。如图3所示,电导率随着香蕉果实贮藏时间的延长和成熟度的增加呈逐渐上升趋势,从贮藏第6 d起炭疽菌侵染组的果皮电导率显著高于对照组电导率,且二者间的电导率差距逐渐增大,贮藏至第15 d,炭疽菌侵染组的果皮电导率较对照组提高27.94%。由此可知,炭疽菌侵染香蕉致使其果皮细胞膜发生破损,导致电导率上升,且贮藏早期对细胞膜影响远小于贮藏后期。
2. 4 炭疽菌侵染对香蕉果皮膜脂代谢相关酶活性的影响
2. 4. 1 PLC活性的变化 PLC是一类重要的细胞膜磷脂水解酶,在植物细胞的信号转导中PLC及其产物均发挥重要的媒介作用。PLC可水解磷脂产生三磷酸肌醇和二酰甘油。由图4可知,在香蕉果实贮藏过程中,果皮PLC活性呈先上升后下降的变化趋势;从贮藏第3 d开始,炭疽菌侵染组与对照组间存在显著差异,二者均在贮藏第9 d达最高值,分别为513.07和383.70 U/g,贮藏至第15 d,炭疽菌侵染组的果皮PLC活性较对照组提高31.21%。由此推测,炭疽菌侵染香蕉能提高香蕉果皮PLC活性,使得香蕉在抗逆过程中起到更主动的作用。
2. 4. 2 PLD活性的變化 PLD是细胞膜脂结构降解的起始酶,也是细胞磷脂催化分解的一个关键酶,可催化磷脂生成PA和胆碱等降解产物。由图5可知,在香蕉果实贮藏过程中,对照组和炭疽菌侵染组的果皮PLD活性均呈先上升后略微下降的变化趋势,从贮藏第3 d开始对照组与炭疽菌侵染组间存在显著差异;贮藏至第9 d,二者的差异达最大值,炭疽菌侵染组的果皮PLD活性较对照组提高72.56%,贮藏至第15 d,炭疽菌侵染组的果皮PLD活性较对照组提高63.72%。由此可知,在炭疽菌侵染香蕉果实的过程中,PLD活性升高导致细胞膜降解进程加快。
2. 4. 3 LOX活性的变化 LOX以不饱和脂肪酸为底物,催化植物中亚油酸和亚麻酸等多元不饱和脂肪酸的加氧反应,导致不饱和脂肪酸形成氢过氧化物,引发膜脂过氧化而造成细胞膜的伤害。由图6可知,在香蕉果实贮藏过程中,对照组和炭疽菌侵染组的果皮LOX活性均呈先上升后下降的变化趋势,且在炭疽菌侵染的第3 d开始二者间存在显著差异,贮藏第6 d达最大值,分别为801.20和960.13 U/g,贮藏至第15 d炭疽菌侵染组的果皮LOX活性较对照组提高26.24%。可见,炭疽菌侵染可促使LOX活性增加,导致细胞膜破损,从而使得果实病害加重。
2. 5 炭疽病侵染对香蕉果皮细胞膜磷脂组分的影响
2. 5. 1 PC含量的变化 PC是细胞膜磷脂的重要组成部分,是PLD的主要底物,脂酰胆碱含量的变化与细胞衰老和细胞膜损伤有关。由图7可知,随着贮藏时间的延长,香蕉果皮PC含量大致呈逐渐下降趋势,其中对照组果皮的PC含量从贮藏0 d最高的2310 μmol/g下降至贮藏15 d的1508 μmol/g;炭疽菌侵染组的果皮PC含量则下降到贮藏15 d的916 μmol/g;从贮藏第9 d起炭疽菌侵染组与对照组间出现显著差异,贮藏至第12 d时,二者差异达最大值,炭疽菌侵染组的果皮PC含量较对照组降低46.44%。
2. 5. 2 PI含量的变化 PI在PLC和PLD的作用下水解成二酰甘油(DAG)和肌醇三磷酸。由图8可知,随着贮藏时间的延长,香蕉果皮PI含量呈下降趋势;在贮藏第3、9和12 d,炭疽菌侵染组的果皮PI含量显著低于对照组,贮藏至第12 d时二者的PI含量差异最大,炭疽菌侵染组的果皮PI含量较对照组降低26.70%。可见,在香蕉果实成熟衰老过程中PI一直在进行转化分解,而病原菌侵染使得PI分解加速。
2. 5. 3 PE含量的變化 PE也是PLD的主要底物之一。由图9可知,香蕉果皮PE含量随贮藏时间的延长而呈逐渐下降趋势,从贮藏第6 d起炭疽菌侵染组的果皮PE含量即显著低于对照组,至贮藏第15 d时,PE含量较对照组降低35.93%。
2. 5. 4 PA含量的变化 PA是PLD水解细胞膜的直接产物,在脂质合成代谢过程中具有重要作用;PA也是信号分子,广泛参与生长、发育和逆境胁迫的调控过程。由图10可知,对照组香蕉果皮PA含量呈先上升后下降的变化趋势,而炭疽菌侵染组在贮藏过程中一直呈上升趋势。在贮藏3 d后炭疽菌侵染组与对照组间的香蕉果皮PA含量呈现显著差异,至贮藏第15 d,二者间的差距最大,与对照组相比,炭疽菌侵染组果皮PA含量增加35.91%。由此可见,炭疽菌侵染导致细胞膜降解加强,PA大量积累。
2. 6 炭疽菌侵染对香蕉果皮细胞膜脂脂肪酸含量的影响
脂肪酸是细胞膜骨架的重要组分之一,细胞膜结构的稳定与流动性受其组分和组分间比例影响极大,低饱和脂肪酸比例有利于保持细胞膜流动性,增强果实抗逆性(Wang et al.,2016)。从表1可知,采后香蕉果皮的脂肪酸中,饱和脂肪酸以棕榈酸(21.92%)和硬脂酸(6.93%)为主,而不饱和脂肪酸以油酸(3.98%)、亚油酸(32.83%)和亚麻酸(27.86%)为主。贮藏过程中对照组和炭疽菌侵染组的香蕉果皮脂肪酸组分未发生改变,总体趋势均表现为不饱和脂肪酸总量逐渐降低,而饱和脂肪酸总量逐渐增加;从贮藏第3 d开始,炭疽菌侵染组的香蕉果皮不饱和脂肪酸总量显著低于对照组,而饱和脂肪酸总量显著高于对照组,至贮藏第15 d,与对照组相比,炭疽菌侵染组的香蕉果皮不饱和脂肪酸总量降低12.97%,饱和脂肪酸总量则提高17.77%,说明炭疽菌侵染能促进果皮中不饱和脂肪酸比例的降低。脂肪酸不饱和度即不饱和脂肪酸含量与饱和脂肪酸含量的比值,是衡量膜脂脂肪酸不饱和程度的重要指标,贮藏后期(第6 d以后),炭疽菌侵染组香蕉果皮的脂肪酸不饱和度呈迅速下降趋势,且显著低于对照组。
2. 7 炭疽菌侵染对香蕉果皮过氧化的影响
H2O2是植物细胞在生理代谢过程中的一种活性氧,当植物受到病害等外界胁迫时,即打破活性氧的产生—清除系统导致活性氧大量积累,从而促进细胞膜脂过氧化过程,并产生MDA,MDA导致细胞膜结构破坏,最终致使果蔬采后衰老或发生病害(Tian et al.,2013)。由图11可知,对照组和炭疽菌侵染组的香蕉果皮H2O2含量在贮藏期间均呈逐渐上升趋势,从贮藏第3 d开始炭疽菌侵染组的香蕉果皮H2O2含量显著高于对照组(第9 d除外),贮藏至第15 d,炭疽菌侵染组的香蕉果皮H2O2含量较对照组高13.58%。
MDA含量可表示细胞膜脂的过氧化程度,如图12所示,对照组和炭疽菌侵染组的香蕉果皮MDA含量变化趋势基本相同,均呈先缓慢后急剧上升的变化趋势,但炭疽菌侵染组在3~6 d内明显上升,果皮中MDA快速累积的时间较对照组提前;炭疽菌侵染组的香蕉果皮MDA含量从贮藏第3 d开始均高于对照组,贮藏至第15 d,炭疽菌侵染组的果皮MDA含量高于对照组17.23%。说明炭疽病胁迫对香蕉果皮的细胞膜有破坏作用,贮藏过程中细胞膜损伤严重,促进了细胞膜的过氧化程度。
3 讨论
香蕉炭疽病是由芭蕉炭疽菌引起的真菌性病害,其特征是在果实采前侵染、果实完成成熟后发病,是香蕉采后的最重要病害之一,表现为果皮褐变和果肉腐烂(Gunasinghe and Karunaratne,2009)。本研究中,喷雾接种炭疽菌孢子菌悬液可促进香蕉炭疽病的发生,提高发病指数、降低果实硬度,与李丽等(2017)报道的采后接种炭疽病菌可促进香蕉果实发病的研究结果一致。
炭疽病的发生涉及许多复杂而有规律的生理代谢过程,细胞膜在维持细胞完整的区域化结构和为生物体提供正常的生理代谢活动等方面发挥着关键作用。细胞膜损伤是导致采后病害发生的主要原因(Tian et al.,2013;许佳妮等,2016;单婷婷等,2017;Dukare et al.,2019)。本研究中,香蕉炭疽病发病期间果皮电导率持续上升,表明香蕉果皮细胞膜受到损伤,细胞膜结构的变化导致细胞渗透调节能力下降和细胞质外流,推测细胞膜降解在果皮细胞对炭疽病响应中起关键作用。该结论与采后龙眼果实衰老劣变及柑橘油胞病发病中果皮细胞膜降解响应一致(许佳妮等,2016;林毅雄等,2019)。
逆境胁迫下细胞膜最先受到伤害,膜脂的水解、脂肪酸中不饱和比例降低及活性氧的累积等均会促进细胞膜结构破坏和病害发生(余经等,2020)。植物细胞膜磷脂水解关键酶包括PLC和PLD等,酶活性升高是导致膜脂降解的主要原因。PLC和PLD可催化磷脂(PC、PI和PE等)生成PA和胆碱等降解产物,因此磷脂的降解程度可通过PLC和PLD活性进行判断(Lin et al.,2016)。本研究中,从贮藏第3 d开始,香蕉炭疽菌侵染组的果皮PLC和PLD活性显著高于对照组,表明在贮藏后期,PLC和PLD对细胞膜的水解能力逐渐增强,导致细胞膜降解。与此同时,PLC和PLD的磷脂底物PC、PI和PE含量均呈降低趋势,产物PA的含量逐渐增加,细胞膜透性增强,果皮电导率增大,炭疽病病情指数升高,果实腐烂加重。
LOX是膜脂过氧化的启动酶和关键酶,可将不饱和脂肪酸催化成饱和脂肪酸,在病害等逆境胁迫中发挥重要作用(Tian et al.,2013)。本研究中,炭疽菌侵染组的香蕉果皮LOX活性从贮藏第3 d开始显著高于对照组,说明炭疽菌侵染组的果皮过氧化程度较高,高H2O2含量和MDA含量印证了果皮的过氧化,与此同时,LOX的底物亚油酸和亚麻酸含量从贮藏第6 d起始终低于对照组,活性氧累积与膜脂不饱和脂肪酸氧化为饱和脂肪酸的协同效果,造成细胞膜降解,与、蓝莓(周倩,2014)、黄瓜(赵宇瑛,2011)柑橘(许佳妮等,2016)、龙眼(林毅雄等,2019)等在逆境胁迫下不饱和脂肪酸的变化规律表现一致。
4 结论
炭疽病菌侵染与贮藏期间香蕉果皮细胞膜脂代谢有关,炭疽菌侵染加剧细胞膜水解,导致细胞膜结构破坏和功能丧失,从而促使炭疽病发生。
参考文献:
曹建康,姜微波,赵玉梅. 2007. 果蔬采后生理生化实验指导[M]. 北京:中国轻工业出版社:68-70. [Cao J K,Jiang W B,Zhao Y M. 2007. Instruction of fruit and vegetable postharvest physiological and biochemical experiments[M]. Beijing:China Light Industry Press:68-70.]
古瑞琼. 1986. 香蕉炭疽菌和镰刀菌潜伏侵染初步研究[J]. 热带作物学报,(4):63-67. [Gu R Q. 1986. Preliminary study on the latent infection of anthrax and fusarium in banana[J]. Chinese Journal of Tropical Crops,(4):63-67.]
蒋跃明. 1997. 香蕉采后炭疽病发生与几丁酶、β-1,3-葡聚糖酶和多巴胺的关系[J]. 植物生理学报,23(2):158-162. [Jiang Y M. 1997. Incidence of anthracnose in relation to chitinase,β-1,3-glucanase and dopamine of banana fruits after harvest[J]. Physiology and Molecular Biology of Plants,23(2):158-162.]
李丽,何雪梅,李昌宝,孙健,零东宁,盛金凤,饶川艳,肖占仕,李杰民,郑凤锦,刘国明,唐雅园. 2017. 炭疽病菌侵染对香蕉采后品质变化及抗病相关酶活性的影响[J]. 现代食品科技,33(9):83-90. doi:10.13982/j.mfst.1673-9078. 2017.9.012. [Li L,He X M,Li C B,Sun J,Ling D N,Sheng J F,Rao C Y,Xiao Z S,Li J M,Zheng F J,Liu G M,Tang Y Y. 2017. Effects of Colletotrichum musae infection on the postharvest quality and related enzymatic activities of banana fruit[J]. Modern Food Science and Technology,33(9):83-90.]
林毅雄,林河通,陳艺晖,王慧,林艺芬. 2019. 采前喷施胺鲜酯对采后龙眼果实贮藏期间果皮膜脂代谢的影响[J]. 食品科学,40(21):203-210. doi:10.7506/spkx1002-6630-20181224-283. [Lin Y X,Lin H T,Chen Y H,Wang H,Lin Y F. 2019. Effect of pre-harvest spraying of diethyl aminoethyl hexanoate on membrane lipid metabolism in pericarp of longan fruits during postharvest storage[J]. Food Science,40(21):203-210.]
刘惠怡,林爝尧,彭埃天,温兆清,李燕文. 1990. 香蕉采后生理变化与炭疽病发病的关系[J]. 中国果树,(2):30-32. doi:10.16626/j.cnki.issn1000-8047.1990.02.011. [Liu H Y,Lin J Y,Peng A T,Wen Z Q, Li Y W. 1990. Relationship between postharvest physiological changes of banana and the incidence of anthracnose[J]. China Fruits,(2):30-32.]
单婷婷,林育钊,林毅雄,孙钧政,林艺芬,林河通. 2017. 龙眼果实采后保鲜技术研究进展[J]. 亚热带农业研究,13(2):139-143. doi:10.13321/j.cnki.subtrop.agric.res.2017. 02.13. [Shan T T,Lin Y Z,Lin Y X,Sun J Z,Lin Y F,Lin H T. 2017. Research progress on postharvest storage technologies of longan(Dimocarpus longan Lour.) fruits[J]. Subtropical Agriculture Research,13(2):139-143.]
王壁生. 1989. 广东香蕉采后病害研究[J]. 广东农业科学,(4):42-43. doi:10.16768/j.issn.1004-874x.1989.04.018. [Wang B S. 1989. Study on postharvest diseases of banana in Guangdong[J]. Guangdong Agricultural Sciences,(4):42-43.]
王芳,郇青鶴,柯佑鹏,过建春,刘秋冬. 2016. 中国香蕉产业的全要素生产率、技术进步与效率变化[J]. 广东农业科学,43(12):168-175. doi:10.16768/j.issn.1004-874X. 2016.12.027. [Wang F,Huan Q H,Ke Y P,Guo J C,Liu Q D. 2016. Changes of total factor productivity,technological progress and efficiency in Chinese banana industry[J]. Guangdong Agricultural Sciences,43(12):168-175.]
谢春艳,宾金华,陈兆平,莫熙穆. 1999. 多酚氧化酶及其生理功能[J]. 生物学通报,34(6):15-17. [Xie C Y,Bin J H,Chen Z P,Mo X M. 1999. Polyphenol oxidase and its physiological functions[J]. Bulletin of Biology,34(6):15-17.]
解修超. 2004. 香蕉炭疽病采前侵染规律及分子检测研究[D]. 儋州:华南热带农业大学. [Xie X C. 2004. Studies on preharvest regularity of infection and molecular detection of banana anthraenose[D]. Danzhou:South China University of Tropical Agriculture.]
许佳妮,曹琦,邓丽莉,姚世响,王威浩,曾凯芳. 2016. 低成熟度柑橘果实油胞病发病进程中的膜脂代谢[J]. 食品科学,37(24):262-270. doi:10.7506/spkx1002-6630-2016 24042. [Xu J N,Cao Q,Deng L L,Yao S X,Wang W H,Zeng K F. 2016. Membrane lipid metabolism in the pathogenesis of low maturity citrus oleifera[J]. Food Science,37(24):262-270.]
余经,林育钊,范中奇,林艺芬,林河通. 2020. 果蔬采后病害的发生与活性氧和膜脂代谢的关系研究进展[J]. 亚热带农业研究,16(2):132-137. doi:10.13321/j.cnki.subtrop. agric.res.2020.02.011. [Yu J,Lin Y Z,Fan Z Q,Lin Y F,Lin H T.2020. Research progress on the relationship between disease occurrence and the metabolism of reactive oxygen species and membrane lipids in postharvest fruits and vegetables[J]. Subtropical Agriculture Research,16(2):132-137.]
赵宇瑛. 2011. 黄瓜磷脂酶D和抗氧化系统对采后机械损伤胁迫的响应[D]. 杭州:浙江大学. [Zhao Y Y. 2011. Response of phospholipase and antioxidant system to mechanical wounding in postharvest cucumber fruits[D]. Hangzhou:Zhejiang University.]
郑永华,苏新国,毛杭云. 2001. 纯氧处理草莓的保鲜效果初探[J]. 南京农业大学学报,24(3):85-88. [Zheng Y H,Su X G,Mao H Y. 2001. A preliminary study on the effects of pure oxygen on strawberry fruit storage[J]. Journal of Nanjing Agricultural University,24(3):85-88.]
周倩. 2014. 冷藏蓝莓果蒂凹陷的发生机理及控制技术研究[D]. 沈阳:沈阳农业大学. [Zhou Q. 2014. Study on the mechanism and control technology of frozen blueberry pedicle depression[D]. Shenyang: Shenyang Agriculture University.]
Bazie S,Ayalew A,Woldetsadik K. 2014. Integrated management of postharvest banana anthracnose(Colletotrichum musae) through plant extracts and hot water treatment[J]. Crop Protection,66:14-18. doi:10.1016/j.cropro.2014. 08.011.
Bellaire L D L D,Mourichon X. 1997. The pattern of fungal contamination of the banana bunch during its development and potential influence on incidence of crown-rot and anthracnose diseases[J]. Plant Pathology,46(4):481-489. doi:10.1046/j.1365-3059.1997.d01-34.x.
Darvill A G,Albershim P. 1984. Phytoalexins and their elictors-a defense against microbial infection in plants[J]. Annual Review of Plant Physiology,35(1):243-275. doi:10.1146/annurev.arplant.35.1.243.
Dukare A S,Paul S,Nambi V E,Gupta R K,Singh R,Sharma K,Vishwakarma R K. 2019. Exploitation of microbial antagonists for the control of postharvest diseases of fruits:A review[J]. Critical Reviews in Food Science and Nutrition,59(9):1498-1513. doi:10.1080/10408398.2017. 1417235.
Gunasinghe W K R N,Karunaratne A M. 2009. Interactions of Colletotrichum musae and Lasiodiplodia theobromae and their biocontrol by Pantoea agglomerans and Flavobacterium sp. in expression of crown rot of “Embul” banana[J]. BioControl,54(4):587-596. doi:10.1007/s10526- 009-9210-4.
Huang G T,Ma S L,Bai L P,Zhang L,Ma H,Jia P,Liu J,Zhong M,Guo Z F. 2012. Signal transduction during cold, salt,and drought stresses in plants[J]. Molecular Biology Reports,39:969-987. doi:10.1007/s11033-011-0823-1.
Lin Y F,Lin H T,Lin Y X,Zhang S,Chen Y H,Jiang X J. 2016. The roles of metabolism of membrane lipids and phenolics in hydrogen peroxide-inducedpericarp brow-ning of harvested longan fruit[J]. Postharvest Biology and Technology,111:53-61. doi:10.1016/j.postharvbio.2015. 07.030.
Madjouko M A,Nguemezi S T,Tchinda E S,Dongmo P M J,Kamsu P M,Kamga V A M S,Sameza M L,Francois T,Menut C. 2019. Inhibitory effects of essential oils from Ocimum basilicum and Ocimum gratissimum on Colletotrichum musae:The causal agent of bananas anthracnose[J]. Journal of Phytopathology,167(3):257-264. doi:10. 1111/jph.12793.
Tian S P,Qin G Z,Li B Q. 2013. Reactive oxygen species involved in regulating fruit senescence and fungal pathogenicity[J]. Plant Molecular Biology,82(6):593-602. doi: 10.1007/s11103-013-0035-2.
Unnithan R R,Thammaiah N,Kulkarni M S,Gangadharappa P M. 2018. Physiological studies of Colletotrichum musae the causal agent of anthracnose disease of banana[J]. International Journal of Plant Protection,11(1):87-92. doi:10.15740/HAS/IJPP/11.1/87-92.
Wang Q,Ding T,Zuo J H,Gao L P,Fan L L. 2016. Amelioration of postharvest chilling injury in sweet pepper by glycine betaine[J]. Postharvest Biology and Technology,112: 114-120. doi:10.1016/j.postharvbio.2015.12.026.
Zhimo V Y,Dilip D,Sten J,Ravat V K,Bhutia D D,Panja B,Saha J. 2017. Antagonistic yeasts for biocontrol of the banana postharvest anthracnose pathogen Colletotrichum musae[J]. Journal of Phytopathology,165(1):35-43. doi: 10.1111/jph.12533.
Zhu X Y,Lin H Z,Si Z W,Xia Y H,Chen W X,Li X P. 2016. Benzothiadiazole-mediated induced resistance to
Colletotrichum musae and delayed ripening of harvested
banana fruit[J]. Journal of Agricultural and Food Chemi-
stry, 64(7):1494-1502. doi:10.1021/acs.jafc.5b05655.
(責任编辑 罗 丽)

