Wnt通路中亮氨酸重复序列G蛋白偶联受体5/6在儿童急性淋巴细胞白血病中的表达及意义
李 宣,王文鹏,周 敏,徐晓蕊,高吉照
徐州医科大学附属医院儿科,江苏徐州 221002
急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)是一种恶性血液系统疾病,起源于B或T淋巴细胞在骨髓内的异常增殖,其发病机制暂不明确。ALL是儿童期最常见的肿瘤性疾病,其中以B-ALL最常见,约占儿童ALL的80%[1]。随着化疗方案的不断改进,ALL患儿的5年无病生存率可达80%[2],但仍有一部分患儿出现耐药和复发,甚至死亡。Wnt/β-连环蛋白信号通路的异常激活与ALL的发病关系密切,富含亮氨酸重复序列G蛋白受体(leucine-rich repeat-containing G-protein coupled receptor,LGR)5/6是Wnt/β-连环蛋白信号通路中的重要因子,参与多种肿瘤的发生发展。本研究通过检测ALL患儿骨髓细胞中LGR5和LGR6 mRNA及蛋白的表达,探讨其在儿童ALL中的表达及意义。
对象和方法
对象选取2017年1月至2020年2月于徐州医科大学附属医院就诊的新发ALL和免疫性血小板减少症(immue thrombocytopenia,ITP)患儿为研究对象。ALL患儿入组标准:新发ALL患儿经诱导化疗第33天骨髓达完全缓解者。排除标准:(1)诱导缓解治疗期间放弃治疗、转外、死亡者;(2)经诱导化疗第33天骨髓未缓解者;(3)伴髓系标记者;(4)有其他恶性疾病者;(5)确诊前使用激素及其他免疫抑制剂者;(6)不同意入组者。纳入研究的ALL患儿39例,其中男22例、女17例,年龄1.4~12岁,平均年龄(6.2±3.6)岁。以治疗前作为初发组,经诱导化疗第33天骨髓达完全缓解时为缓解组;根据危险度分层再分为低危组(n=16)、中危组(n=9)和高危组(n=14),ALL分层标准为与儿童ALL危险度相关的因素:包括(1)诊断时年龄<1岁或≥10岁;(2)诊断时外周血白细胞计数>50×109/L;(3)诊断时已发生中枢神经系统白血病(central nervous system leukemia,CNSL)或睾丸白血病(testicular leukemia,TL);(4)免疫表型为T系ALL;(5)细胞及分子遗传学特征:染色体数目<45的低二倍体、t(9;22)(q34;q11.2)/BCR-ABL1、t(4;11)(q21;q23)/MLL-AF4或其他MLL基因重排、t(1;19)(q23;p13)/E2A-PBX1;(6)泼尼松反应不良;(7)诱导缓解治疗第15天骨髓原始及幼稚淋巴细胞≥25%;(8)微小残留病灶(minimal residual disease,MRD)水平:诱导缓解治疗结束(化疗第33天)MRD≥1×10-4(本研究骨髓符合完全缓解标准),或巩固治疗开始前(第12周)MRD≥1×10-3。在上述危险因素的基础上将儿童ALL的临床危险度分为3型:低危组:不具备上述任何一项危险因素者。中危组:具备以下任何1项或多项者:(1)诊断时年龄≥10岁或<1岁;(2)诊断时外周血白细胞计数≥50×109/L;(3)诊断时已发生CNSL和/或TL;(4)免疫表型为T系ALL;(5)t(1;19)(q23;p13)/E2A-PBX1阳性;(6)初诊危险度为低危,在诱导缓解治疗第15天骨髓原始及幼稚淋巴细胞≥25%;(7)诱导缓解治疗末(第33天)MRD≥l×10-4,且<1×10-2。高危组:具备以下任何1项或多项者:(1)t(9;22)(q34;q11.2)/BCR-ABL1阳性;(2)t(4;11)(q21;q23)/MLL-AF4或其他MLL基因重排阳性;(3)泼尼松反应不良;(4)初诊危险度为中危经诱导缓解治疗第15天骨髓原始及幼稚淋巴细胞≥25%;(5)诱导缓解治疗结束(化疗第33天)MRD>1×10-2(本研究骨髓符合完全缓解标准),或巩固治疗开始前(第12周)MRD≥1×10-3[3]。ITP患儿30例纳入对照组,其中男20例、女10例,年龄0.3~12岁,平均年龄(4.6±3.5)岁。各组年龄和性别构成比差异无统计学意义。ALL患儿的诊断、危险度分层和诱导化疗方案依据《儿童急性淋巴细胞白血病诊疗建议(第4次修订)》[3],ITP患儿的诊断依据《儿童原发性免疫性血小板减少症诊疗建议》[4]。本研究获得本院伦理委员会批准(XZFY2020-KL153- 01)。
主要试剂与仪器淋巴细胞分离液(MP Biomedicals公司,美国)、TRIzol(Invitrogen 公司,美国)、cDNA第一链合成试剂盒(Thermo Fisher公司,美国)、全蛋白抽提试剂盒(中国江苏凯基生物技术股份有限公司)、BCA蛋白含量检测试剂盒(中国江苏凯基生物技术股份有限公司)、兔抗-GAPDH(中国江苏凯基生物技术股份有限公司)、兔抗-LGR5(Abcamplc公司,英国)、兔抗-LGR6(Abcam公司,英国),普通梯度PCR仪(美国ABI Veriti 96 well Thermal cycler)、Western blot检测试剂盒(中国江苏凯基生物技术股份有限公司)、荧光定量PCR循环仪(ABI Step one plus Real time-PCR system,美国)、多功能酶标仪(MD Spectramac M3,美国);引物由中国凯基生物技术股份有限公司设计合成。
标本制备分别取初发组、缓解组及对照组骨髓血3 ml,乙二胺四乙酸抗凝,密度梯度离心法分离单个核细胞,磷酸盐平衡生理盐水(phosphate buffer saline,PBS)液洗涤3次,将单个核细胞和血浆分别移至不同EP管,-80 ℃冻存。
逆转录聚合酶链反应逆转录聚合酶链反应法检测骨髓细胞中LGR5和LGR6 mRNA表达水平。依据TRIzol说明书提取总RNA。取5 μl RNA至495 μl 1×TE缓冲液中,测定其在260 nm和 280 nm处吸光光密度(optical density,OD)值;OD260/OD280在1.8~2.1,提取的RNA的纯度很高,符合实验要求。依据cDNA第一链合成试剂盒说明书进行逆转录合成cDNA。LGR5上游引物:5’-CATCAGCTATGTGCCCCCAA- 3’,下游引物:5’-AAAGCCTGGACGGGGATTTC- 3’,片段长度99 bp;LGR6上游引物:5’-ACCCCCTGACGGCTTACCT- 3’,下游引物:5’-GCTTGTCCTGGGATGTGTGAG- 3’,片段长度133 bp;GAPDH上游引物:5’-CAAATTCCATGGCACCGTCA- 3’,下游引物:5’-AGCATCGCCCCACTTGATTT- 3’,片段长度109 bp。扩增:往0.1 ml PCR管中依次加入如下组份:2×荧光探针10 μl、模板(cDNA稀释10倍)1 μl、引物混合(上游/下游各为10 μmol/L)2 μl、0.1% 超纯水7 μl。反应条件:95 ℃预变性5 min;95 ℃变性15 s,60 ℃退火20 s,72 ℃延伸40 s,共40个循环;95 ℃变性15 s,骤冷至60 ℃,制作溶解曲线。
蛋白质印迹蛋白质印迹法检测骨髓单个核细胞中LGR5、LGR6蛋白表达水平。蛋白提取:PBS洗涤细胞2次;加入胰蛋白酶消化液,37 ℃消化后移至离心管中离心,再加入PBS离心洗涤2次;根据细胞数量加入裂解缓冲液(每1 ml冷裂解缓冲液加入10 μl磷酸酶抑制剂、1 μl蛋白酶抑制剂和5 μl 100 mol/L 苯甲基磺酰氟),置于4 ℃摇床平台上,振荡15 min,离心15 min,取上清,分装保存于-70 ℃。蛋白定量:稀释待测样品总体积为20 μl,加入聚氰基丙烯酸正丁酯工作液200 μl,混匀后37 ℃放置30 min,在562 nm波长下比色,记录吸光值,通过标准曲线和样品的体积计算样品的蛋白浓度。聚丙烯酰胺凝胶电泳与转膜:吸取样品加入样品孔中,样品旁孔加入蛋白Marker;选择合适的电压水平,待目的条带进入凝胶最佳分离区(大约凝胶的2/3)时,停止电泳;切下目的条带转膜;转膜结束后,取出硝酸纤维素膜做好标记,用等渗缓冲盐溶液洗膜 5 min×3次。免疫印迹:将硝酸纤维素膜放入平皿中封闭;封闭结束后,用等渗缓冲盐溶液洗膜5 min×3次;将膜放入含一抗的平皿中,4 ℃摇床振荡孵育过夜;第2天取出,室温振荡30 min,吸弃一抗,TBST洗膜10 min×3次;加入稀释的二抗,室温摇床振荡反应2 h;结束后,回收二抗,TBST洗膜5 min×3次。取出硝酸纤维素膜,滴加工作液(EcL化学发光试剂盒中的A、B两种液体按1∶1等体积混合),用保鲜膜覆盖。使用G:BOX chemiXR5成像,使用Gel-Pro32软件对结果进行灰度分析。
统计学处理采用SPSS 24.0 统计软件对数据进行统计学分析。计量资料采用Kolmogorov-Smirnov检验判断正态性,正态分布的计量资料以均数±标准差表示,初发组、缓解组与对照组比较采用独立样本t检验,初发组与缓解组比较采用配对t检验。多组间均数比较采用单因素方差分析,多组间两两比较方差齐时采用LSD法并作Bonferroni校正,方差不齐时采用Dunnett’ T3法[5]。P<0.05为差异有统计学意义。
结 果
LGR5和LGR6的mRNA表达初发组LGR5 mRNA的相对表达低于缓解组(t=-12.921,P=0.000)和对照组(t=-7.954,P=0.000),差异有统计学意义;缓解组和对照组之间LGR5 mRNA的相对表达差异无统计学意义(t=-1.396,P=0.167)(表1)。初发组低危、中危、高危组LGR5 mRNA的相对表达不同,差异有统计学意义(F=5.057,P=0.012),其中低危患儿LGR5 mRNA的相对表达高于中危(P=0.038)和高危(P=0.030)患儿,差异有统计学意义;中危和高危患儿LGR5 mRNA的相对表达差异无统计学意义(P=1.000);缓解组低危、中危、高危组LGR5 mRNA的相对表达不同,差异有统计学意义(F=5.034,P=0.012),其中低危患儿LGR5 mRNA的相对表达高于中危(P=0.039)和高危(P=0.030)患儿,差异有统计学意义;中危和高危患儿LGR5 mRNA的相对表达差异无统计学意义(P=1.000)(表2)。
初发组LGR6 mRNA的相对表达高于缓解组(t=12.532,P=0.000)和对照组(t=7.658,P=0.000),差异有统计学意义;缓解组和对照组之间的LGR6 mRNA的相对表达差异无统计学意义(t=-0.450,P=0.654)(表1)。初发组低危、中危、高危组LGR6 mRNA的相对表达不同,差异有统计学意义(F=4.688,P=0.016),其中低危患儿LGR6 mRNA的相对表达低于中危(P=0.045)和高危(P=0.042)患儿,差异有统计学意义,中危和高危患儿LGR6 mRNA的相对表达差异无统计学意义(P=1.000);缓解组低危、中危、高危组LGR6 mRNA的相对表达不同,差异有统计学意义(F=5.628,P=0.007),其中低危患儿LGR6 mRNA的相对表达低于中危(P=0.026)和高危(P=0.021)患儿,差异有统计学意义,中危和高危患儿LGR6 mRNA的相对表达差异无统计学意义(P=1.000)(表2)。
LGR5和LGR6的蛋白表达初发组LGR5 蛋白的相对表达低于缓解组(t=-6.864,P=0.000)和对照组(t=-6.404,P=0.000),差异有统计学意义;缓解组和对照组LGR5蛋白的相对表达差异无统计学意义(t=-0.884,P=0.380)(表1、图1)。初发组低危、中危、高危组LGR5蛋白的相对表达不同,差异有统计学意义(F=4.632,P=0.016),其中低危患儿LGR5蛋白的相对表达高于中危(P=0.045)和高危(P=0.045)患儿,差异有统计学意义;中危和高危患儿之间LGR5蛋白的相对表达水平差异无统计学意义(P=1.000);缓解组低危、中危、高危组LGR5蛋白的相对表达不同,差异有统计学意义(F=45.969,P=0.006),其中低危患儿LGR5 蛋白的相对表达高于中危(P=0.034)和高危(P=0.011)患儿,差异有统计学意义;中危和高危患儿之间LGR5蛋白的相对表达水平差异无统计学意义(P=1.000)(表3、图1)。
初发组LGR6蛋白的相对表达高于缓解组(t=23.508,P=0.000)和对照组(t=13.075,P=0.000),差异有统计学意义;缓解组和对照组LGR6蛋白的相对表达差异无统计学意义(t=1.845,P=0.069)(表1)。初发组低危、中危、高危组LGR6蛋白的相对表达不同,差异有统计学意义(F=6.368,P=0.004),其中低危患儿LGR6蛋白的相对表达低于中危(P=0.020)和高危(P=0.011)患儿,差异有统计学意义;中危和高危患儿LGR6蛋白的相对表达水平差异无统计学意义(P=1.000);缓解组低危、中危、高危组LGR6蛋白的相对表达不同,差异有统计学意义(F=5.750,P=0.007),其中低危患儿LGR6蛋白的相对表达低于中危(P=0.023)和高危(P=0.020)患儿,差异有统计学意义;中危和高危患儿LGR6蛋白的相对表达水平差异无统计学意义(P=1.000)(表3、图2)。

表1 各组LGR5和LGR6 mRNA和蛋白的相对表达

表2 各危险度分组中LGR5和LGR6 mRNA的相对表达

表3 各危险度分组中LGR5和LGR6蛋白的相对表达

Mr:相对分子质量;1:缓解组;2:中危初发组;3:低危初发组;4:高危初发组;5:对照组
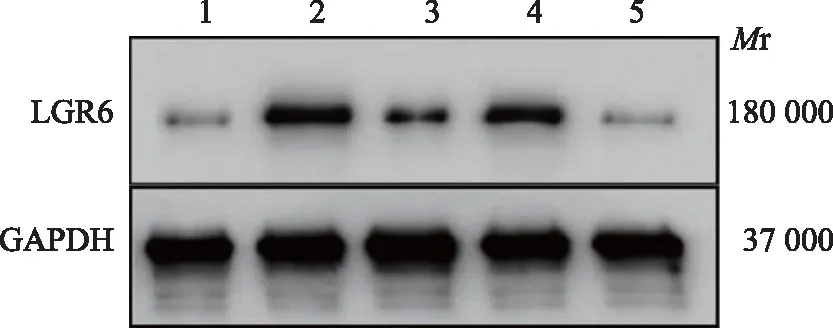
1:缓解组;2:中危初发组;3:低危初发组;4:高危初发组;5:对照组
讨 论
Wnt信号通路在进化过程中高度保守,在调节细胞增殖、迁移、凋亡和分化及调控正常组织重建等生命活动中发挥重要的作用,Wnt信号通路有多条途径,其中研究最为广泛的是经典Wnt信号通路,亦称为Wnt/β-连环蛋白通路[6]。当细胞外存在Wnt信号时,Wnt配体蛋白与受体结合,并募集散乱蛋白与细胞膜上的卷曲蛋白受体(frizzled,Fz)结合,使糖原合成激酶- 3β-支架蛋白-大肠腺瘤息肉蛋白-酪蛋白激酶1降解复合体无法降解胞质内的β-连环蛋白,使β-连环蛋白在胞内累积并进入细胞核,与核内T细胞因子/淋巴样增强因子结合,从而调控下游靶基因的转录。有研究显示,在ALL患儿中β-连环蛋白表达水平明显高于非恶性血液病患儿[7],因此,Wnt/β-连环蛋白信号通路的异常激活与儿童ALL的发病关系密切。
LGR是一种7次跨膜受体,分为A、B、C 3个亚型,其中参与Wnt/β-连环蛋白信号通路的B型受体家族只有3种密切相关的受体即LGR4、LGR5、LGR6[8],B型受体在多种肿瘤的发病中具有重要作用,尤其是LGR5和LGR6被认为是癌症干细胞的标志物。LGR5和LGR6是特异性顶部盘状底板反应蛋白(R-spondins,RSPOs)的特异性配体,RSPOs通过LGR与锌环指3(zinc and ring finger 3,ZNRF3)和环指蛋白43(ring finger protein 43,RNF43)结合,抑制ZNRF3/RNF43的泛素连接酶活性,使FZ受体在质膜上积聚,从而促进Wnt/β-连环蛋白信号通路的激活[9- 10]。有研究显示Fz4在ALL患儿中表达增高,可能通过激活Wnt/β-连环蛋白信号通路,参与儿童ALL的发病[5]。因此,LGR5、LGR6作为具有特定配体的Wnt/β-连环蛋白信号通路中的相关受体,可能成为独特的治疗靶标。
虽然LGR5与LGR6在序列上有50%的同源性[11],但是LGR5和LGR6在不同肿瘤中发挥不同作用。有研究表明LGR5的高表达对胶质瘤细胞的克隆和致瘤能力非常重要[12]。另外,在脑胶质瘤细胞中,LGR5可以通过抑制β-连环蛋白的磷酸化激活Wnt/β-连环蛋白通路,使LGR5阳性的细胞具有更高的侵袭性和转移性[13]。因此,在脑胶质瘤中LGR5发挥促癌作用。但是,Cosgun等[14- 16]通过小鼠实验发现,当LGR5在B-ALL细胞中缺失时,核内β-连环蛋白大量积累并且其下游靶基因的表达也增加,表明在B细胞环境中LGR5是Wnt/β-连环蛋白信号通路的重要负调控因子。但LGR5发挥负向调控作用的机制暂不清楚,可能通过减少Wnt/FZ复合物对脂蛋白受体5/6的进入引起,但也可能是RSPOs通过LGR5与ZNRF3/RNF43结合触发更多的间接作用,其具体机制有待进一步研究。本研究显示,初发组LGR5 mRNA和蛋白的相对表达均低于缓解组和对照组;在儿童ALL中,低危患儿LGR5 mRNA和蛋白的相对表达均高于中危和高危患儿。因此,本研究认为在儿童ALL中,LGR5在Wnt/β-连环蛋白信号通路中发挥负向调控作用,LGR5的低表达使Wnt/β-连环蛋白信号通路异常激活,从而参与儿童ALL的发病,并且其表达变化与儿童ALL的危险度分层和治疗效果关系密切。
有研究指出,LGR6在卵巢癌及食管癌中表达水平增高,认为LGR6高表达导致Wnt/β-连环蛋白信号通路异常激活,促进肿瘤的发生发展进程[17- 18]。本研究显示,初发组LGR6 mRNA和蛋白的相对表达均高于缓解组和对照组,在儿童ALL中,低危患儿LGR5 mRNA和蛋白的相对表达均高于中危和高危患儿。并且,另有研究显示,FZ4在初发组表达均明显高于缓解组和对照组,在低危患儿中表达均低于中危和高危患儿[11]。因此,在儿童ALL中LGR6通过与RSPOs和ZNRF3/RNF43结合,使FZ受体在膜上积聚,从而在Wnt/β-连环蛋白信号通路中发挥正向调控作用,参与儿童ALL的发病。但也有研究认为LGR6为肿瘤抑制因子[19- 20]。LGR5和LGR6在肿瘤中发挥正向调控作用,是因为其与RSPOs配体和ZNRF3/RNF43结合,使FZ在胞膜上累积,导致Wnt/β-连环蛋白信号通路异常激活。但其在肿瘤中发挥抑癌作用的机制暂不明确。总之,LGR5和LGR6在肿瘤发生过程中的作用可能是其生物学功能整合的结果,可能与细胞环境、RSPOs家族成员的表达方式及相互作用有关,其在不同类型的肿瘤进展过程中可能发挥复杂甚至相反的作用。
综上,本研究表明在儿童ALL中,LGR5在Wnt/β-连环蛋白信号通路中发挥负向调控作用,LGR6在Wnt/β-连环蛋白信号通路中发挥正向调控作用,LGR5低表达和LGR6高表达,使Wnt/β-连环蛋白信号通路异常激活,参与儿童ALL的发病。LGR5和LGR6表达水平的变化可能与儿童ALL危险度分层和治疗效果关系密切。并且已有研究通过小鼠实验发现,LGR5-单甲基阿司他丁单药治疗可显著降低B-ALL的负担,地塞米松处理不仅增强LGR5在细胞表面的持续表达,而且增强LGR5-单甲基阿司他丁的疗效,并且认为LGR5是根除白血病起始细胞的一个很有前途的靶点[15- 16]。因此,检测LGR5和LGR6表达水平的变化对判断儿童ALL的发病、危险分层及治疗效果有一定意义,LGR5和LGR6有望成为治疗儿童ALL的靶点,可能为儿童ALL的治疗提供新的方法。

