空气污染物对兰州市特应性皮炎门诊人次的影响
何 苑,石春蕊,光 奇,骆志成,郗 群,韩 磊
1兰州大学第一临床医学院皮肤病与性病学,兰州 730000 兰州大学第一医院 2皮肤科 3信息中心,兰州 730000 兰州大学第二医院 4皮肤科 5信息中心,兰州 730000
近年来,随着我国社会经济的快速发展,空气污染问题日益严重,空气污染对人群健康的影响得到社会大众越来越多的关注。既往研究表明,空气污染可能对呼吸疾病、心血管疾病、变态反应性疾病(如哮喘、特应性皮炎)有一定的影响[1- 3]。在人体中,与外界环境接触最频繁、接触面积最大的是皮肤,作为防御屏障,时刻接触空气污染物,感受外界环境的变化。特应性皮炎是一种慢性复发炎症性皮肤病,患者常合并过敏性鼻炎和哮喘,有剧烈瘙痒,严重影响生活质量。过去几十年全球范围内特应性皮炎的患病率逐渐增加[4-5]。特应性皮炎的发病与遗传、环境等因素相关,发病率的逐年上升不能仅由遗传背景来解释,环境暴露可能参与特应性皮炎的发病。目前国内外关于利用空气污染物和特应性皮炎门诊人次进行定量分析的研究较少,仅局限于部分国家和地区,如韩国[6],中国台湾[7]、四川[8]、北京[9- 10]和上海[11],且不同国家和地区,由于污染物来源、成分以及当地的气象条件、人口学特征等存在差异,不同国家和地区所得结论并不能完全外推至其他国家和地区。中国兰州深居西北内陆,特有盆地地形、特殊的气象条件等因素,容易造成兰州空气污染物不易扩散,它是研究空气污染物对皮肤疾病影响的理想区域。目前,研究人员对兰州市空气污染物与特应性皮炎门诊人次的关系的相关研究较少。本研究拟采用基于泊松(Poisson)分布的广义相加模型(generalized additive model,GAM)定量评估兰州市大气中的主要污染物PM2.5、PM10、NO2、SO2日均浓度变化对特应性皮炎门诊人次的影响,为采取针对性应对措施和保护居民健康提供科学依据。
资料和方法
资料来源特应性皮炎门诊就诊资料来源于2013年1月1日至2017年12月31日兰州市3所三级甲等综合医院(兰州大学第一医院、兰州大学第二医院、甘肃省人民医院),资料为在兰州办理户籍登记手续的居民特应性皮炎门诊就诊信息,包括患者的性别、出生日期、年龄、就诊日期、疾病诊断和家庭住址等。参照国际疾病分类法第10版,特应性皮炎诊断编码为L20。根据患者性别和年龄分为不同亚组。空气污染物资料来源于全国城市空气质量实时发布平台(http://106.37.208.233:20035/)公布的空气质量日报数据,选取兰州市逐日监测数据,包括 PM2.5、PM10、SO2、NO2日平均浓度。气象监测资料来源于甘肃省气象局,包括每日的平均气温(℃)及平均相对湿度(%)。
统计学处理
描述性统计分析:采用Excel和SPSS 22.0统计软件对特应性皮炎门诊人次、空气污染物(PM2.5、PM10、SO2、NO2)、平均气温、平均相对湿度等指标进行描述性分析,分别以均数±标准差、最小值、最大值和分位数(P25、P50、P75)表示。采用Spearman秩相关分析空气污染物与气象因素之间的相关性。
统计模型建立:对于总人群来说,每日特应性皮炎门诊人次属于小概率事件,其近似服从Poisson分布,因此本研究采用Poisson分布作为回归模型,采用GAM分析空气污染物对门诊人次的影响。以特应性皮炎门诊人次为因变量,运用自然平滑样条函数控制时间长期趋势、季节趋势和气象因素的影响。基本模型的公式如下:
Log[E(Yt)]=a+βZt+s(time,df)+s(humt,df)+s(temperaturet,df)+DOW+Holiday
(1)
式中Yt为观察日t当天的门诊人次;E(Yt)为第t日的预期特应性皮炎门诊人次;α为截距;Zt为第t日的空气污染物;β为回归模型中的解释变量系数;s为非参数平滑样条函数;time为对应的日期;humt和temperaturet为第t日的平均气温和平均相对湿度;DOW和Holiday是对应星期变量和假期变量,处理星期几效应和节假日效应问题。df为自由度,该值通过赤池信息准则值最小的原则选取,本研究时间自由度确定为7,5年的自由度合计应为7×5,平均气温和平均相对湿度自由度为3。有研究显示,由于考察的是空气污染物对特应性皮炎门诊人次的短期健康效应,用当日(lag0)至滞后7 d(lag1~lag7)、累积当日和前1 d(lag01,即累积1 d)至当日和前7 d(lag07,即累积7 d)进行分析[8]。本研究采用空气污染物浓度每升高10 μg/m3时门诊人次变化的百分比,定量评价空气污染物效应,采用超额危险度(excess risk,ER)及其95%的置信区间(95% confidence interval,95%CI)衡量空气污染物与门诊人次的联系强度。公式如下:
ER=[EXP(β×10)-1]×100%
(2)
首先进行单污染物模型分析,分析空气污染物对特应性皮炎门诊人次影响的总体效应和滞后效应,并对门诊人次进行性别、年龄(≤2岁、3~12岁、13~59岁、≥60岁)和季节(冷季1~4月和11~12月,暖季5~10月)分层。其次,根据单污染物模型中确定空气污染物影响最大滞后时间,分析空气污染物的交互作用,并拟合双污染物模型,将某两种污染物同时纳入模型分析。研究采用 R 3.4.4 软件进行分析。检验水准为0.05。
模型敏感性分析:通过改变时间变量自由度(df=6- 10)评价模型结果的稳定性。
结 果
特应性皮炎门诊人次和气象因素及空气污染的分布情况兰州市医院特应性皮炎门诊人次为35 057例,平均每日就诊1.00~77.00(10.00±4.60)例。其中男性与女性持平,0~2岁人群、≥60岁人群特应性皮炎门诊人次高于其他年龄人群,暖季门诊人次高于冷季。其中平均气温、平均相对湿度、PM2.5的日均浓度、PM10的日均浓度、NO2的日均浓度和SO2均低于国家《环境空气质量标准》(GB3095- 2012)PM2.5的二级标准(75 μg/m3)、PM10的二级标准(150 μg/m3)、NO2的二级标准(80 μg/m3)、SO2的二级标准(80 μg/m3)(表1)。
空气污染物和气象因素之间的相关性PM2.5、PM10、NO2、SO2两两之间呈正相关,其中PM2.5与PM10之间高度相关,相关系数为0.90(P=0.004)。PM2.5、PM10、NO2、SO2与相对湿度呈正相关,与温度呈负相关(P=0.005)(表2)。
单污染物模型分析使用GAM模型控制长期和季节趋势、气温和相对湿度等气象因素的影响,PM2.5和PM10与特应性皮炎门诊人次的关联在滞后当日(lag0)最为显著,PM2.5和PM10每升高10 μg/m3增加的ER值分别为0.56%(95%CI=-0.03%~1.61%)和0.20%(95%CI=-0.15%~0.39%),差异无统计学意义;而NO2对特应性皮炎门诊人次的影响则在滞后当日(lag0)、滞后第1天(lag1)以及累积滞后1和2 d(lag01、lag02)时有统计学意义(P=0.01),且lag0最为显著,NO2浓度每升高10 μg/m3引起特应性皮炎门诊人次增加的ER值为1.95%(95%CI=1.09%~2.82%);SO2则在滞后第3天(lag3)、滞后第4天(lag4)、滞后第5天(lag5)、滞后第6天(lag6)、滞后第7天(lag7)时有统计学意义(P=0.01),其中在lag6增加效应最显著,SO2每增加10 μg/m3引起特应性皮炎门诊人次增加的ER值为1.52%(95%CI=0.48%~2.54%,t=5.06,P=0.02)(表3)。

表1 2013至2017年兰州市特应性皮炎门诊人次、空气污染物及气象因素
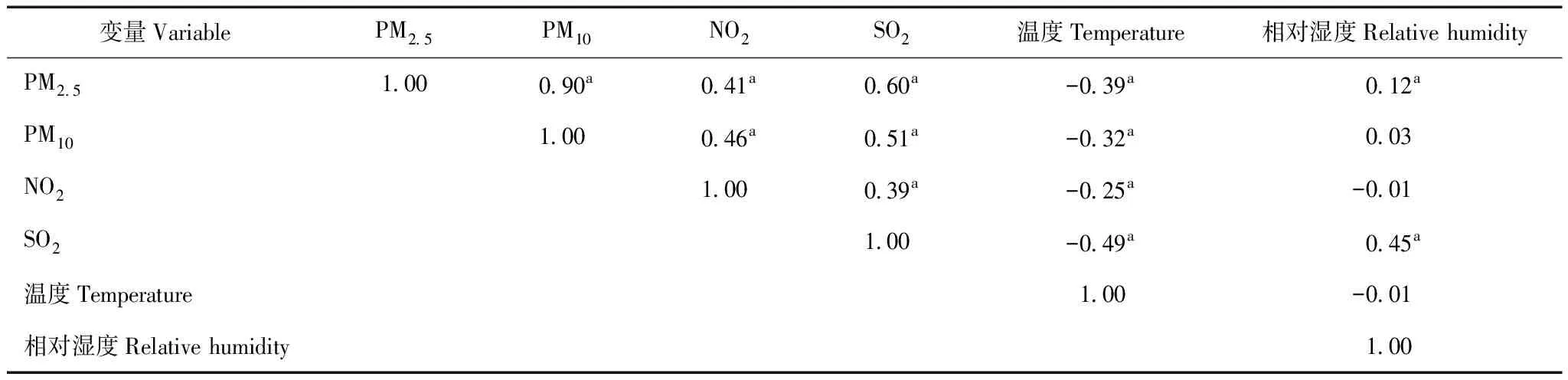
表2 空气污染物与气象因素的Spearman相关分析
根据单污染模型的滞后分析结果选择影响最大的滞后时间(PM2.5、PM10、NO2为 lag0,SO2为lag6)进行分层研究,探讨各污染物对不同性别、年龄和季节内特应性皮炎门诊人次风险的潜在影响,结果显示按性别分层分析,PM2.5、NO2对男性特应性皮炎门诊人次的影响大于女性,NO2每升高10 μg/m3时,男性和女性人群分别增加1.78%(95%CI=0.82%~2.75%)和1.54%(95%CI=0.52%~2.58%),具有统计学意义(t=5.16,P=0.02)。PM10、SO2对女性特应性皮炎门诊人次的影响大于男性,SO2每升高10 μg/m3时,男性和女性人群分别增加-0.57%(95%CI=-2.01%~0.89%)和2.47%(95%CI=0.73%~4.18%),具有统计学意义(t=4.99,P=0.02)。按年龄分层分析,NO2和SO2日均浓度的增加使0~2岁特应性皮炎门诊人次增加,NO2和SO2每增加10 μg/m3,将使该年龄层人群分别增加2.35%(95%CI=1.20%~3.52%)和1.57%(95%CI=0.13%~3.25%),有统计学意义(t=5.02,P=0.02)。在13~59岁年龄组,仅NO2对特应性皮炎门诊人次的影响有统计学意义,为1.39%(95%CI=0.25%~2.54%,t=5.11,P=0.02)。4种空气污染物的浓度变化对3~12岁年龄组和≥60岁年龄组人群特应性皮炎门诊人次的影响无统计学意义。按季节分层显示,仅NO2在冷季对特应性皮炎门诊人次的影响高于暖季,即在冷季时NO2每增加10 μg/m3将使特应性皮炎门诊人次增加2.35(95%CI=1.20%~3.51%),具有统计学意义(t=5.16,P=0.02)。PM2.5、PM10、SO2在暖季对特应性皮炎门诊人次的影响有高于冷季的趋势,但差异无统计学意义(表3)。
双污染物模型分析根据单污染模型分析选择影响最大的滞后时间(PM2.5、PM10、NO2为lag0,SO2为lag6)进行双污染物模型拟合(表3)。分别引入PM2.5、PM10、SO2后,NO2与全人群、男性、女性、0~2岁人群、13~59岁人群、冷季、暖季特应性皮炎门诊人次的ER值增高且有统计学意义(t=5.12,P=0.02);当只引入PM2.5、PM10后,NO2对3~12岁人群、≥60岁人群的关联减弱但无统计学意义。分别引入PM2.5、PM10、NO2后,SO2仅对女性人群关联的ER值增高且有统计学意义(t=5.11,P=0.02),其余人群的关联均无统计学意义;当只引入NO2后,SO2对全人群关联的ER值增高,具有统计学意义(t=5.02,P=0.02);引入PM10后,SO2对0~2岁人群的关联强度增强,具有统计学意义(t=5.09,P=0.02)。当引入NO2、SO2后,PM2.5及PM10与特应性皮炎门诊人次无关联性(表3)。
交互作用PM2.5和NO2,PM10和NO2,SO2和NO2在lag0浓度对特应性皮炎总人群门诊就诊风险的联合效应显示,PM2.5和NO2,PM10和NO2,SO2和NO2在lag0浓度同时上升时,特应性皮炎总人群门诊就诊人次的风险呈上升趋势,提示NO2与PM2.5、PM10和SO2的交互作用明显,两两的联合可能会产生更大的危险效应(图1)。
敏感性分析根据单污染模型分析选择影响最大的滞后时间(PM2.5、PM10、NO2为lag0,SO2为lag6),通过改变不同时间自由度进行敏感分析,显示模型结果拟合较好,表明空气污染物和特应性皮炎门诊人次之间的关联是稳健的(表4)。
讨 论
本研究通过采用GAM分析空气污染物对特应性皮炎门诊人次的影响,结果显示兰州地区PM2.5、PM10、NO2、SO2能使特应性皮炎的危险性增加。
本研究PM2.5、PM10在当日滞后(lag0)对特应性皮炎的影响最大,滞后效应不明显。PM2.5、PM10浓度每增加10 μg/m3,对应的特应性皮炎门诊人次分别增加0.56%和0.20%,差异无统计学意义。这与北京的吕宏梅等[9]、李永荷等[10]和成都的谢丽等[8]研究结果一致,但上述研究均提示颗粒物与特应性皮炎门诊人次存在关联。可能由于地区间污染物的来源、成分、浓度及当地人口学特征(如年龄、性别、教育水平等)的差异引起。本研究显示PM2.5对特应性皮炎门诊人次的效应值比PM10的影响更明显,这与Tang等[12]和Wang等[13]研究结果相似。主要是因为PM2.5体积较小,重金属含量丰富[14],尤其是镉、铜、铅、镍、钒和锌的含量较高,很容易深入皮肤细胞,进而导致特应性皮炎患病率增加[15]。本研究PM2.5与特应性皮炎无关联,可能原因是本研究采用GAM模型,只讨论短期内(滞后7 d内)PM2.5对特应性皮炎门诊就诊人次的影响;另外,大部分特应性皮炎的患者往往合并过敏性鼻炎或哮喘等其他疾病,而动物皮毛及花粉是造成疾病发作的主要原因,所以需要作为混杂因素排除。
兰州市NO2在lag0时效应值最明显并存在滞后效应。NO2浓度每升高10 μg/m3引起特应性皮炎门诊人次增加的ER值为1.95%(95%CI=1.09%~2.82%),这与北京的研究结果一致[9- 10]。而中国上海[11]、韩国[6]、中国成都[8]的研究显示NO2无明显滞后效应。差异可能是不同地区污染源类型差异、人群的年龄构成和对污染的敏感程度不同造成。

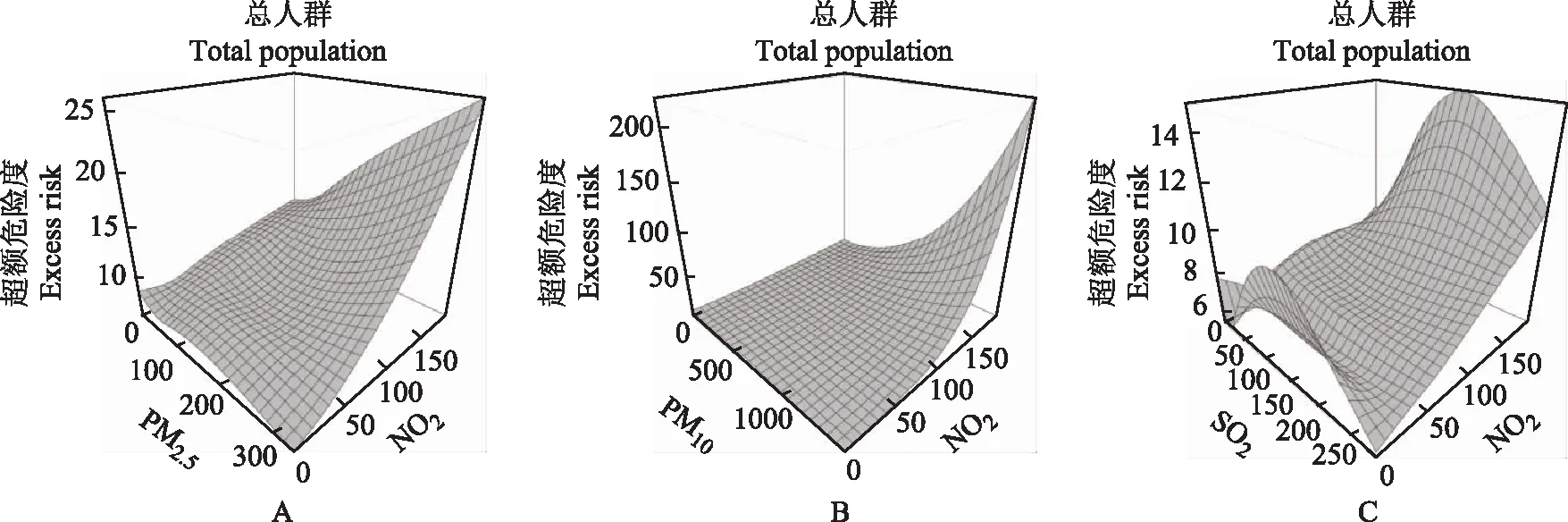
图1 PM2.5和NO2(A),PM10和NO2(B),SO2和NO2(C)在滞后当日(lag0)平均浓度对特应性皮炎门诊人次就诊风险的交互效应图
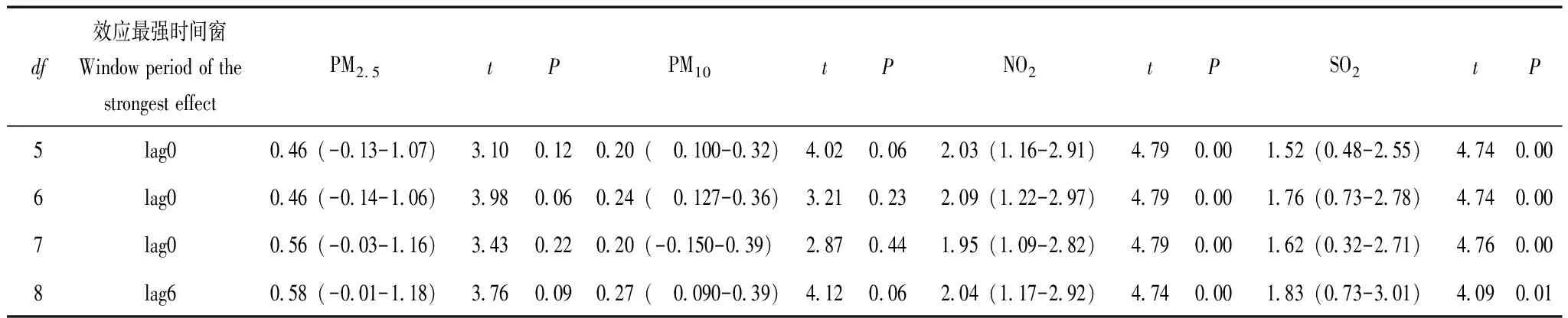
表4 在单污染物模型中,不同时间自由度下空气污染物每升高10 μg/m3对模型稳定性的影响Table 4 Effects of every 10 μg/m3 rise in air pollutant concentration on the stability of the single pollutant models with different degrees of freedom for calendar time
SO2滞后第6天(lag6)对特应性皮炎门诊人次的影响最大,此时SO2每增加10 μg/m3引起特应性皮炎门诊人次增加的ER值为1.52%(95%CI=0.48%~2.59%),差异具有统计学意义。而吕宏梅等[9]研究显示SO2每升高10 μg/m3,在滞后第1天(lag1)时对特应性皮炎门诊人次增加0.4%。李永荷等[10]和谢丽等[8]的研究显示在滞后当日(lag0)时,SO2每升高10 μg/m3对应特应性皮炎门诊人次分别增加1.00%和1.04%。中国上海的研究亦显示SO2在滞后0~6 d时对特应性皮炎门诊人次影响显著,SO2每升高10 μg/m3,对应增加的特应性皮炎门诊人次百分比为2.22%[11]。可能原因是研究过程中调整的混杂因素不同有关;或者由于不同地区SO2的来源及分布特点不同造成。
本研究显示大气污染物(NO2、SO2)对特应性皮炎门诊人次的影响相比颗粒物(PM2.5、PM10)对门诊人次的影响显著。单污染物模型结果显示,大气中这4种污染物(PM2.5、PM10、NO2、SO2)每升高10 μg/m3,皮炎门诊人次增加的ER值分别为0.56%、0.20%、1.95%、0.79%。同时还计算了当空气污染物升高一个四分位间距(即PM2.5每升高29.4 μg/m3,PM10每升高76 μg/m3,NO2每升高28 μg/m3,SO2每升高34.9 μg/m3),特应性皮炎总人群门诊人次分别增加1.67%、0.16%、5.56%、3.98%;且在双污染物模型中发现当引入PM2.5、PM10后,NO2和SO2对特应性皮炎门诊人次影响增强,而引入NO2和SO2时,PM2.5和PM10对特应性皮炎门诊人次影响减弱;颗粒物与NO2交互作用明显。以上结果均可提示气态污染物对特应性皮炎门诊效应强于颗粒物,特别是NO2。这与中国北京[9-10]、中国成都[8]、韩国[6]、中国上海[11]等的文献报道结果类似,均认为气态污染物浓度会增加皮疹的发生风险。可能因为NO2、SO2具有亲水性,极易穿透皮肤屏障,改变皮肤表面pH,影响皮肤表面微生态[16- 18];同时,Bernadette等[19]通过研究显示将特应性皮炎患者短期暴露于NO2含量在23~30 mg/m3环境下,其表皮屏障功能破坏更明显,具体表现为皮肤粗糙度明显增加;又有研究显示NO2与交通污染有关的毒性刺激物水平有关,如挥发性有机污染物(volatile organic compounds,VOCs)和苯,VOCs是导致特应性皮炎发生和加重的危险因素之一[20]。但NO2及SO2在滞后第2天(lag2)时,每升高10 ug/m3,对应的ER值及95%CI分别为-0.22%(95%CI=-1.09%~2.75%)和-0.34%(95%CI=1.40%~0.71%),呈保护效应。有研究表明当人体呼吸系统短期暴露于NO2浓度为0.2~1 ppm(4.48×104~2.24×105ug/m3)时,受试者未显示出肺部炎症、肺功能变化和气道的高反应性[21],表明机体短期暴露在高浓度的污染物可能不会造成损害。这可能提示NO2、SO2对人体的影响可能与其浓度相关,推测当NO2、SO2浓度高于一定值时可能对机体产生损害效应,当浓度低于一定值时则起保护效应,但因相关文献较少,仍需更多研究证明解释。
性别分层显示PM2.5和NO2对男性特应性皮炎门诊人次的影响略高于女性,PM10和SO2的影响女性高于男性。这与李永荷等[10]和Tang等[12]研究结果显示PM2.5和NO2对女性的影响大于男性不一致。这种空气污染物存在的性别间差异可能由于与不同性别的生活习惯、皮肤屏障功能不同等有关。女性相对男性,化妆品使用的频率、内分泌和激素环境的复杂,影响皮肤正常的新陈代谢,加速皮肤屏障破坏,皮肤敏感性增强,易受到外界环境刺激和影响。
年龄分层显示≤2岁人群对气态污染物(NO2、SO2)浓度的升高较为敏感,NO2和SO2浓度每升高10 μg/m3,门诊人次分别增加2.35%和1.57%,差异有统计学意义。这与一项涉及中国7个城市的研究结果一致,其发现户外NO2会增加学龄前儿童(3~6岁)患特应性皮炎的风险[22]。有研究表明469名孕妇在生产前以及生产后第一年因暴露在空气污染物的环境下,特应性皮炎的患病率会增加1倍[23]。主要原因在于胎儿的皮肤防御功能以及机体免疫功能尚未完全成熟,受到大气有毒污染物的侵袭风险更大[23]。本研究显示13~59岁人群对NO2浓度的升高最为敏感,NO2浓度每升高10 μg/m3,门诊人次增加1.39%,差异有统计学意义。13~59岁为青壮年主力人群,作息时间不规律、生活精神压力大、吸烟饮酒等不良生活习惯和户外暴露时间长等因素可能会增加本研究疾病的发病。
冷暖季节分层显示NO2对特应性皮炎门诊人次在冷暖季影响均明显,NO2浓度每增加10 μg/m3,对特应性皮炎日门诊量分别增加2.35%(95%CI=0.71%~4.04%)和1.89%(95%CI=0.64%~3.35%),具有统计学意义。颗粒物(PM2.5、PM10)及SO2在暖季时期对特应性皮炎门诊人次的影响均高于冷季。这与在一项特应性皮炎儿童早期患者的长期研究结果相似,文献中提到暖季(夏秋季)NO2及挥发性有机化合物含量高使特应性皮炎恶化,特应性皮炎指数评分增加[24]。这可能也与冬季寒冷居民外出机会减少、开窗换气的频率和时间缩短有关。
现在空气污染物对特应性皮炎的生物学机制尚不十分清楚。可能的机制如下:暴露于环境空气污染物产生的氧化剂超载使活性氧物种(reactive oxygen species,ROS)和活性亚硝基物质的积累导致抗氧化机制(如谷胱甘肽、超氧化物歧化酶)的激活、脂质和蛋白质的过氧化、血浆和核膜完整性受损和DNA的甲基化,即氧化应激假说。这种氧化应激在不同程度上与特应性皮炎的加重有关。在对75例成人特应性皮炎患者的研究中,采用二硝基苯肼分光光度法测定皮肤组织中氧化蛋白损伤标记物羰基部分的含量,注意到二硝基苯肼在病变部位角质层的上层明显,并且与疾病严重程度相关[25]。中国台湾的一项对34例患有特应性皮炎儿童和106名正常健康儿童行病例对照研究显示,谷胱甘肽S-转移酶中,GSTM1零基因型显著增加了儿童患特应性皮炎的风险[26]。但空气中的颗粒物可以携带如多环芳烃(polycyclic aromatic hydrocarbons,PAHs)等有机化合物,这些物质亲脂性极强,易于渗透皮肤内。而在人体皮肤的角质形成细胞和黑素细胞中表达一种配体依赖性转录因子,即芳香烃受体(aryl hydrocarbon receptor,AhR)。当PAHs与表皮细胞AhR结合并将其激活后,会对炎症性皮肤病变、过敏性皮炎等皮肤损害的发生发展起到促进作用[27]。韩国的一项研究提示,AhR在特应性皮炎患者皮损处的表达高于健康对照,同时研究显示健康人表皮角质形成细胞的AhR被激活后,可以使炎症细胞因子白介素(interleukin,IL)- 6和IL- 8的产生增加[28]。日本研究者也明确了由氧化应激反应介导的健康人表皮角质形成细胞产生的IL- 8通过芳香烃受体的信号传导通路,当PAHs激活AhR后产生的ROS对IL- 8的产生起重要作用[29]的研究证实丝聚蛋白上调,AhR过表达会诱导表皮分化,使皮肤角质层厚度增加。而具体的机制仍有待进一步研究。
综上,本研究显示兰州市空气污染物(PM2.5、PM10、NO2)使特应性皮炎发生的危险性增加,以滞后当日(lag0)浓度效果最显著,滞后效应以NO2明显;就性别、年龄而言,PM10、NO2、SO2对女性的影响较男性显著,而男性对NO2的影响较敏感;≤2岁人群对气态污染物(NO2、SO2)浓度的升高较为敏感,13~59岁人群对NO2浓度的升高最为敏感;NO2对特应性皮炎门诊人次的影响存在季节性差异,对特应性皮炎门诊人次影响更明显。

