新辅助治疗胃癌病理完全缓解的影响因素及预后分析
王童博,周 红,张晓杰,孙崇源,郭春光,陈应泰,周爱萍,金 晶,赵东兵
国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院 北京协和医学院 肿瘤医院 1胰胃外科 2肿瘤内科 3放疗科,北京 100021
胃癌是我国发病率和死亡率均居第2位的恶性肿瘤。据估算我国2015年新发胃癌病例超过67万,占全球新发胃癌病例的41%[1]。虽然近年来我国通过对胃癌的早期筛查、早期诊断及治疗,胃癌患者整体的5年生存率从2003年的27.4%升高到2011年的31.8%[2],但我国胃癌仍呈早期比率低、进展期比率高的特点,超过70%的胃癌患者初诊时已处于局部进展期或晚期。新辅助治疗通过降低肿瘤分期、消除微转移、降低局部和远处复发风险从而改善局部进展期胃癌的总体生存,目前已被国内外众多指南所推荐[3- 6]。通过新辅助治疗后部分患者甚至可以达到病理完全缓解(pathological complete response,pCR),研究表明其是与预后相关的重要因素[7- 8]。但由于胃癌新辅助治疗后pCR率低,目前对于胃癌新辅助治疗后pCR的相关影响因素仍不清楚。本研究通过对胃癌新辅助治疗后pCR患者的临床和病理资料分析,探讨pCR以及新辅助治疗患者预后的相关因素,从而为新辅助治疗患者的临床治疗提供参考。
对象和方法
对象收集中国医学科学院肿瘤医院2008年1至12月行新辅助治疗并进行胃癌根治术的490例胃癌患者的临床资料,其中男性358例、女性132例。纳入标准:(1)组织病理学证实为胃腺癌;(2)术前影像学评估无明确远处转移及不可切除因素并进行新辅助治疗;(3)接受胃癌根治术加D2淋巴结清扫;(4)临床病理及随访资料完整;(5)接受手术前签署知情同意书。排除标准:(1)术中发现有远处转移或腹膜转移;(2)手术为姑息切除或未能完成手术的患者;(3)患多种恶性肿瘤者。本研究的所有研究过程均已获得中国国家癌症中心伦理审查委员会的批准。
治疗方法
新辅助化疗:(1)SOX方案:替吉奥胶囊(S- 1)80 mg/m2,每日2次,口服,第1~14日;奥沙利铂130 mg/m2,静脉滴注,第1日;21 d/周期。(2)FOLFOX方案:奥沙利铂 85 mg/m2,静脉滴注,第1日;亚叶酸钙 400 mg/m2,静脉滴注,第1日;5-氟尿嘧啶(5-fluorouracil,5-fu)400 mg/m2,静脉推注,第1日;5-fu 1200 mg/m2持续静脉滴注维持24 h,第1~2日;14 d/周期。(3)FOLT方案:5-fu 2600 mg/m2,持续静脉滴注超过24 h,第1日;亚叶酸钙200 mg/m2,静脉滴注,第1日;奥沙利铂85 mg/m2,静脉滴注,第1日;多西他赛50 mg/m2,静脉滴注,第1日;14 d/周期。(4)DOS方案:S- 1 80 mg/m2,每日2次,口服,第1~14日;奥沙利铂130 mg/m2,静脉滴注,第1日;多西他赛50 mg/m2,静脉滴注,第1日;21 d/周期。入组患者进行2~6个周期术前化疗,根据影像学评估病灶及患者耐受程度决定手术时机。
新辅助同步放化疗:(1)诱导化疗:采用SOX方案2~4周期,具体剂量如上所述。(2)同步放化疗:三维适形调强放疗给量:计划靶区40.04 Gy/22f,计划肿瘤靶区45.1 Gy/22f,放疗日同步口服S- 1 80 mg/m2,每日1次。
手术:根治性手术安排在新辅助治疗完成后4~6周进行。胃切除手术范围(全胃或远端)根据原发肿瘤大小和位置决定。所有患者均行保留脾脏的D2淋巴结清扫术。术后并发症根据Clavien-Dindo分类标准评估,具体并发症纳入范围为吻合口漏、伤口不愈合、腹腔出血、消化道内出血、术后肠梗阻、腹腔感染、胃轻瘫、胰瘘、肺炎、心脑血管意外、深静脉血栓、肾衰竭等。
新辅助疗效评估及术后病理反应评价疗效评估标准参照实体瘤疗效评价标准1.1,分为完全缓解、部分缓解(partial response,PR)、疾病稳定和疾病进展。采用NCI-CTCAE 4.0版评分系统对新辅助治疗中出现的不良反应进行评估。术后病理分期根据美国癌症联合会第8版TNM分期系统标准评估。肿瘤病理学反应根据Mandard肿瘤消退等级评价[9]。
随访总生存时间定义为从根治性手术时间至患者死亡或随访终点的时间。无病生存时间定义为从根治性手术时间至患者肿瘤出现复发或随访终点的时间。随访主要采用门诊复查、电话相结合的方式进行,末次随访时间为2019年12月。
统计学处理采用SPSS 24.0软件进行统计学分析。分类变量用χ2检验或Fisher’s精确检验。采用Kaplan-Meier法绘制生存曲线和计算生存率,生存时间比较采用Log-rank检验。采用多变量(因素)Cox回归分析方法探索影响胃癌患者生存的因素。
结 果
临床特征490例患者平均年龄(55.00±10.60)岁(21~84岁);治疗前临床分期Ⅱ期61例、Ⅲ期429例;490例患者中100例接受新辅助同步放化疗,390例接受新辅助化疗;肿瘤位于贲门-胃底-胃体部190例、胃窦-幽门部300例,平均清扫淋巴结(32.00±13.87)个(6~82个)。
新辅助治疗后病理完全缓解的影响因素共有41例患者接受新辅助治疗后达到pCR,其中男性35例、女性6例,整体pCR率为8.3%(41/490)。新辅助放化疗组pCR率为16.0%,新辅助化疗组为6.4%。单因素分析显示,新辅助放化疗(P=0.002)、术前治疗疗效为PR(P<0.001)及贲门-胃底-胃体部肿瘤(P<0.001)与新辅助治疗后达到pCR相关(表1)。进一步多因素分析显示,新辅助放化疗(OR=4.401,95%CI=2.023~9.574,P<0.001)、术前治疗疗效为PR(OR=40.492,95%CI=5.366~305.572,P<0.001)是新辅助治疗后pCR的独立预测因素。
新辅助治疗后患者预后分析490例患者中位随访时间为21.5个月(0.7~131.8个月),中位生存时间为54.4个月。1、3、5年总生存率分别为85.4%、60.7%、47.4%。1、3、5年无病生存率分别为72.3%、52.7%、45.38%。新辅助治疗后达到pCR患者的5年生存率为88.9%,非pCR患者的5年生存率为44.4%,两组比较差异有统计学意义(HR=6.204,95%CI=3.768~10.210,P=0.0003)(图1)。单因素预后分析显示年龄(P=0.026)、WHO组织分化等级(P=0.001)、术前治疗反应(P=0.013)、肿瘤部位(P<0.001)、术中清扫淋巴结数(P=0.013)、术后并发症(P=0.001)、术后pCR(P<0.001)及术后辅助化疗(P<0.001)与新辅助治疗后患者预后显著相关(表2)。进一步多因素分析显示,肿瘤呈低分化(HR=1.809,95%CI=1.104~2.964,P=0.019)、贲门-胃底-胃体部肿瘤(HR=2.025,95%CI=1.497~2.739,P<0.001)、术中淋巴结≤15枚(HR=1.482,95%CI=1.059~2.073,P=0.022)、术后出现并发症(HR=1.625,95%CI=1.156~2.285,P=0.005)、术后pCR(HR=0.153,95%CI=0.048~0.484,P=0.001)及术后行辅助化疗(HR=0.589,95%CI=0.421~0.823,P<0.001)是影响新辅助治疗后行胃癌根治术患者预后的独立因素。
讨 论
随着胃癌的新辅助治疗被临床逐渐接受,如何能够较为客观地反映新辅助治疗效果以及患者预后成为新辅助治疗领域研究的重点,而肿瘤学病理反应可能是最为重要的病理学指标之一。目前已有多项研究提示,新辅助治疗后达到pCR的胃癌患者能够获得较好的预后生存[7-8]。然而,胃癌与结直肠癌、乳腺癌等肿瘤相比,新辅助治疗后的pCR率较低[10-11]。本研究显示新辅助治疗后胃癌患者整体pCR率为8.3%。国内一项荟萃研究分析显示,所纳入的7项关于胃癌新辅助治疗研究平均pCR率为6.74%(3%~15%)[7]。Fileds等[12]报道在714例接受新辅助化疗或新辅助放化疗的胃及胃食管结合部癌患者中,有8.4%的患者达到pCR。另外,韩国的一项关于续贯新辅助化疗联合同步放化疗治疗局部进展期胃癌的Ⅱ期临床研究报道了12.1%的pCR率[13]。由此可见,尽管目前围手术期综合治疗模式已经成为局部进展期胃癌治疗的标准,但由于各个研究对于新辅助治疗模式(化疗或放化疗)、化疗方案的应用以及入组患者临床及病理特征的标准不尽相同,各研究报道的pCR率之间的差异也相对较大。
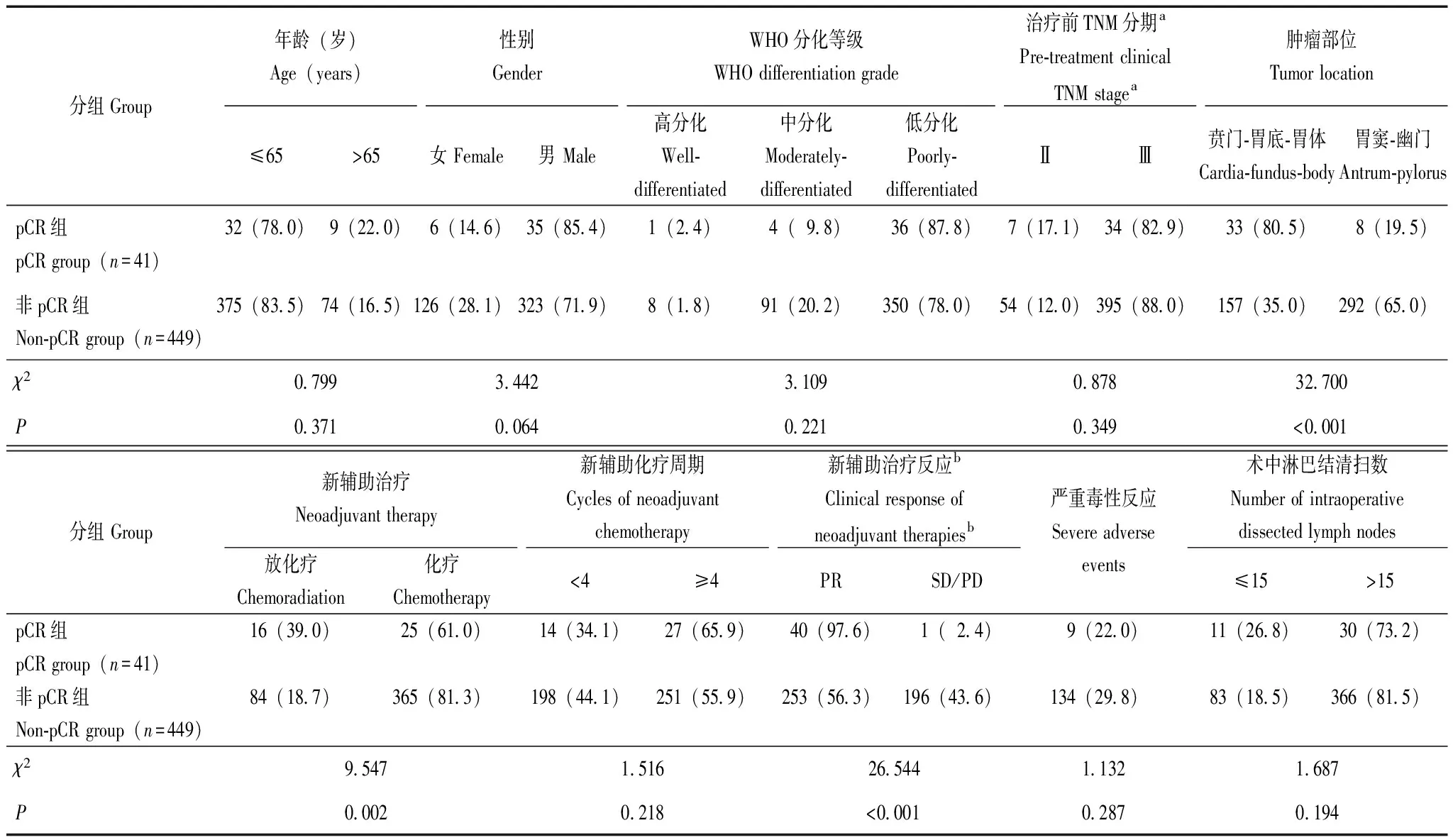
表1 影响胃癌新辅助治疗后病理完全缓解的单因素分析[n(%)]
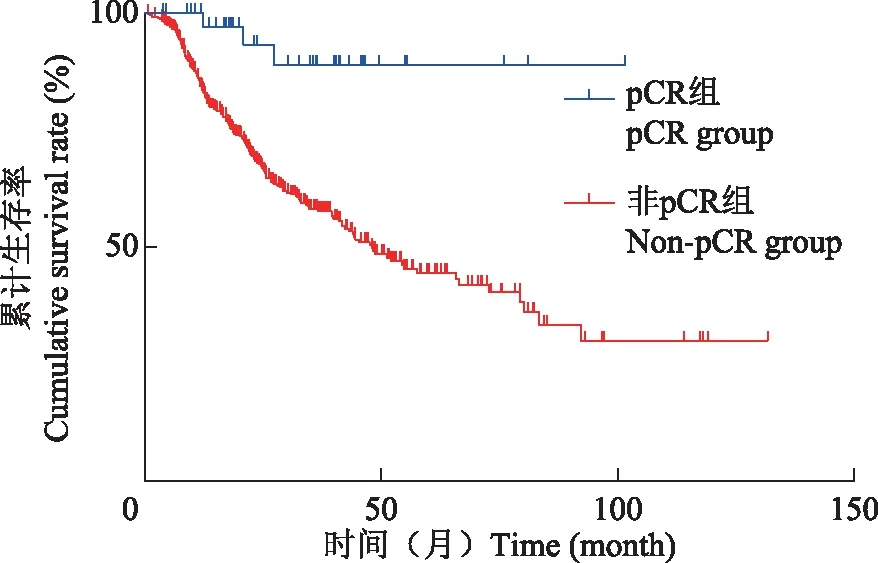
P=0.0003
目前对于局部进展期胃癌新辅助治疗的最佳模式仍然存在争议,因此探索不同治疗模式对胃癌患者治疗后pCR率的影响仍是目前新辅助治疗领域的研究热点。最近的多项研究结果显示,术前同步放化疗可以提高胃癌患者新辅助治疗后的pCR率[14- 17]。Zafar等[14]报道的一项基于美国国家癌症数据库的大样本回顾性研究显示,与单独接受术前化疗患者相比,接受术前放化疗的食管胃结合部癌患者原发肿瘤达到pCR的可能性高2.7倍(95%CI=1.29~3.23)。另一项针对局部进展期胃癌的研究评估新辅助化疗后原发肿瘤以及区域淋巴结的病理反应情况,结果显示术前放化疗组患者较单纯化疗组原发肿瘤病理反应达到Becker Ⅰa~Ⅰb级的可能性更高(58%比32%,P=0.001),区域淋巴结病理反应达到4级的概率(文章中定义为完全缓解)也较单纯化疗组高(30%比6%,P=0.009)[17]。本研究显示相似的结果,行新辅助放化疗较术前单纯行化疗患者的pCR率显著增高(新辅助放化疗16.0%,新辅助化疗6.4%),并且多因素分析显示新辅助放化疗是达到pCR的独立预测因素。造成此现象的原因可能是化疗药物对肿瘤细胞的杀伤增强了肿瘤对放疗的敏感性,从而提高了pCR率,但具体机制仍需要进一步的临床及基础研究进行探索。另一方面,术前化疗的方案以及化疗周期数也对胃癌的病理反应存在一定的影响。一项针对局部进展期胃癌的Ⅱ期临床试验报道了对比不同化疗方案及不同化疗周期疗效的早期结果,纳入的132例患者中,66例接受了卡铂联合替吉奥的术前化疗方案(33例患者2程化疗、33例4程化疗),66例患者接受多西他赛、卡铂及替吉奥的术前化疗方案(33例2程化疗、33例4程化疗)。术后病理结果显示,卡铂联合替吉奥组患者病理反应率(完全缓解或残存肿瘤小于10%)为19.4%,多西他赛、卡铂及替吉奥组为15.4%;2程化疗组为15.6%,4程化疗组为19.0%[18]。COMPASS试验对比了局部进展期胃癌接受2程或4程卡铂联合替吉奥(SC)或紫杉醇联合卡铂(PC)的化疗方案,结果显示各组的病理反应率分别为2程SC组43%,4程SC组40%,2程PC组29%,4程PC组38%。而病理完全缓解仅在4程化疗组出现,两组pCR率都为10%,由此可见4程化疗相比2程化疗能够提高局部进展期胃癌的pCR率[19]。

表2 影响胃癌新辅助治疗后胃癌根治术患者总生存率的单因素分析
目前,pCR已做为新辅助治疗有效的病理性证据,是评价新辅助治疗疗效的关键指标,并且其在预测患者预后方面具有重要的作用,许多大型前瞻性随机临床试验已将其作为主要终点事件之一。因此能够在手术之前通过影像学手段评估患者的肿瘤病理反应程度,对于局部进展期患者综合治疗策略的制定具有重要的意义。目前在新辅助治疗阶段,国内外多数研究及常规临床诊疗中多使用实体瘤疗效评价标准1.1来评估肿瘤对治疗的反应。本研究显示术前治疗达到PR是术后达到pCR的独立预测因素,提示术前影像学检测到的肿瘤反应与术后病理反应存在相关性。近年PET-CT在评估新辅助治疗疗效方面的作用也得到越来越多的重视。欧洲的一项前瞻性研究报道PET-CT在评价局部进展期胃食管结合部肿瘤新辅助治疗疗效中的作用,研究共纳入79例患者,利用基线与治疗后PET-CT的最大摄取值变化率(standardized uptake ratio,SUR)评估治疗反应,结果显示存在病理反应患者较无反应患者的SUR显著降低,并且术前放化疗组较单纯化疗组患者SUR值变化更大,但pCR与病理部分缓解者的SUR差异无统计学意义[19]。因此,提示虽然PET-CT能够有效地区分出病理反应者与无反应者,但对于pCR的判断仍不准确[20]。Cheedella等[21]也报道了相似的结果,评价临床完全缓解(术前胃镜活检阴性+PET扫描显示生理性摄取)与病理完全缓解的相关性,纳入的284例患者中,218例(77%)达到临床缓解,然而其中仅有31%(67/218)在术后病理评估为pCR,临床完全缓解预测pCR的敏感度为97.1%(67/69),但特异度仅为29.8%(64/215)。因此临床完全缓解与pCR的相关性较差,并不能在临床决策对医生及患者起到指导作用。由此可见,目前临床上所能用到的影像学手段如增强CT、PET-CT等以及内镜活检都不能完全评估新辅助治疗后胃癌患者的病理学反应状态。
目前对于新辅助放化疗与新辅助化疗对局部进展期胃癌患者预后的影响仍存在争议。本研究显示术前放化疗可以提高患者pCR率,但多因素预后分析显示新辅助放化疗并不是患者总生存的独立影响因素。许多其他相关的研究同样得到了与本研究相似的结果,即术前放化疗可以提高pCR率,降低局部复发率;但与单纯化疗相比,其并不影响患者总生存[14- 16,22-23]。然而,Tian等[24]报道了不同的结果,对1048例接受新辅助治疗的胃食管结合部癌及胃癌患者分析显示,术前放化疗组pCR率高于单纯化疗(13.1% 比8.2%,P=0.01),但在预后分析中显示化疗组中位生存、2年生存率以及5年生存率均显著高于放化疗组。由此可见,术前放疗的加入可以对原发肿瘤以及区域淋巴结中转移的肿瘤细胞增强杀伤,从而降低局部复发率。但目前已经有数项研究讨论了心脏接受的放疗剂量与患者不同原因死亡率以及心血管事件发生之间的关系[25- 27],并且接受术前放疗还可能降低患者接受术后化疗的耐受能力,而本研究及许多其他研究已经证实术后辅助化疗是预后的重要影响因素[24],并且值得注意的是,目前尚无临床研究关注术后辅助治疗在新辅助放化疗治疗模式中的作用,因此,对此方面的疑问仍值得在未来进行深入探索。
综上,本研究表明新辅助治疗后获得pCR的局部进展期胃癌患者可以获得满意的远期生存,并且是患者预后的独立预测因素。相较于单纯化疗,术前放化疗可以显著提高局部进展期胃癌的pCR率。对于新辅助放化疗与化疗对患者预后的影响仍需进一步探索。

