胡黄连苷 Ⅱ 通过MEK/ERK通路抑制食管癌细胞增殖及侵袭转移的机制研究Δ
杨 谦,张 军,马玉泉,谭雪敏
(邯郸市中心医院胸外二科,河北 邯郸 056000)
食管癌是指来源于食管上皮的恶性肿瘤,常伴有体重严重下降、呕血及便血等不良症状,是世界范围内发病率较高的恶性肿瘤之一,若发生转移或侵袭临近器官,将会对患者的生命健康造成威胁[1]。目前,临床常用手术、化疗和放疗等方法缓解食管癌,但预后效果较差,生存率较低[2]。恶性肿瘤细胞增殖、迁移和侵袭是恶性肿瘤发展的重要因素,因此,探讨新型药物对于食管癌的治疗具有重要意义。胡黄连苷是中药胡黄连中的一种有效成分,为环烯醚萜类化合物,具有肝脏保护[3]、神经保护[4]和抗炎[5]等多种生物活性。胡黄连苷Ⅱ是胡黄连苷单体有效成分之一,资料显示其能显著抑制乳腺癌细胞的迁移、侵袭及肿瘤血管生成,并认为胡黄连苷Ⅱ具有潜在的恶性肿瘤治疗作用[6]。但关于其具体机制尚不清晰。研究结果表明,丝裂原活化的细胞外信号调节激酶(mitogen extracellular signal regulated kinase,MEK)/细胞外信号调节激酶(extracellular signal regulated kinase,ERK)信号通路在细胞的增殖、分化、侵袭和迁移过程中发挥重要作用,激活的MEK可使ERK磷酸化,进而调节细胞功能,加速细胞增殖,最终导致肿瘤的形成与发展[7-8]。推测胡黄连苷Ⅱ和MEK/ERK通路之间可能存在一定的关联。目前关于胡黄连苷Ⅱ对食管癌的治疗作用研究较少,本研究通过培养人食管癌细胞,探讨胡黄连苷Ⅱ抑制食管癌细胞增殖、侵袭及迁移的机制。
1 材料与方法
1.1 材料
1.1.1 仪器:MCO-15AC型CO2细胞培养箱(日本SANYO公司);XElx800型酶标仪(美国Perkin Elmer公司);NC-100型细胞计数器(丹麦Chemimetec公司);Accuri C6型流式细胞仪(美国BD公司);TS100型倒置显微镜(日本Nikon公司);GIS-500型凝胶成像仪(杭州米欧仪器有限公司)。
1.1.2 实验细胞及药物:人食管癌Eca109细胞(批号:XY-XB-1075)购自美国菌种保藏中心。
1.1.3 药品与试剂:胡黄连苷Ⅱ(原料药,纯度≥98%,批号:39012-20-9)购自上海同田生物技术有限公司;MEK/ERK信号通路激活剂(美国MedChemexpress公司,批号:HY-12028);膜联蛋白V-异硫氰酸荧光素/碘化丙啶(Annexin V-FITC/PI)细胞凋亡双染试剂盒、聚乙二醇辛基苯基醚(Triton X-100)试剂(武汉普诺赛生命科技有限公司,批号分别为P-CA-201、SA-209);RPMI-1640培养基、胎牛血清(FBS)、胰蛋白酶及四唑盐(MTT)试剂盒(北京索莱宝科技有限公司,批号分别为P1400、T1300、R1200及M1020);RIPA裂解液、蛋白提取试剂盒及BCA蛋白测定试剂盒(上海碧云天公司,批号分别为P0013C、P0027及P0011);鼠抗人B淋巴细胞瘤-2基因(Bcl-2)、Bcl-2相关X蛋白(Bax)、细胞周期蛋白依赖性激酶2(CDK2)、MEK、磷酸化MEK(p-MEK)、ERK、磷酸化ERK(p-ERK)及β-肌动蛋白(β-actin)一抗(武汉菲恩生物科技有限公司,批号分别为FNab00809、FNab00840、FNab09147、FNab03527、FNab01553、FNab05113、FNab02844及FNab00032);鼠抗人半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)、细胞周期蛋白D1(cyclinD1)、细胞周期蛋白D3(cyclinD3)、磷酸化丝氨酸/苏氨酸蛋白激酶(p-c-Raf)一抗及鼠抗人IgG二抗(美国Abcam公司,批号分别为ab13847、ab16663、ab183338、ab42596及ab150077)。
1.2 方法
1.2.1 细胞培养及含药培养液制备:将食管癌Eca109细胞株快速融化,在离心管中反复吹打至细胞充分悬浮后接种于培养瓶,用含10% FBS的RPMI-1640培养液,于37 ℃、5%CO2培养箱中进行培养;细胞长满培养瓶后进行消化传代,用0.25%胰蛋白酶进行消化,消化至细胞变圆、即将从瓶壁脱落时停止消化并继续培养,取对数生长期细胞进行实验。胡黄连苷Ⅱ用无血清培养液溶解,配置成浓度为0、5、10、20、40及60 μmol/L的含药培养液。
1.2.2 胡黄连苷Ⅱ对食管癌Eca109细胞增殖的影响:收集对数生长期细胞,分别用0、5、10、20、40及60 μmol/L的含药培养液培养食管癌Eca细胞48 h,用MTT试剂盒检测细胞增殖情况,每孔加入MTT溶液(5 g/L)20 μl,培养4 h后吸去上清液,加入二甲基亚砜150 μl,摇匀后于酶标仪中测定吸光度记为A实验,同时设置对照孔(含细胞、培养基及MTT溶液,不含药物)及空白孔(含培养基、MTT溶液,不含药物和细胞),计算细胞增殖抑制率(%)=[(A对照-A实验)/(A对照-A空白)]×100%。每组5个复孔,实验重复3次(n=3)。选取对食管癌Eca109细胞增殖抑制率较强的含药培养液进行后续实验。
1.2.3 细胞分组及处理:收集对数生长期细胞,分为正常培养组(不加药物,常规培养)、胡黄连苷Ⅱ组(20 μmol/L胡黄连苷Ⅱ含药培养液200 μl)、激活剂组(等量20 μmol/L MEK/ERK信号通路激活剂)及胡黄连苷Ⅱ+激活剂组(等量20 μmol/L胡黄连苷Ⅱ含药培养液+20 μmol/L MEK/ERK信号通路激活剂),于37 ℃、5%CO2培养箱中进行培养48 h后,收集四组细胞进行实验。
1.2.4 MTT法检测细胞增殖活性:采用MTT法检测四组食管癌Eca109细胞增殖情况,测定方法同“1.2.2”项。
1.2.5 流式细胞仪检测细胞凋亡及周期情况:参考文献[9]并按照AnnexinV-FITC/PI细胞凋亡双染试剂盒中的要求进行操作,将四组食管癌Eca109细胞加入胰蛋白酶进行消化,加入FBS培养基终止消化,调整细胞密度为1×106个/ml并收集于1.5 ml EP管中,每管1 ml,用预冷PBS缓冲液清洗2次后离心,加入70%的乙醇溶液在4 ℃固定过夜,用PBS缓冲液清洗细胞后离心,重悬于PBS缓冲液中,加入2 μl RNA酶去除内源性RNA,加入1 μl Triton X-100增加细胞膜通透性,静置45 min后加入2 μl PI溶液,避光下染色1 h,用细胞流式仪观察并分析细胞凋亡及周期情况。每组5个复孔,实验重复3次(n=3)。
1.2.6 Transwell小室实验检测细胞侵袭能力:收集四组食管癌Eca109细胞,调整细胞密度至2×105个/ml,各取细胞液200 μl加入预铺设稀释Matrigel胶的上室,用RPMI-1640培养液补至1 ml,下室加入含10% FBS的RPMI-1640培养液600 μl,培养24 h,擦拭胶上细胞及Matrigel胶,将小室于4%多聚甲醛中固定20 min并室温(25 ℃)风干,接着用结晶紫染液浸染20 min,室温风干后去除聚碳酸酯膜,置于载玻片上,以树胶封片,于光学显微镜下观察小室细胞侵袭情况,计算穿过Matrigel基质的平均细胞数[10]。实验重复3次(n=3)。
1.2.7 划痕实验检测细胞迁移能力:收集四组食管癌Eca109细胞,将细胞置于37 ℃、5%CO2恒温培养箱中继续培养,待细胞融合率约90%时,用200 μl枪头垂直于6孔板底部做横线划痕,之后继续置于恒温培养箱中培养12 h,于倒置显微镜下拍照观察,利用Image J软件测量划痕区域宽度,并计算细胞划痕愈合率(%)=[(0 h划痕区域宽度-12 h划痕区域宽度)/0 h划痕区域宽度]×100%[11]。实验重复3次(n=3)。
1.2.8 蛋白免疫印迹法检测细胞凋亡相关蛋白、周期相关蛋白和MEK/ERK通路相关蛋白表达情况:收集四组食管癌Eca109细胞,吸去培养基后置于灭菌离心管中,加入RIPA裂解液提取其中蛋白质,用BCA蛋白试剂盒测定细胞中总蛋白含量,用聚丙烯酰胺凝胶电泳分离等量蛋白质后转移至聚偏氟乙烯膜上,在4 ℃下添加Caspase-3、Bax、Bcl-2、cyclinD1、cyclinD3、CDK2、p-c-Raf、p-MEK、MEK、p-ERK、ERK与β-actin一抗(均为1∶1 000稀释)孵育过夜,用TBST缓冲液洗涤后添加二抗(1∶5 000稀释)常温下孵育2 h,采用凝胶成像仪对蛋白水平进行定量分析。
1.3 统计学方法

2 结果
2.1 胡黄连苷Ⅱ对食管癌Eca109细胞增殖的影响
与0 μmol/L组(0%)相比,5、10、20、40和60 μmol/L的胡黄连苷Ⅱ对食管癌Eca109细胞增殖抑制率[(14.06±1.69)%、(19.44±2.21)%、(25.71±2.59)%、(23.04±2.38)%和(21.25±2.25)%]显著升高(F=25.922,P=0.000),其中20 μmol/L胡黄连苷Ⅱ对食管癌Eca109细胞增殖抑制率最高,因此,选择20 μmol/L胡黄连苷Ⅱ用于后续实验。
2.2 四组食管癌Eca109细胞增殖情况比较
与正常培养组[食管癌Eca109细胞增殖抑制率为(11.59±1.21)%]相比,胡黄连苷Ⅱ组食管癌Eca109细胞增殖抑制率[(25.68±1.68)%]升高,激活剂组细胞增殖抑制率[(8.01±1.20)%]降低;与胡黄连苷Ⅱ组相比,胡黄连苷Ⅱ+激活剂组食管癌Eca109细胞增殖抑制率[(15.30±1.27)%]降低;与激活剂组相比,胡黄连苷Ⅱ+激活剂组食管癌Eca109细胞增殖抑制率升高,上述差异均有统计学意义(P<0.05)。
2.3 四组食管癌Eca109细胞凋亡率和凋亡相关蛋白表达比较
与正常培养组相比,胡黄连苷Ⅱ组细胞凋亡率、Caspase-3及Bax蛋白表达升高,Bcl-2蛋白表达降低;激活剂组细胞凋亡率、Caspase-3及Bax蛋白表达降低,Bcl-2蛋白表达升高,上述差异均有统计学意义(P<0.05)。与胡黄连苷Ⅱ组相比,胡黄连苷Ⅱ+激活剂组细胞凋亡率、Caspase-3及Bax蛋白表达降低,Bcl-2蛋白表达升高;与激活剂组相比,胡黄连苷Ⅱ+激活剂组细胞凋亡率、Caspase-3及Bax蛋白表达升高,Bcl-2蛋白表达降低,上述差异均有统计学意义(P<0.05),见表1、图1—2。
表1 四组食管癌Eca109细胞凋亡率和凋亡相关蛋白表达比较Tab 1 Comparison of apoptosis rate and expression of apoptosis-related protein among 4 group of esophageal
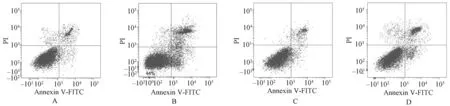
A.正常培养组;B.胡黄连苷Ⅱ组;C.激活剂组;D.胡黄连苷Ⅱ+激活剂组A. normal culture group; B. picroside Ⅱ group; C. activator group; D. picroside Ⅱ+activator group图1 四组食管癌Eca109细胞凋亡率比较Fig 1 Comparison of apoptosis rate among 4 group of esophageal cancer Eca109 cells
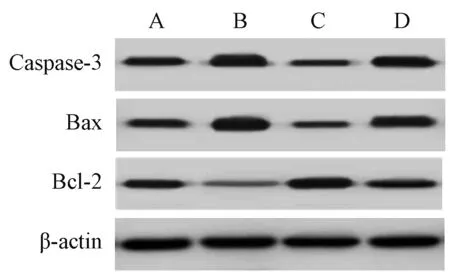
A.正常培养组;B.胡黄连苷 Ⅱ 组;C.激活剂组;D.胡黄连苷 Ⅱ +激活剂组A. normal culture group; B. picroside Ⅱ group; C. activator group; D. picroside Ⅱ+activator group图2 四组食管癌Eca109细胞凋亡相关蛋白表达比较Fig 2 Comparison of expression of apoptosis-related protein among 4 groups of esophageal cancer Eca109 cells
2.4 四组食管癌Eca109细胞周期分布情况比较
与正常培养组相比,胡黄连苷Ⅱ组G0/G1期、S期比例升高,G2/M期比例降低;激活剂组G0/G1期、S期比例降低,G2/M期比例升高,差异均有统计学意义(P<0.05)。与胡黄连苷Ⅱ组相比,胡黄连苷Ⅱ+激活剂组G0/G1期、S期比例降低,G2/M期比例升高;与激活剂组相比,胡黄连苷Ⅱ+激活剂组G0/G1期、S期比例升高,G2/M期比例降低,差异均有统计学意义(P<0.05),见表2。
表2 四组食管癌Eca109细胞周期分布情况比较Tab 2 Comparison of distribution of cell cycle among 4 groups of esophageal cancer Eca109 cells n=3,%)
2.5 四组食管癌Eca109细胞侵袭及迁移能力比较
与正常培养组相比,胡黄连苷Ⅱ组侵袭细胞数、划痕愈合率降低,激活剂组侵袭细胞数、划痕愈合率升高,差异均有统计学意义(P<0.05)。与胡黄连苷Ⅱ组相比,胡黄连苷Ⅱ+激活剂组侵袭细胞数、划痕愈合率升高;与激活剂组相比,胡黄连苷Ⅱ+激活剂组侵袭细胞数、划痕愈合率降低,上述差异均有统计学意义(P<0.05),见表3、图3—4。
表3 四组食管癌Eca109细胞侵袭及迁移能力比较Tab 3 Comparison of invasive and metastasizing ability among 4 groups of esophageal cancer Eca109 cells n=3)

A.正常培养组;B.胡黄连苷Ⅱ组;C.激活剂组;D.胡黄连苷Ⅱ+激活剂组A. normal culture group; B. picroside Ⅱ group; C. activator group; D. picroside Ⅱ+activator group图3 四组食管癌Eca109细胞侵袭能力比较(结晶紫染色,×200)Fig 3 Comparison of invasive ability among 4 groups of esophageal cancer Eca109 cells (crystal violet staining, ×200)

A.正常培养组;B.胡黄连苷Ⅱ组;C.激活剂组;D.胡黄连苷Ⅱ+激活剂组A. normal culture group; B. picroside Ⅱ group; C. activator group; D. picroside Ⅱ+activator group图4 四组食管癌Eca109细胞迁移能力比较Fig 4 Comparison of metastasizing ability among 4 groups of esophageal cancer Eca109 cells
2.6 四组食管癌Eca109细胞周期相关蛋白、MEK/ERK通路相关蛋白表达比较
与正常培养组相比,胡黄连苷Ⅱ组食管癌Eca109细胞周期相关蛋白(cyclinD1、cyclinD3和CDK2)、MEK/ERK通路相关蛋白(p-c-Raf、p-MEK和p-ERK)表达降低;激活剂组细胞周期相关蛋白、MEK/ERK通路相关蛋白表达升高,差异均有统计学意义(P<0.05)。与胡黄连苷Ⅱ组相比,胡黄连苷Ⅱ+激活剂组食管癌Eca109细胞周期相关蛋白、MEK/ERK通路相关蛋白表达升高;与激活剂组相比,胡黄连苷Ⅱ+激活剂组食管癌Eca109细胞周期相关蛋白、MEK/ERK通路相关蛋白表达降低,差异均有统计学意义(P<0.05),见表4、图5—6。
表4 四组食管癌Eca109细胞周期及MEK/ERK通路相关蛋白表达比较Tab 4 Comparison of cell cycle and MEK/ERK pathway related protein expression of esophageal cancer Eca109 cells in each group n=3)
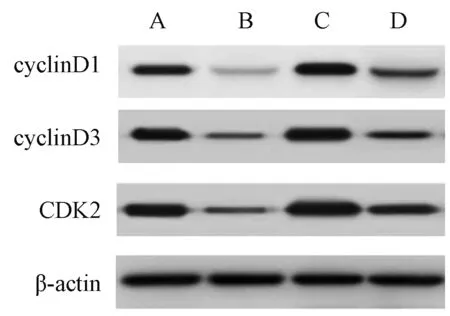
A.正常培养组;B.胡黄连苷 Ⅱ 组;C.激活剂组;D.胡黄连苷 Ⅱ +激活剂组A. normal culture group; B. picroside Ⅱ group; C. activator group; D. picroside Ⅱ+activator group图5 四组食管癌Eca109细胞周期相关蛋白表达比较Fig 5 Comparison of expression of cell cycle-related protein among 4 groups of esophageal cancer Eca109 cells
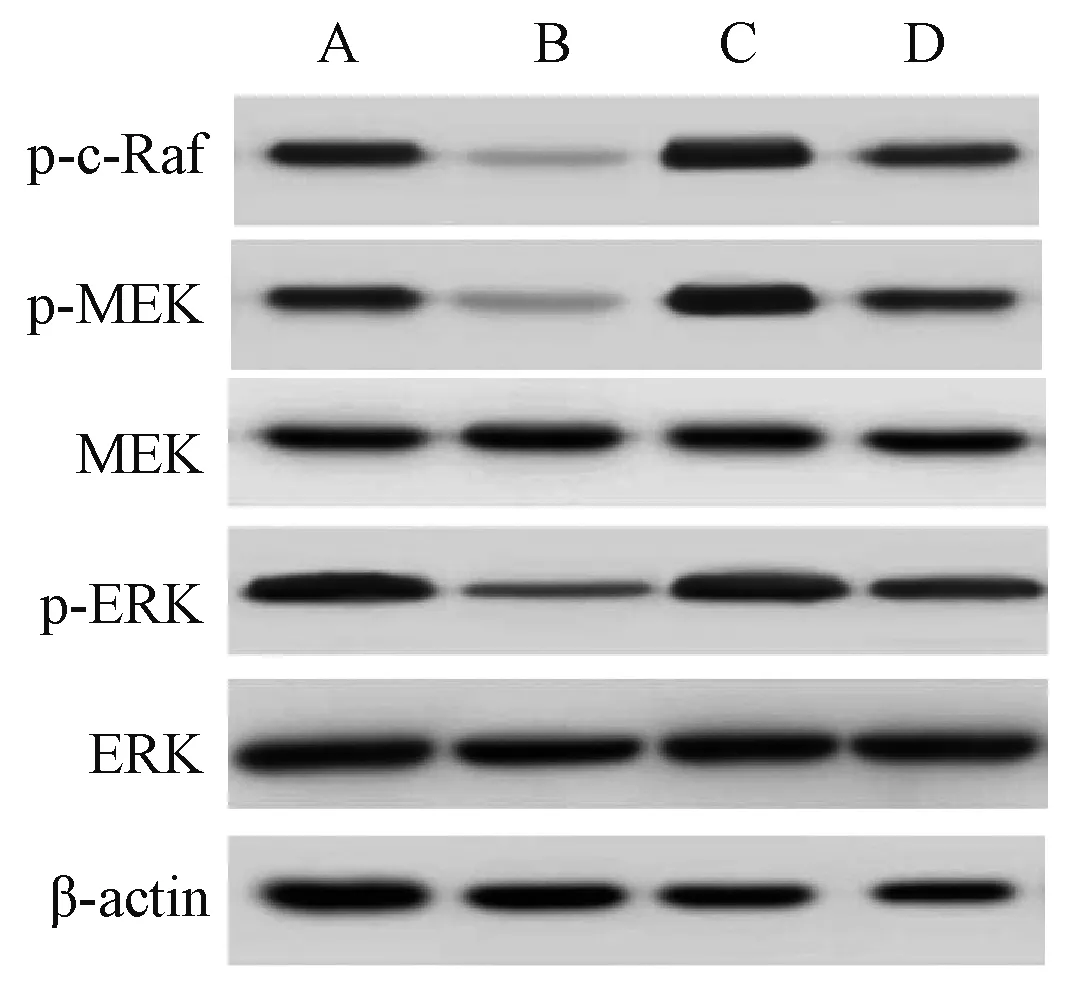
A.正常培养组;B.胡黄连苷Ⅱ组;C.激活剂组;D.胡黄连苷Ⅱ+激活剂组A. normal culture group; B. picroside Ⅱ group; C. activator group; D. picroside Ⅱ+activator group图6 四组食管癌Eca109细胞MEK/ERK通路相关蛋白表达比较Fig 6 Comparison of expression MEK/ERK pathway-related protein among 4 groups of esophageal cancer Eca109 cells
3 讨论
食管癌是常见的恶性肿瘤,我国是食管癌高发区,食管癌的发病与吸烟、喝酒及不良饮食习惯等多种因素密切相关,常有手术、化疗和放疗等多种治疗方法,但仍表现出较低的存活率[12]。因此,寻找有效的药物对于治疗食管癌具有重要意义。资料显示,胡黄连苷Ⅱ是中药胡黄连的有效成分之一,具有抗氧化、抗凋亡、抗炎、抗肿瘤、神经保护、护肝和抗胆固醇等多种药理作用[13],可在缓解急性胰腺炎[14]、心肌梗死[15]等方面发挥重要作用;且胡黄连苷Ⅱ具有诱导肾癌细胞凋亡的作用,通过改变Bax、Bcl-2等细胞凋亡相关蛋白的表达来发挥作用[16]。Caspase-3、Bax及Bcl-2蛋白表达与细胞凋亡密切相关,Caspase-3、Bax是介导细胞凋亡的关键水解酶,是细胞凋亡过程中的重要调控因子;Bcl-2是一种抗凋亡因子,可侧面反应细胞凋亡状态[17]。本研究结果显示,与正常培养组相比,胡黄连苷Ⅱ组食管癌Eca109细胞增殖抑制率、凋亡率升高,Caspase-3、Bax蛋白表达升高,Bcl-2蛋白表达降低,细胞侵袭、迁移能力降低,表明胡黄连苷Ⅱ具有一定的诱导人食管癌Eca109细胞凋亡、抑制细胞侵袭、迁移的作用,推测其具有潜在的食管癌治疗作用,但其作用机制尚不明确。
细胞周期是由细胞周期蛋白(cyclins)及细胞周期蛋白依赖性激酶(CDK)调控的,CDK4是CDK家族重要成员,在细胞周期调控过程中起到关键作用,当细胞受到不良刺激时,CDK4与cyclins D1结合形成复合物,进而引起细胞周期发生紊乱,使细胞分化减弱、异常增殖、功能紊乱,最后发展为肿瘤细胞[18]。MEK/ERK信号通路的过度激活与肿瘤的发生发展联系密切,ERK信号通路在血管内皮细胞增殖及新血管生成过程中发挥重要作用,持续性激活的ERK信号通路可正向调控细胞周期,推动细胞由G1期进入S期,进而促进细胞异常增殖与分化[19]。资料显示,活化的cyclins D可激活MEK/ERK信号通路,使得p-ERK表达增加,导致cyclins D等细胞周期相关蛋白的表达增加,加速细胞周期进程,促进细胞增殖,进而导致肿瘤的发生与发展[20]。本研究结果显示,胡黄连苷Ⅱ处理过的食管癌Eca109细胞周期相关蛋白、MEK/ERK通路相关蛋白表达较正常培养细胞降低,表明胡黄连苷Ⅱ具有一定的调节细胞周期并抑制MEK/ERK通路激活的作用;用胡黄连苷Ⅱ和MEK/ERK通路激活剂共同处理食管癌Eca109细胞后,药物的抑制增殖及抗凋亡能力减弱,进一步表明胡黄连苷Ⅱ抑制MEK/ERK通路是其发挥抗食管癌作用的重要机制之一。
综上所述,胡黄连苷Ⅱ具有抑制食管癌细胞增殖、迁移和侵袭的作用,与调节细胞凋亡、周期相关蛋白的表达密切相关,其中抑制MEK/ERK通路在抗食管癌细胞增殖过程中起到重要作用,但其作用机制较为复杂,仍需深入研究。

