基于网络药理学和分子对接技术探讨凉膈散抑制急性肺损伤细胞因子风暴的机制Δ
杨丽玲,周湘君,晏丽君,余林中
(1.暨南大学附属东莞医院临床药学科,广东 东莞 523900; 2.广东医科大学药学院,广东 东莞 523808; 3.南方医科大学中医药学院,广东 广州 510515)
急性肺损伤(acute lung injury,ALI)是以肺实质细胞损伤为主要特征的急性低氧血症,其严重阶段为急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS),严重感染及细胞因子风暴引起失控的全身性炎症反应是ALI发生的重要原因,急性胰腺炎、脓毒症、新型冠状病毒肺炎(COVID-19)、甲型流感(H1N1、H5N1及H7N9)等重症及危重病例均会出现ALI。目前,对于ALI尚缺乏满意的治疗药物,糖皮质激素的应用受到广泛质疑,尽管应用了机械通气、体外膜氧合等综合治疗措施,病死率仍高达40%,成为危重病医学的难点[1-2]。中医学对ALI的认识颇有特色,中西医结合的防治措施对ALI的治疗作用也得到了肯定[3-4]。尤其对于COVID-19疫情的防控,中医药全程介入、中西医结合治疗在控制疾病进程、提高治愈率等方面优势明显[5]。凉膈散为中医温病治疗经典名方,由黄芩、连翘、山栀子、薄荷、大黄、芒硝、淡竹叶和甘草组成。相关的临床研究[6]及本团队先期的实验研究[7]结果均表明,凉膈散是治疗严重感染及炎症所致ALI的有效方,但该方的主要作用靶点和作用机制尚未明确,有必要进一步研究。
研究结果发现,细胞因子过度释放可诱发细胞因子风暴导致ALI,细胞因子风暴是推动ALI向ARDS进展的主要原因[8]。促炎因子白细胞介素(IL)1β、IL-6及肿瘤坏死因子(TNF)α是引起细胞因子风暴的关键因子,利用其特异性抑制剂、阻断剂遏制细胞因子风暴一直是抗ALI药物研究的热点[9]。此外,糖原合成酶激酶3β(GSK-3β)作为炎症反应的中枢激酶,是多条炎症信号通路如NF-κB、p38及JNK信号通路相应调节位点NF-κB p65、CREB及AP-1的共同靶分子,与ALI的发生发展密切相关,可作为抗ALI药物筛选的新靶标[10-11]。本研究利用网络药理学技术筛选出凉膈散活性成分和作用靶点,预测其核心化合物及信号通路,再将核心化合物与IL-6、TNF-α、IL-1β及GSK-3β药物靶点通过Auto Dock进行分子对接,进一步预测凉膈散抑制ALI细胞因子风暴的分子机制,为凉膈散方及其单体成分多角度的开发应用提供参考。
1 资料与方法
1.1 凉膈散组方药物活性成分及对应靶点的筛选
在中药系统药理学数据库与分析平台(traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP)中对凉膈散所有组方药物的化学成分进行筛选[条件:口服生物利用度(oral bioavailability,OB)≥30%且类药性(drug-likeness,DL)≥0.18],得到凉膈散活性成分及相关的作用靶点。
1.2 ALI靶点收集
以“acute lung injury”为关键词检索人类孟德尔遗传综合数据库(online mendelian inheritance in man,OMIM)和GeneCards数据库,将结果汇总、分析,取交集,得到ALI疾病相关靶点基因。
1.3 药物-疾病靶标蛋白基因名确定、蛋白质-蛋白质相互作用(protein-protein Interaction,PPI)网络构建及“中药-化合物-靶点”相互作用网络构建
通过Uniprot 数据库查询“1.1”项与“1.2”项对应的基因名,利用R软件进行交集分析,得到“疾病-药物”共同靶点。将共同靶点上传至String数据库,按最低相互作用得分(中等可信度:0.99)构建PPI网络。输入凉膈散活性成分、共同靶点等至Cytoscape软件,构建“中药-化合物-靶点”相互作用网络。
1.4 基因本体(gene ontology, GO)功能富集分析和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析
将“凉膈散-ALI”共同靶点用R软件进行GO功能、KEGG通路富集分析,用Cytoscape软件可视化靶点-通路网络。
1.5 “成分-靶点”分子对接
通过ChemSpider数据库筛选出的凉膈散核心化合物结构,利用Chem3D软件转换为mol2格式。从RCSB数据库下载IL-6(PDB:1P9M)、TNF-α(PDB:1NCF)、IL-1β(PDB:4DEP)和GSK-3β(PDB:1H8F)的3D结构,在AutoDockTools中删配体、去水、加氢及计算格点能等,最后使用VINA程序进行分子对接。
2 结果
2.1 凉膈散组方药物活性化合物收集
根据设置的筛选条件,从TCMSP数据库中收集到候选活性化合物共192个;来源于大黄16个,连翘23个,黄芩36个,甘草92个,栀子15个,薄荷10个(芒硝和竹叶均未检索到化合物数据)。其中,部分化合物存在于多种单味药中,如木犀草素(luteolin)来源于连翘和薄荷,β-谷甾醇(beta-sitosterol)为黄芩、连翘、大黄和栀子共有。删除重复活性成分后,共获得候选活性化合物173种,其中,黄芩的新黄芩素(MOL002934)、连翘的连翘脂素(MOL003330)和甘草的甘草酚(MOL002311)的OB排序居前3位,均>90%;甘草的美迪紫檀素(MOL004924)、甘草醇F(MOL004988)和连翘的荷包牡丹碱(MOL000791)的DL排序居前3位,均≥0.88;此外,有159个(占90.34%)活性成分的肠上皮通透性(Caco-2)≥-0.4,提示凉膈散极易被小肠吸收利用。
2.2 “凉膈散-ALI”靶点收集及PPI网络构建
从TCMSP数据库中得到凉膈散活性成分173个,其对应靶点263个;从GeneCards和OMIM数据库中得到ALI相关靶点6 400个,二者交集得到“凉膈散-ALI”共同靶点237个,见图1。用237个共同靶点反向筛选凉膈散成分,剔除不作用于这237个靶点的成分,得到作用于ALI相关靶点的活性化合物149个。237个“凉膈散-ALI”共同靶点通过String数据库构建的PPI网络见图2。如图所示,靶蛋白通过基因连线相互作用形成多中心相互作用网络图,靶点蛋白节点连接数越高则在网络中越重要,为核心靶点蛋白;AKT1、IL-6、MAPK3、VEGFA、JUN、EGFR、CASP3、MAPK8、EGF和MAPK1等10种靶蛋白连线最多,处于整个网络的核心位置,提示上述靶蛋白与其他靶蛋白相互作用非常密切,在维持网络稳定性和相互作用中起到重要作用,因此其编码基因可能是“凉膈散-ALI”的核心靶点基因。将核心靶点蛋白按其连接数进行排序,绘制成条形图,见图3。
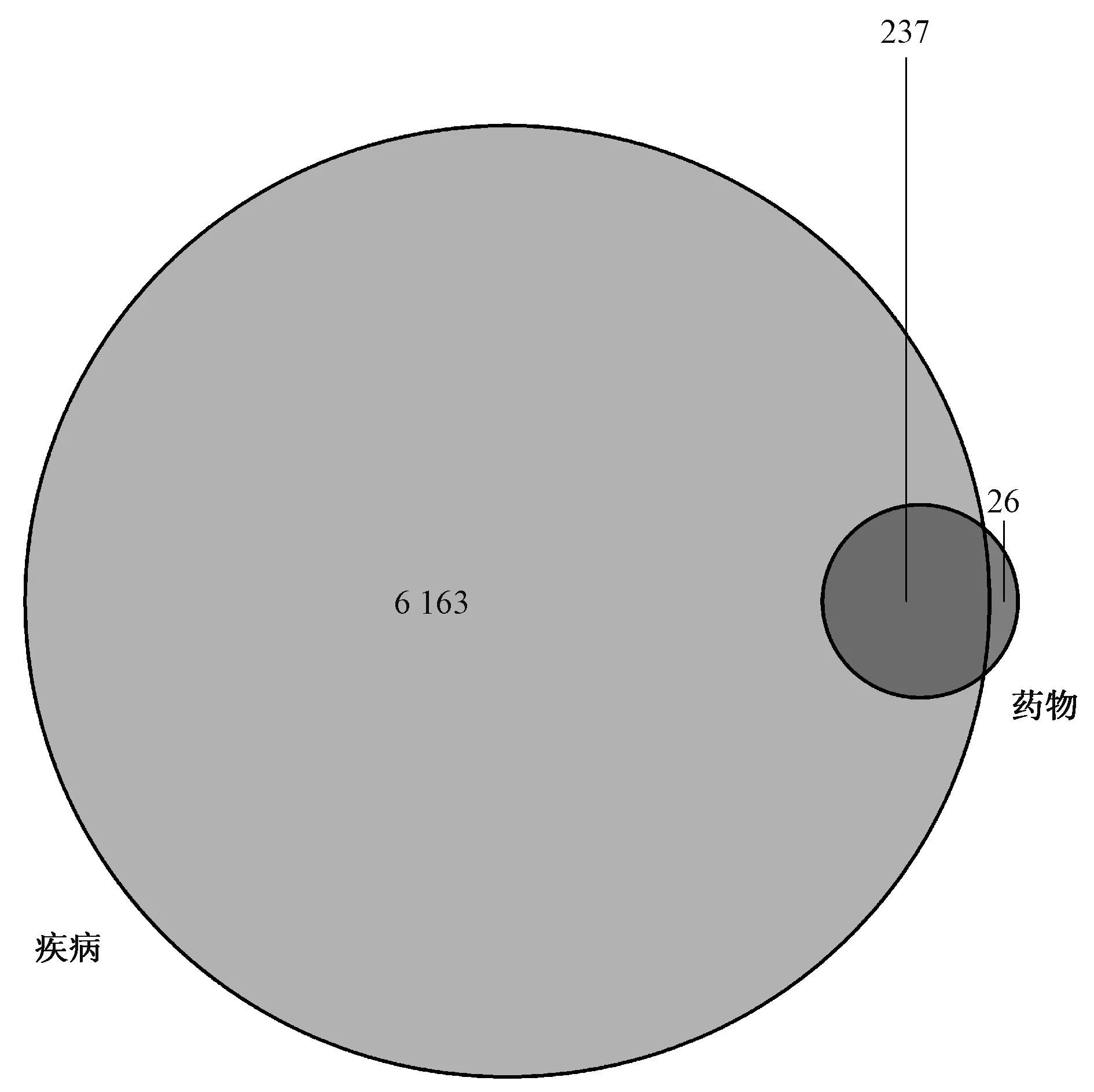
图1 凉膈散-ALI靶点交集韦恩图Fig 1 Venn diagram of targets intersection of Liangge Powder-ALI
2.3 “中药-化合物-靶点”相互作用网络构建
“中药-化合物-靶点”相互作用网络见图4。在组方中药方面,有11个化合物归属于2种以上药材,以来源于甘草的化合物居多。在靶点蛋白方面,10.55%的靶点蛋白与≥20个化合物相互作用;作用≥30个化合物的靶点蛋白共23个。在化合物方面,20.81%化合物的靶点蛋白≥20个,其中8个化合物的靶点蛋白≥30个;靶点蛋白数排序居前3位的化合物分别为槲皮素、木犀草素和山柰酚,相关靶点蛋白数分别为130、52和50个。
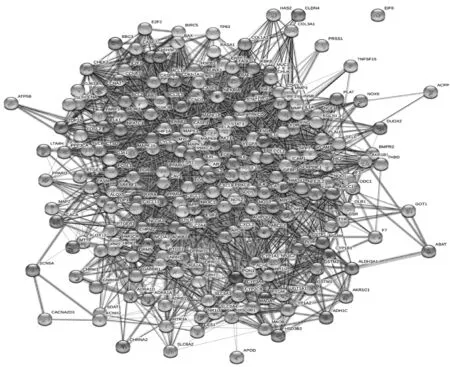
图中圆球表示靶点蛋白,连接线表示靶点蛋白间的相互作用关系the balls in the diagram indicate target proteins, and the connecting lines indicate the interactions between target proteins图2 凉膈散-ALI靶点蛋白PPI网络图Fig 2 Diagram of PPI network of Liangge Powder-ALI target proteins
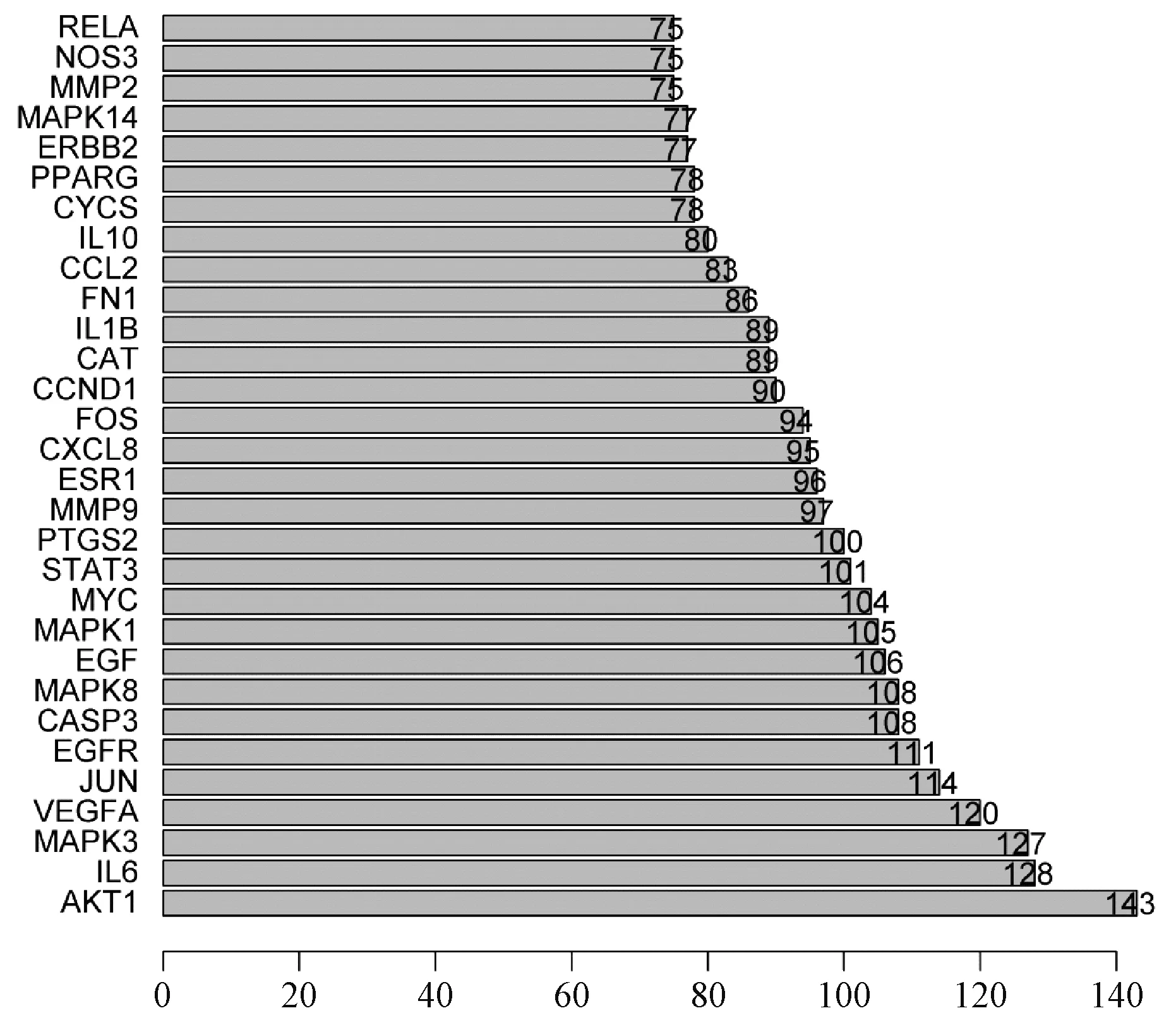
纵列为基因名,横列为相应基因连接数,如AKT1连接数为143the vertical column is gene name and the horizontal column is the corresponding gene linking number, e.g. the linking number of AKT1 is 143图3 凉膈散-ALI核心靶标的条形图Fig 3 Bar chart of Liangge Powder-ALI core targets
2.4 GO功能、KEGG通路富集分析
(1)GO条目共2 755个(P<0.05),其中生物过程条目2 433个(占 88.3%),细胞组成条目112个(占4.1%),分子功能条目210个(占7.6%),说明237个靶点主要富集到生物过程,包括氧化应激反应、脂多糖反应、细菌起源分子和营养水平等,富集的靶点数分别为58、57、57和57个。靶点数排序居前20位的条目见图5。(2)KEGG通路共182条通路(P<0.05),剔除疾病、广义通路后发现237个靶点在炎症免疫通路中富集明显,如PI3K-Akt、TNF、IL-17及MAPK等通路,其富集的靶点数均≥25个。靶点数排序居前20位的通路气泡图见图6。为了更加清晰地展示凉膈散治疗ALI的作用机制,将“凉膈散-ALI”共同靶点和KEGG主要通路输入Cytoscape,得到可视化靶点-通路网络,见图7。结果显示,1个靶点对应多条通路,1条通路涉及多个靶点,其中有28个靶点富集到10条以上信号通路,涉及靶点数≥40个的信号通路有4条,表明凉膈散是通过多靶点、多通路作用于ALI。
2.5 凉膈散核心活性化合物与IL-6、TNF-α、IL-1β和GSK-3β的分子对接结果
普遍认为,结合能越低,配体与受体越可能结合发挥作用,当两者结合能≤-5.0 kJ/mol时结合较好。将凉膈散核心活性化合物与IL-6(PDB:1P9M)、TNF-α(PDB:1NCF)、IL-1β(PDB:4DEP)和GSK-3β(PDB:1H8F)进行对接,相应结合能均≤-5.0 kJ/mol,说明凉膈散核心活性化合物与上述受体有较好的结合能力(见表1)。其中,与IL-6结合能较低的3个化合物为连翘苷、豆甾醇和光甘草定;与TNF-α结合能较低的3个化合物为连翘苷、豆甾醇和β-谷甾醇;与IL-1β结合能较低的3个化合物为连翘苷、豆甾醇和攀紫檀素;与GSK-3β结合能较低的3个化合物为连翘苷、豆甾醇和1-甲氧基菜青素。将目前临床使用的几种抗炎药与IL-6、TNF-α、IL-1β和GSK-3β受体进行分子对接,发现凉膈散核心化合物中连翘苷与上述4种受体的结合能均小于临床使用的几种抗炎药。连翘苷与4种受体对接模式见图8。

表1 凉膈散中核心化合物及目前临床常见抗炎药与IL-6、TNF-α、IL-1β和GSK-3β的结合能Tab 1 Binding energy of core components in Liangge Powder and clinically used anti-inflammatory drugs with IL-6, TNF-α, IL-1β and GSK-3β

图中正中4个圆环代表凉膈散-ALI共同靶标;其余代表凉膈散各单味中药的核心成分the four circles in the middle of diagram represent common target of Liangge Powder-ALI; the rest represent core components of each single flavour of Liangge Powder图4 “中药-化合物-靶点”相互作用网络图Fig 4 Interaction network of herbal-compound-target
3 讨论
凉膈散出自《太平惠民和剂局方》,是清上泻下治法的代表方。连翘清热解毒,黄芩清胸隔郁热,以为君;桅子通泻三焦,大黄和芒硝攻积泄热、逐瘀通经,三药共为臣;薄荷、竹叶疏散泻火、透热于外,皆为佐;甘草和诸药,是为使;全方上疏胸膈邪热,下通中焦滞热,清泄结合,用于上中二焦火热证候。著名中西医结合急救医学专家王今达[12]依据“肺与大肠相表里”理论,运用清上泻下、解毒排毒之法,以凉膈散治疗ALI/ARDS,80%的重症患者痊愈。凉膈散作为集清热解毒、通腑泻下两法为一体的经典方剂,其作用机制也是多重的。过往仅针对某一靶点或途径通过实验方法逐一筛选药物作用靶点与机制的研究方式存在盲目主观、费时低效且缺乏整体观的缺点,使得中医药的综合治疗作用难以得到诠释。利用网络药理学和分子对接技术对凉膈散治疗ALI进行系统的预测分析,从“成分-靶点-通路”的研究理念出发,可为凉膈散及其单体成分的开发应用提供参考。
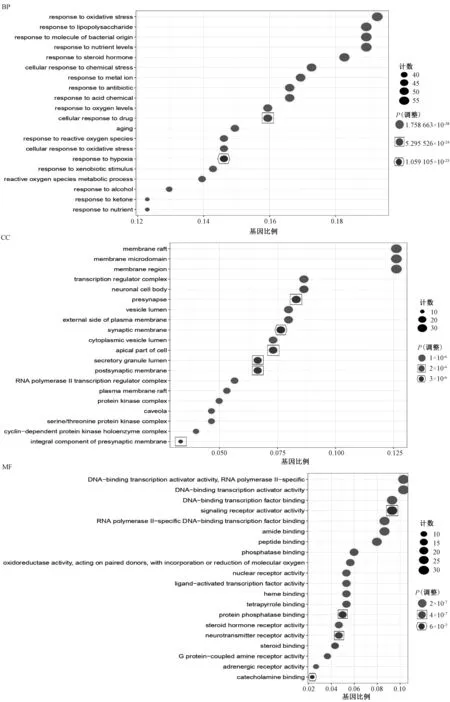
气泡大小表示基因数目,横列数字表示基因比例,不同气泡代表不同P值,富集程度越高则P值越小the size of bubble indicates the number of gene, the number in horizontal column indicates the proportion of genes, different bubbles represent different P-values, the higher the enrichment level the smaller the P-value图5 凉膈散-ALI关键靶点GO功能富集分析Fig 5 GO function enrichment analysis of key targets of Liangge Powder-ALI

气泡大小表示基因数目,横列数字表示基因比例,不同气泡代表不同P值,富集程度越高则P值越小the size of bubble indicates the number of gene, the number in horizontal column indicates the proportion of genes, different bubbles represent different P-values, the higher the enrichment level the smaller the P-value图6 凉膈散-ALI关键靶点KEGG通路富集分析Fig 6 KEGG pathway enrichment analysis of key targets of Liangge Powder-ALI
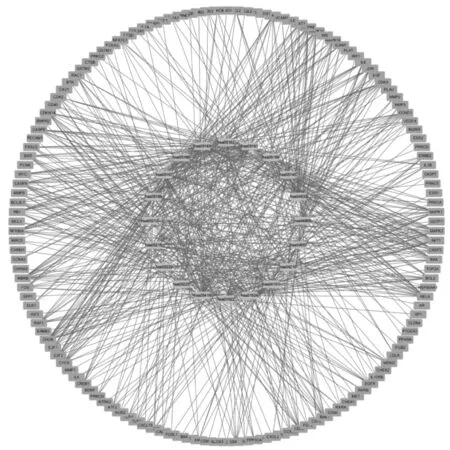
大圆环代表化合物与疾病共同靶点,小圆环代表前20位信号通路Large circles represent common targets of compounds and diseases, small circles represent top 20 signaling pathways图7 靶点-通路相互作用网络图Fig 7 Network of interaction of target-pathway
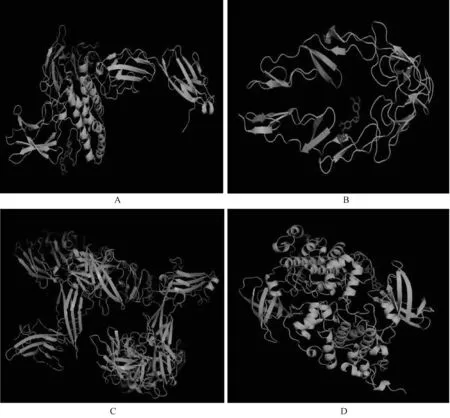
A.连翘苷与IL-6受体对接模式;B.连翘苷与TNF-α受体对接模式;C.连翘苷与IL-1β受体对接模式;D.连翘苷与GSK-3β受体对接模式A.molecular docking patterns of phillyrin with IL-6;B.molecular docking patterns of phillyrin with TNF-α;C.molecular docking patterns of phillyrin with IL-1β;D.molecular docking patterns of phillyrin with GSK-3β图8 连翘苷分别与IL-6、TNF-α、IL-1β和GSK-3β的分子对接模式Fig 8 Molecular docking patterns of phillyrin with IL-6, TNF-α, IL-1β and GSK-3β
通过网络药理学技术从TCMSP中得到凉膈散活性化合物173个,相对应靶点263个,其中90.34%的活性化合物极易被小肠吸收,说明凉膈散适合作为口服药物使用;90.11%的作用靶点与ALI有关,揭示凉膈散治疗ALI的合理性、有效性。在PPI网络、靶点-通路网络中占据中心位置的靶点AKT1、IL-6等在ALI发生发展中具有重要作用,可能是凉膈散治疗ALI的核心靶点。AKT1属于AKT激酶家族,由PI3K激活,活化的AKT磷酸化下游靶蛋白GSK-3β、IKKα及Tpl2等调控NF-κB信号转导,进而调节机体炎症免疫反应、细胞凋亡、肺泡凝血和纤溶等[10-11]。IL-6是细胞因子风暴的核心炎症因子,是急性感染和炎症损伤的早期灵敏指标。“中药-化合物-靶点”相互作用网络显示,槲皮素、山柰酚、木犀草素、柚皮素和汉黄连素存在于凉膈散的多个单味药中,其相应的连接核心靶点数排序居前10位,且均已被证实与抗炎、抗菌及免疫调节等密切相关,是该方的核心成分[13-16]。GO功能富集分析发现核心靶点主要富集生物过程,KEGG通路富集分析发现PI3K-Akt、TNF和IL-17等多条炎症免疫信号通路富集明显,而阻断这些信号通路可明显抑制细胞因子风暴,减轻ALI[17-19]。从分子对接分析结果可知,核心化合物与IL-6、TNF-α、IL-1β和GSK-3β受体的结合能均远<-5.0 kJ/mol,其中,连翘中的连翘苷结合能比临床常用强抗炎药地塞米松还低,说明连翘苷与上述受体均有较好的结合活性。
综上所述,本研究应用网络药理学与分子对接技术,首次对温病治疗名方凉膈散治疗ALI的活性成分与分子机制进行了系统的预测,推测其潜在机制为:凉膈散活性成分一方面抑制GSK-3β活性,减少NF-κB p65活化,下调促炎因子表达,同时增加CREB和AP-1转录,上调抗炎因子表达,维持体内促炎与抗炎平衡,从而减轻机体炎症损伤;另一方面竞争性地与IL-6、TNF-α和IL-1β受体结合,减少IL-6、TNF-α和IL-1β释放,进而抑制细胞因子风暴,避免炎症级联反应对肺部的进一步损伤,改善ALI的临床症状。

