大豆蚜Kazal型丝氨酸蛋白酶抑制剂基因AgKaSPI对蜡蚧刺束梗孢菌侵染的表达响应
陈雅茹, 杨洪佳, 李 泽, 车进明,2, 王泽群, 樊 东,*
(1. 东北农业大学农学院, 哈尔滨 150030; 2. 桂应祥沙里院农业大学, 朝鲜平壤 95003)
在节肢动物中,丝氨酸蛋白酶(serine protease)及其同源蛋白是蛋白酶中的一个超家族,其成员包括胰蛋白酶、胰凝乳蛋白酶和弹性蛋白酶,数量占全部蛋白酶的2/3,这些蛋白酶都是维持生物体正常生命活动不可或缺的,且受丝氨酸蛋白酶抑制剂(serine proteinase inhibitor, SPI)的严格调控(赵丽芳等, 2016)。Kazal型SPI(Kazal-type serine proteinase inhibitor, KaSPI)是最为保守的一类,其广泛的生物学功能使其成为当今的研究热点(van Hoefetal., 2013)。在黑腹果蝇Drosophilamelanogaster(Niimietal., 1999)、大锥蝽Panstrongylusmegistus(Meiseretal., 2010)、东方蜜蜂Apiscerana(Kimetal., 2013)、埃及伊蚊Aedesaegypti(Torquatoetal., 2017)等30余种昆虫中发现了KaSPI,主要作用于对丝氨酸蛋白酶的调节,从而影响昆虫正常的生长发育(Gubbetal., 2010)。如在家蚕Bombyxmori丝腺中的包含3个Kazal结构域的BmKaSPI能有效抑制枯草杆菌蛋白酶,推测其在家蚕抵抗病原体入侵方面发挥着重要作用(Zhengetal., 2007);从丽蝇蛹集金小蜂Nasoniavitripennis毒液中克隆获得两个Kazal类丝氨酸蛋白酶抑制剂基因NvKSPI-1和NvKSPI-2。NvkSPI-1能抑制胰蛋白酶的活性,而NvKSPI-2对胰凝乳蛋白酶、胰蛋白酶和蛋白酶K 3种丝氨酸酶的活性均无影响(Qianetal., 2015)。来自蜜蜂毒液的Kazal型丝氨酸蛋白酶抑制剂不仅抑制枯草杆菌蛋白酶A和枯草杆菌蛋白酶K,而且还表现出对革兰氏阳性细菌和真菌的抗菌活性(Yangetal., 2017)。在其他昆虫中,KaSPIs还有助于保护昆虫免受微生物蛋白酶或宿主消化蛋白酶的侵害,同时还参与食物消化、凝血、抑菌作用以及先天免疫反应(Soaresetal., 2015; Gonellaetal., 2019)。
大豆蚜Aphisglycines隶属于半翅目蚜科(Aphididae),与其他昆虫不同,蚜虫基因组缺失大量的免疫相关基因(Gerardoetal., 2010)。尽管如此,蚜虫的免疫系统仍能够有效地对抗病原菌的入侵(Parkeretal., 2017)。为深入揭示丝氨酸蛋白酶抑制剂KaSPI在病原真菌侵染大豆蚜过程中的作用,本研究克隆了大豆蚜KaSPI基因cDNA的序列,对该基因进行RNAi后利用蜡蚧刺束梗孢菌Akanthomyceslecanii(简称蜡蚧菌)侵染大豆蚜,以探究KaSPI在昆虫病原真菌侵染大豆蚜中的作用,为进一步利用KaSPI通过生物技术手段防治害虫奠定基础。
1 材料与方法
1.1 供试材料
供试昆虫:本实验所用大豆蚜来源于东北农业大学向阳实验示范基地。以盆栽大豆苗(黑农54)为寄主,在无任何杀虫剂接触的条件下置于人工气候箱中培养,温度为25±2℃,相对湿度为70%±5%,光周期为14L∶10D。每隔一周接到新的大豆叶片上。
供试菌株:蜡蚧刺束梗孢菌(菌种编号BNCC336750)购自北纳创联生物技术有限公司。购买的冻干菌粉经复苏,在PDA培养基上活化1~2代,接种于PDA培养基上,置于25℃恒温箱中培养7 d,待菌株充分产孢后保存于4℃冰箱中,备用。
1.2 Kazal型丝氨酸蛋白酶抑制剂基因的克隆及氨基酸序列分析
在无菌操作台中分别收集未接触任何药剂的1-4龄大豆蚜若虫和成虫于1.5 mL EP管中,提取RNA,按ReverTra Ace qPCR RT Kit试剂盒进行反转录合成cDNA,由安诺优达基因科技有限公司进行转录组测序。在转录组数据库中筛选出大豆蚜Kazal型丝氨酸蛋白酶抑制剂基因AgKaSPI,在NCBI(https:∥blast.ncbi.nlm.nih.gov/Blast.cgi)上进行同源性比对后,利用Primer Premier 5.0设计全长序列引物AgKaSPI-Full-F/AgKaSPI-Full-R(表1),进行PCR扩增,反应体系(25 μL): 10×Easy Taq Buffer 2.5 μL, 大豆蚜成虫cDNA 0.5 μL, 上下游引物(10 umol/L)各1 μL, High Pure dNTPs 2.5 μL, Easy Taq DNA Polymerase 0.5 μL, ddH2O 17 μL。反应条件: 94℃预变性5 min; 94℃变性30 s, 50℃退火30 s, 72℃延伸4 min, 35个循环;最后72℃保存10 min。将产物进行胶回收,由哈尔滨新海基因检测有限公司测序后与转录组测序获得的基因进行对比,对克隆得到的AgKaSPI基因序列进行准确性校对。利用DNAMAN软件预测AgKaSPI开放阅读框并翻译成氨基酸序列。利用ExPASy网站(http:∥ca.expasy.org/tools/)的compute pI/Mw工具软件预测氨基酸的等电点和分子量,利用Signal P 4.1Server预测信号肽。利用SMART在线网站(http:∥smart.embl-heidelberg.de/)预测氨基酸序列的结构域;在NCBI网站搜索昆虫KaSPI氨基酸序列,利用MEGA 5.1软件中邻接(neighbor-joining)法构建系统进化树。
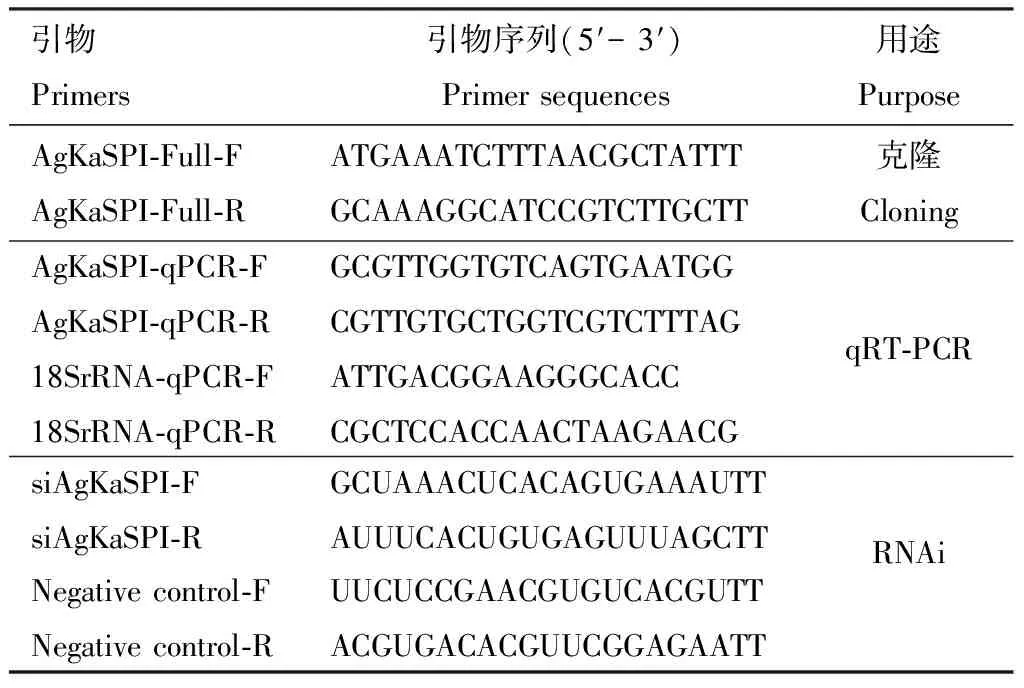
表1 引物信息Table 1 Primer information
1.3 AgKaSPI基因在大豆蚜不同龄期的表达模式分析
分别选取大豆蚜1-4龄若虫和成虫,30头个体为一个生物学重复,设3个生物学重复。利用TRIzol法提取大豆蚜总RNA,每100 mg组织加入1 mL TRIzol®Reagent。提取的总RNA用紫外分光光度检测,用1%琼脂糖凝胶电泳鉴定RNA的纯度和浓度,检测合格后放入-80℃冰箱备用。取4 μg总RNA,按照ReverTra Ace qPCR RT Kit试剂盒进行反转录,合成cDNA第1链,-20℃保存。
根据1.2节克隆的AgKaSPIcDNA序列和内参基因18S rRNA基因(Bansaletal., 2012)设计qRT-PCR引物AgKaSPI-qPCR-F/AgKaSPI-qPCR-R和18SrRNA-qPCR-F/18SrRNA-qPCR-R(表1),大豆蚜不同发育阶段的cDNA作为模板进行qRT-PCR,用荧光染料SYBR Primer Script RT-PCR Kit Mix(TOYOBO,日本)在Bio-Rad荧光定量PCR仪通过三步法进行qRT-PCR,反应体系(20 μL): SYBR qPCR Mix 10 μL, 上下游引物(10 pmol/μL)各0.6 μL, cDNA 2 μL, ddH2O 6.8 μL。反应程序: 94℃ 1 min; 95℃ 30 s, 59℃ 30 s, 72℃ 30 s, 40个循环。每发育阶段3个生物学重复。
1.4 蜡蚧刺束梗孢菌侵染及AgKaSPI表达响应测定
供试孢子液的配制:收集1.1节已经在PDA培养基培养好的蜡蚧刺束梗孢菌分生孢子,经过滤后,用含0.1%吐温80的无菌水分别配成1×108, 1×107, 1×106, 1×105和1×104孢子/mL的孢子悬浮液各50 mL备用,含0.1%吐温80的无菌水作空白对照,采用浸渍法(Feng and Johnson, 1991)处理大豆蚜成虫。连续观察7 d,计算LC50,以此浓度浸渍法处理大豆蚜成虫3, 6, 12, 24, 48和72 h,以含0.1%吐温80的水溶液处理为对照,每个时间点取30头大豆蚜为一个生生物学重复,设3个生物学重复,在液氮中快速冷冻并置于-80℃冰箱中保存备用。qRT-PCR(反应体系与条件同1.3节,下同)检测大豆蚜经蜡蚧刺束梗孢菌侵染大豆蚜处理不同时间点AgKaSPI的表达,引物序列见表1。
1.5 AgKaSPI的RNAi
使用的AgKaSPI的siRNA(siAgKaSPI)和阴性对照(negative control, NC)siRNA(siNC)均是长度为21~23 bp的一段序列,由上海吉玛公司设计并合成,均稀释成浓度为20 μmol/L备用,阴性对照是与靶基因无同源性且在大豆蚜体内没有生物学效应的基因序列,引物序列见表1。基于预试验结果,将纳米载体SPc(由中国农业大学植物保护学院昆虫学系沈杰教授课题组提供)和siRNA以1∶1的体积比混合,然后加入总体积10%的洗涤剂(购自立白集团, 广州)到混合液中,涡旋震荡2~3次,室温孵育30 min,使其充分结合形成稳定的复合体;取健康大豆蚜成虫置于光学显微镜下,用显微注射器吸取0.1 μL siRNA/SPc/洗涤剂复合体溶液,缓缓推出液滴,靠近大豆蚜背部,使液滴在表面活性剂作用下贴附于大豆蚜体壁表面,静置10 min,对照组滴加等量的siNC。分别在处理3, 6, 12, 24和48 h时收集30头大豆蚜成虫置于1.5 mL EP管中,每处理3次重复,液氮速冻后置于-80℃冰箱中保存备用。通过qRT-PCR检测不同时间的RNAi干扰效率,并记录RNAi 12, 24, 48和96 h后的大豆蚜成虫死亡数和产蚜量。
1.6 AgKaSPI蛋白含量测定
取1.4节蜡蚧刺束梗孢菌处理3, 6, 12, 24, 48和72 h及相应对照的大豆蚜成虫,以及1.5节siAgKaSPI及siNC阴性对照处理3, 6, 12, 24和48 h的大豆蚜成虫置于玻璃匀浆器中研磨5 min,在4℃条件下4 500 r/min离心15 min,收集上清液,即为待测酶液,备用。利用昆虫Kazal型丝氨酸蛋白酶抑制剂酶联免疫分析(ELISA)试剂盒(江苏酶标生物科技有限公司),采用双抗体夹心法测定蜡蚧刺束梗孢菌侵染和RNAi后大豆蚜体内AgKaSPI蛋白含量的变化,具体操作见说明书。每处理3个生物学重复,每样品测定3次技术重复。
1.7 丝氨酸蛋白酶活性的测定
取1.4节蜡蚧刺束梗孢菌和对照处理3, 6, 12, 24, 48和72 h的大豆蚜成虫,以及1.5节siAgKaSPI和siNC阴性对照处理 3, 6, 12, 24和48 h的大豆蚜成虫,利用昆虫丝氨酸蛋白酶(serine protease)、胰蛋白酶(trypsin)、胰凝乳蛋白酶(chymotrypsin)酶联免疫分析(ELISA)试剂盒(江苏酶标生物科技有限公司),采用双抗体夹心法分别测定丝氨酸蛋白酶、胰蛋白酶和胰凝乳蛋白酶的活性变化,具体操作见说明书,每处理3个生物学重复,每样品测定3次技术重复。待测样品的总蛋白质含量参照Bradford(1976)描述的考马斯亮蓝G-250染色法测定。样品折算酶活力=样品实际酶活力/样品的总蛋白质含量,以样品折算酶活力作为结果中样品的酶活性。
1.8 RNAi后大豆蚜对蜡蚧刺束梗孢菌的敏感性变化测定
取1.5节siAgKaSPI处理6 h的30头大豆蚜成虫,用LC50浓度的蜡蚧刺束梗孢菌的孢子悬浮液,通过浸渍法处理存活的蚜虫,方法同1.4节,12, 24, 48和96 h后观察并记录死亡情况。试验重复3次。
1.9 数据分析
采用2-ΔΔCt法(Livak and Schmittgen, 2001)计算基因的相对表达量。利用SAS 9.0软件单因素方差分析Duncan氏多重比较法进行各处理下不同时间点基因的相对表达量以及酶活性差异显著性分析,死亡率的差异显著性采用t检验法来分析,显著性水平设置为P<0.05。数值计算及图表制作利用Excel 2010进行。
2 结果
2.1 AgKaSPI基因序列特征
本实验经在大豆蚜转录组数据库中搜索、NCBI比对、保守结构域的查找及序列准确性校正,筛选出1条Kazal型丝氨酸蛋白酶抑制剂基因AgKaSPI的cDNA序列(GenBank登录号: MK440557),长1 019 bp,开放阅读框为324 bp,编码107个氨基酸,含有197 bp的5′非编码区和498 bp的3′非编码区,N端含有21个氨基酸组成的信号肽。ExPASy分析所得氨基酸序列的蛋白质分子量为11.43 kD,等电点为9.24。通过SMART在线软件对其结构域进行预测,发现AgKaSPI蛋白含有一个典型的Kazal结构域,该结构域具有6个半胱氨酸残基(图1)以特定模式(CysI-CysV, CysII-CysIV和CysIII-CysVI)形成3个二硫键,从而形成紧密的三维构象。

图1 大豆蚜AgKaSPI基因cDNA序列及推导的氨基酸序列Fig. 1 cDNA and deduced amino acid sequences of AgKaSPI of Aphis glycines起始密码子ATG和终止密码子TAA用方框标注,信号肽序列用双下划线标注,保守半胱氨酸残基加方框用灰色阴影标注。The start codon (ATG) and stop codon (TAA) are boxed. The signal peptides are double underlined. Conserved cysteine residues are indicated by gray shade.
2.2 AgKaSPI与其他昆虫KaSPI氨基酸序列比对及系统进化关系
将AgKaSPI的氨基酸序列在NCBI中搜索,与获得的其他昆虫的KaSPI氨基酸序列构建系统发育树(图2),AgKaSPI与同属半翅目蚜科的昆虫棉蚜Aphisgossypii的ApKaSPI (GenBank登录号: XP_027843052)、苜蓿蚜Aphiscraccivora的AcKaSPI (GenBank登录号: KAF0767270)、豌豆蚜Acyrthosiphonpisum的ApKaSPI (GenBank登录号: NP_001156573)和高粱蚜Melanaphissacchari的MsKaSPI (GenBank登录号: XP_025194394)等亲缘关系较近,与其他目昆虫如柞蚕Antheraeapernyi的ApKaSPI (GenBank登录号: AHZ90949)、家蚕Bombyxmori的BmKaSPI (GenBank登录号: NP_001040250)和埃及伊蚊Aedesaegypti的AaKaSPI (GenBank登录号: XP_001658905)等亲缘关系较远,昆虫Kazal型丝氨酸蛋白酶抑制剂之间的系统进化关系与形态特征的系统进化关系具有一定的相关性。
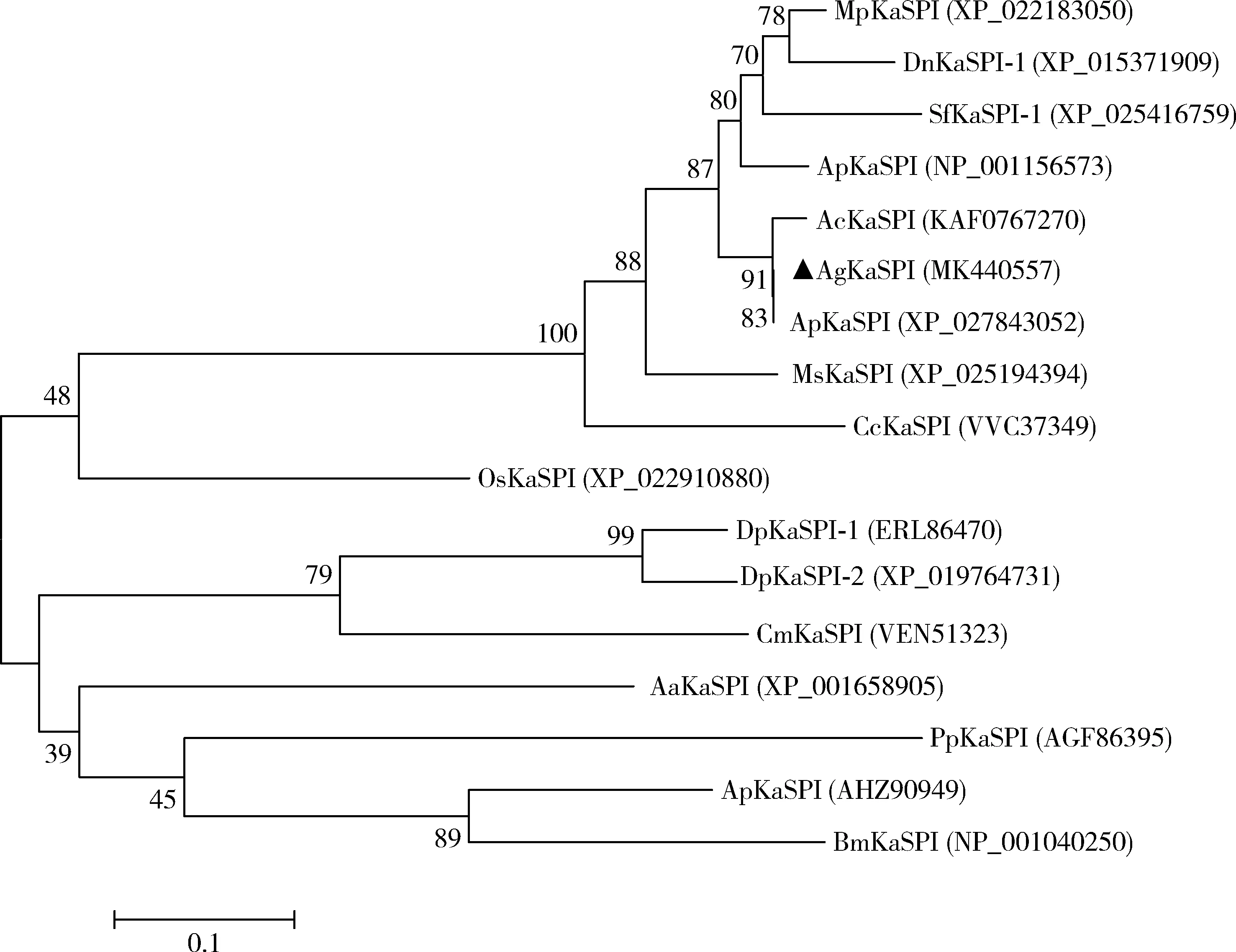
图2 邻接法构建的基于氨基酸序列的大豆蚜与其他昆虫KaSPI的系统进化树(1 000次重复)Fig. 2 Phylogenetic tree of KaSPI proteins from Aphis glycines and other insectsby neighbor-joining method based on amino acid sequence (1 000 replicates)KaSPI蛋白来源物种Origin species of KaSPI proteins: MpKaSPI: 桃蚜Myzus persicae; DnKaSPI-1: 麦双尾蚜Diuraphis noxia; SfKaSPI-1: 甘蔗黄蚜Sipha flava; ApKaSPI: 豌豆蚜Acyrthosiphon pisum; AcKaSPI: 苜蓿蚜Aphis craccivora; AgKaSPI: 大豆蚜Aphis glycines; ApKaSPI: 棉蚜Aphis gossypii; MsKaSPI: 高粱蚜Melanaphis sacchari; CcKaSPI: 雪松长足大蚜Cinara cedri; OsKaSPI: 牛头嗡蜣螂Onthophagus taurus; DpKaSPI-1, DpKaSPI-2: 中欧山松大小蠹Dendroctonus ponderosae; CmKaSPI: 四纹豆象Callosobruchus maculatus; AaKaSPI: 埃及伊蚊Aedes aegypti; PpKaSPI: 静食白蛉Phlebotomus papatasi; ApKaSPI: 柞蚕Antheraea pernyi; BmKaSPI: 家蚕Bombyx mori.
2.3 AgKaSPI在大豆蚜不同发育阶段的表达
利用qRT-PCR检测大豆蚜1-4龄若虫以及成虫体内AgKaSPI的表达水平,结果表明该基因在大豆蚜不同发育阶段皆有表达,在1龄若虫体内的表达量最高,分别为其在2-4龄若虫体内表达量的1.90, 2.37和2.12倍(P<0.05),但与在成虫体内的表达量差异不显著(P>0.05)(图3)。
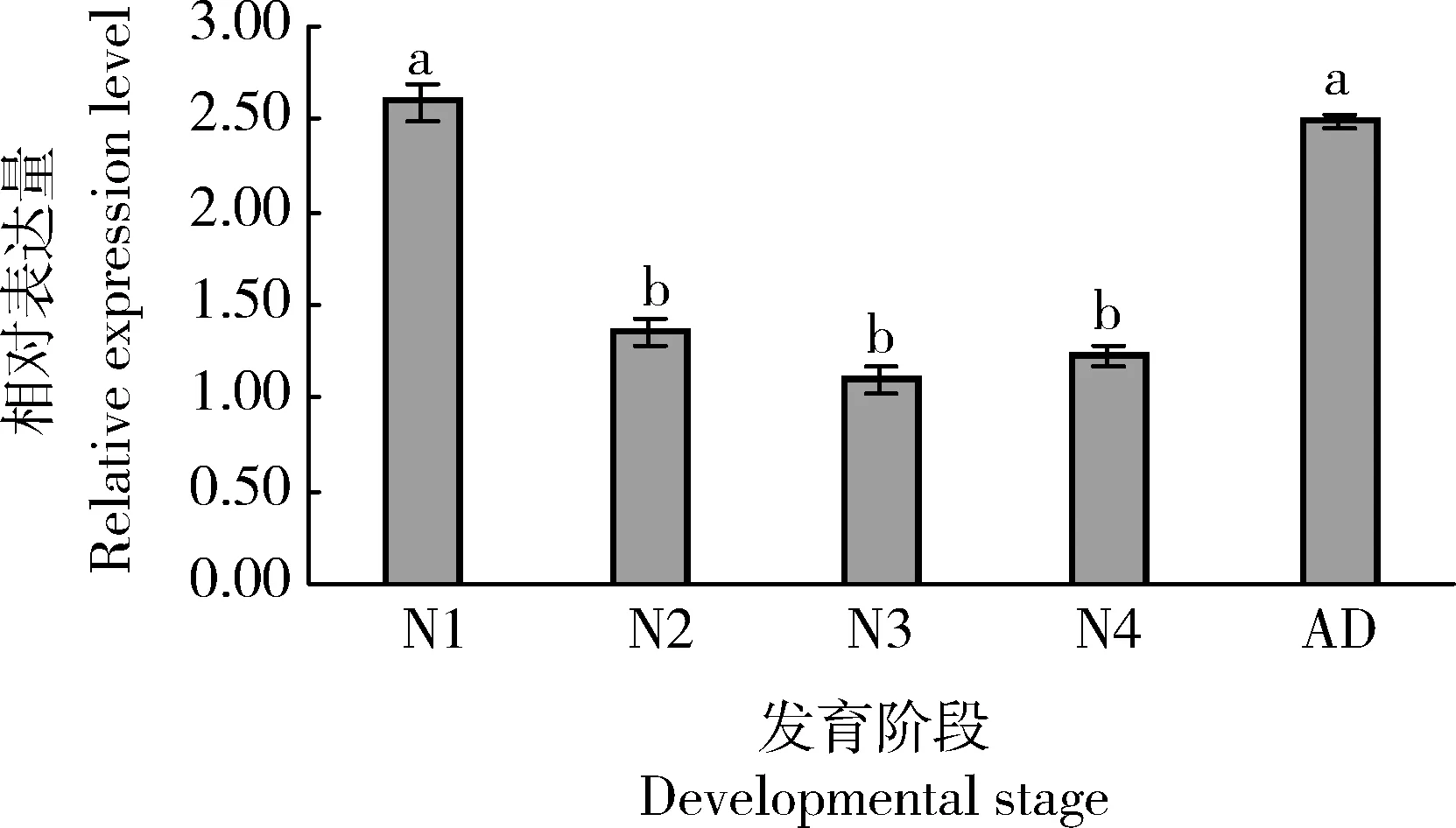
图3 AgKaSPI在大豆蚜不同发育阶段的相对表达量Fig. 3 Relative expression levels of AgKaSPI at differentdevelopmental stages of Aphis glycinesN1-N4: 分别为1-4龄若虫1st-4th instar nymphs, respectively; AD: 成虫Adult. 图中数据为平均值±标准误;柱上不同小写字母表示基因表达量在不同发育阶段间差异显著(P<0.05, Duncan氏多重比较法)。Data in the figure are means±SE. Different lowercase letters above bars indicate significant difference in the gene expression level at different developmental stages (P<0.05, Duncan’s multiple range test).
2.4 蜡蚧刺束梗孢菌侵染大豆蚜对AgKaSPI表达的影响
通过预实验蜡蚧刺束梗孢菌对大豆蚜室内毒力测定得到的LC50(4.05×106孢子/mL)的孢子悬浮液侵染大豆蚜成虫,qRT-PCR检测大豆蚜感染72 h内AgKaSPI的表达水平呈现先升高后降低的趋势,侵染12, 24和48 h时,AgKaSPI表达量显著上调(P<0.05),分别为对照组的2.23, 4.31和2.38倍(图4),说明蜡蚧刺束梗孢菌侵染诱导了AgKaSPI的表达。
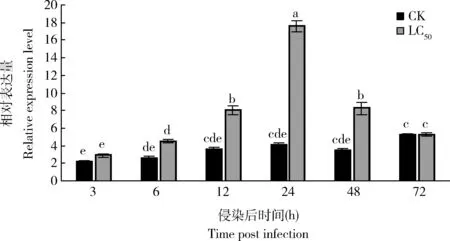
图4 蜡蚧刺束梗孢菌侵染大豆蚜成虫后AgKaSPI的表达量Fig. 4 Expression levels of AgKaSPI in Aphis glycines adults after infection by Akanthomyces lecanii用对大豆蚜成虫LC50为4.05×106孢子/mL的孢子悬浮液进行侵染,含0.1%吐温80的无菌水作空白对照(CK)。图中数据为平均值±标准误;柱上不同小写字母表示基因表达量在不同处理时间点间差异显著(P<0.05, Duncan氏多重比较法)。下图同。The spore suspension with the LC50 value of 4.05×106 spores/mL against A. glycines adults was used for infection, and sterile water containing 0.1% Tween 80 was used as the blank control (CK). Data in the figure are means±SE. Different lowercase letters above bars indicate significant difference in the gene expression level among different treatment time points (P<0.05, Duncan’s multiple range test). The same for the following figures.
如图5所示,经蜡蚧刺束梗孢菌侵染12, 24和48 h时大豆蚜AgKaSPI蛋白含量与对照组差异均显著(P<0.05),分别为对照组的2.20, 1.69和1.98倍,但经蜡蚧刺束梗孢菌侵染72 h时与对照组蛋白含量差异不显著(P>0.05)。可见该基因可能通过调节丝氨酸蛋白酶抑制剂的含量来参与大豆蚜对蜡蚧刺束梗孢菌的免疫应答。
2.5 蜡蚧刺束梗孢菌侵染对大豆蚜成虫体内丝氨酸蛋白酶活性的影响
蜡蚧刺束梗孢菌侵染后大豆蚜成虫体内丝氨酸蛋白酶(图6: A)、胰蛋白酶(图6: B)和胰凝乳蛋白酶(图6: C)活性总体均呈先降低再升高的趋势。侵染12, 24和48 h时,丝氨酸蛋白酶、胰蛋白酶和胰凝乳蛋白酶活性显著下降(P<0.05);侵染72 h时酶活力增强,但与对照差异不显著(P>0.05)。结合图5和图6可知,蜡蚧菌可能通过短期诱导AgKaSPI蛋白的过表达抑制了大豆蚜体内丝氨酸蛋白酶的活性。
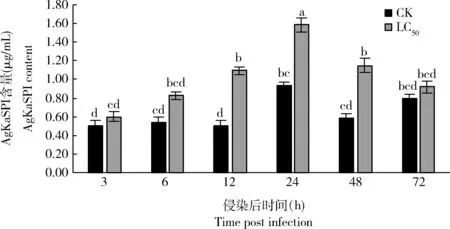
图5 蜡蚧刺束梗孢菌侵染对大豆蚜成虫体内AgKaSPI蛋白含量的影响Fig. 5 Effects of Akanthomyces lecanii infection on the AgKaSPI content in Aphis glycines adults
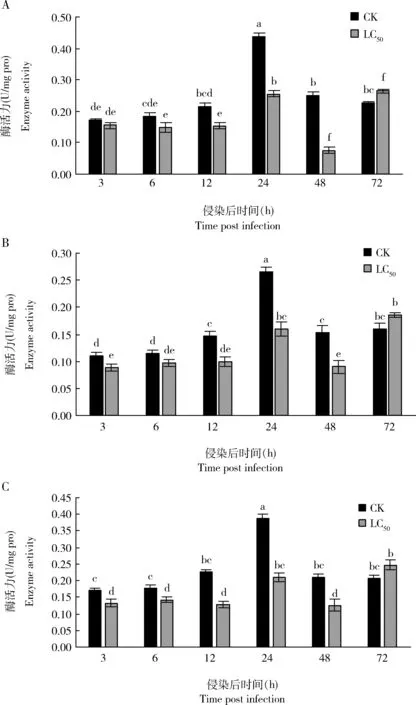
图6 蜡蚧刺束梗孢菌侵染对大豆蚜成虫丝氨酸蛋白酶(A)、胰蛋白酶(B)和胰凝乳蛋白酶(C)活性的影响Fig. 6 Effects of Akanthomyces lecanii infection on the activities of serine proteinase (A),trypsin (B) and chymotrypsin (C) in Aphis glycines adults
2.6 AgKaSPI的RNAi效果
RNAi后,AgKaSPI基因被成功沉默,AgKaSPI表达量在干扰6, 12和48 h时均有不同程度的下降,表达量分别下降了71.05%, 36.22%和21.05%,且6和12 h时与对照组相比差异均显著(P<0.05)(图7)。
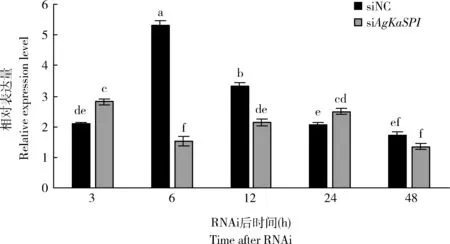
图7 RNAi对大豆蚜成虫体内AgKaSPI表达的影响Fig. 7 Effects of RNAi on the expression of AgKaSPI in Aphis glycines adultsNC: 阴性对照Negative control. 下同The same below.
RNAi干扰AgKaSPI24, 48和96 h时大豆蚜成虫死亡率处理组与阴性对照组相比差异均显著(P<0.05)(表2),分别增加了5.11%, 8.02%和10.12%。表明AgKaSPI干扰对大豆蚜具有一定的致死效应。
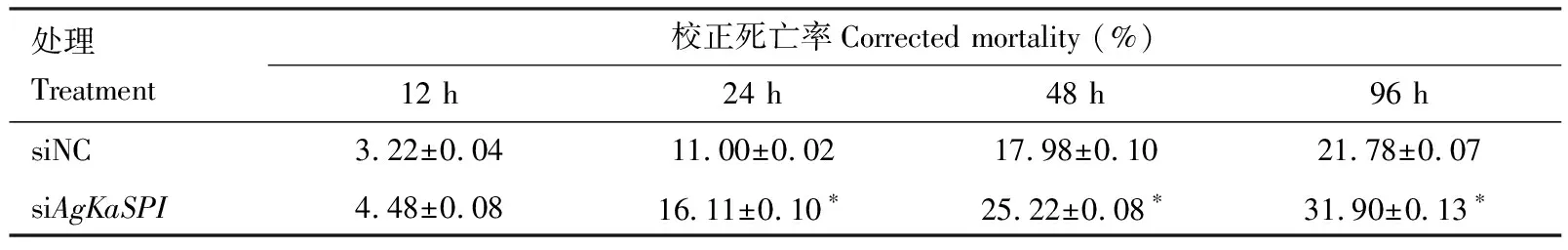
表2 RNAi干扰AgKaSPI后不同时间大豆蚜成虫的校正死亡率Table 2 Corrected mortality of Aphis glycines adults at different time after RNAi of AgKaSPI
RNAi干扰AgKaSPI24, 48和96 h时对照组大豆蚜每百头产蚜量分别为449±38, 505±48和749±74头,处理组分别为400±45, 476±60,和708±78头,24和96 h时处理组均显著低于对照组(P<0.05),说明AgKaSPI沉默对大豆蚜的繁殖具有一定的影响(图8)。
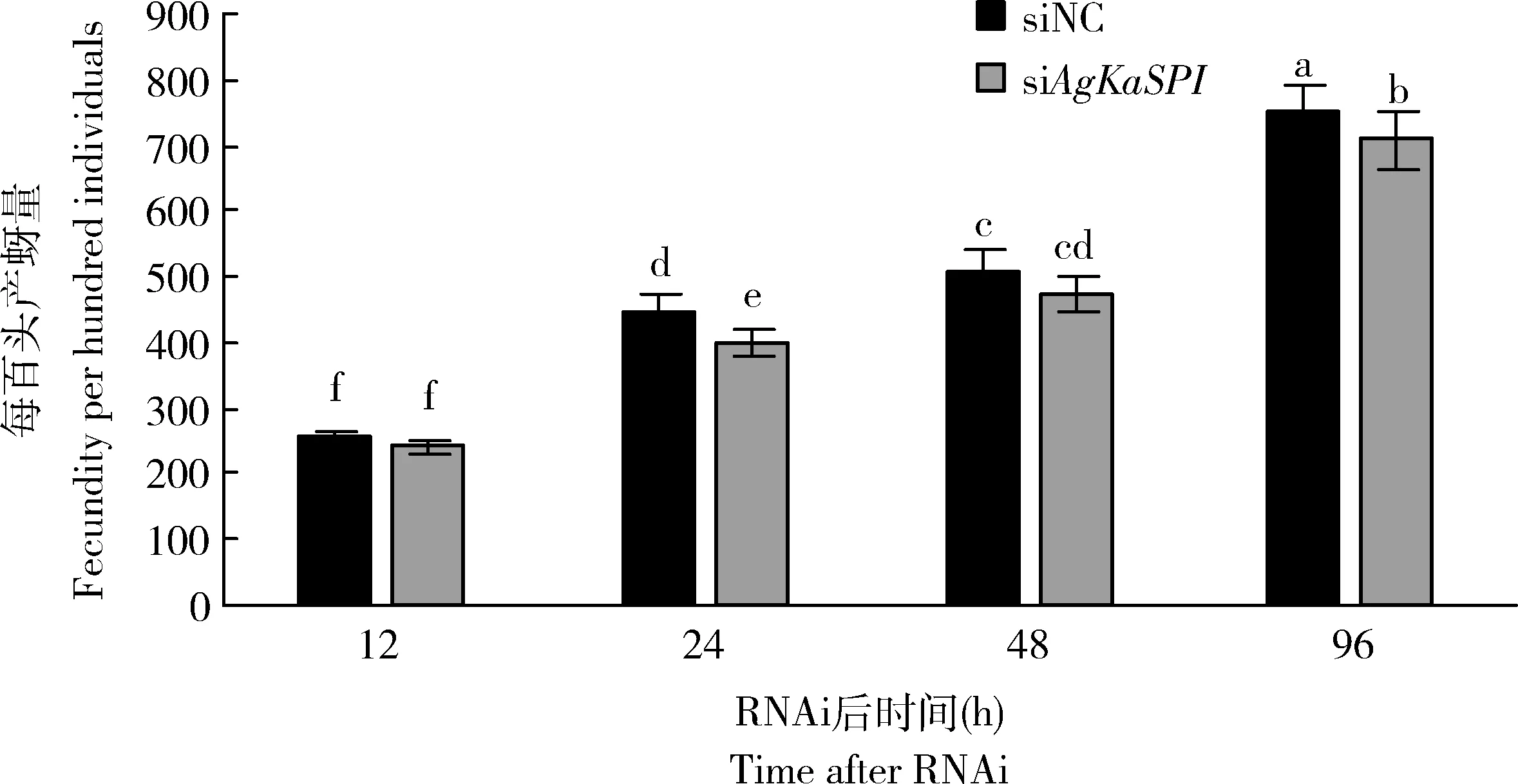
图8 AgKaSPI的RNAi对大豆蚜产蚜量的影响Fig. 8 Effects of RNAi of AgKaSPI on the fecundity of Aphis glycines
为进一步研究AgKaSPI在大豆蚜相应蜡蚧刺束梗孢菌侵染的代谢中的作用,用双抗体夹心法检测了RNAi干扰AgKaSPI3, 6, 12, 24和48 h时大豆蚜成虫体内AgKaSPI蛋白含量的变化。如图9所示,RNAi干扰不同时间点,AgKaSPI蛋白含量均有不同程度的减少,12和24 h时AgKaSPI蛋白含量与对照组相比差异显著(P<0.05),AgKaSPI蛋白含量分别下降了51.11%和44.52%。
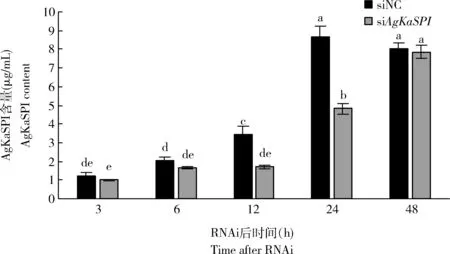
图9 RNAi干扰AgKaSPI对大豆蚜成虫体内AgKaSPI蛋白含量的影响Fig. 9 Effects of RNAi of AgKaSPI on the AgKaSPI content in Aphis glycines adults
2.7 干扰AgKaSPI对大豆蚜成虫体内丝氨酸蛋白酶活性的影响
干扰AgKaSPI后丝氨酸蛋白酶(图10: A)、胰蛋白酶(图10: B)和胰凝乳蛋白酶(图10: C)活性总体呈先升高再降低趋势。干扰12 h时,丝氨酸蛋白酶和胰凝乳蛋白酶活性开始增加,干扰24 h时,丝氨酸蛋白酶、胰蛋白酶和胰凝乳蛋白酶活性显著增强。通过AgKaSPI沉默减少丝氨酸蛋白酶抑制剂的含量可增强大豆蚜丝氨酸蛋白酶、胰蛋白酶和胰凝乳蛋白酶的活性,说明AgKaSPI可能通过调节丝氨酸蛋白酶抑制剂的含量对丝氨酸蛋白酶进行有效的调控。
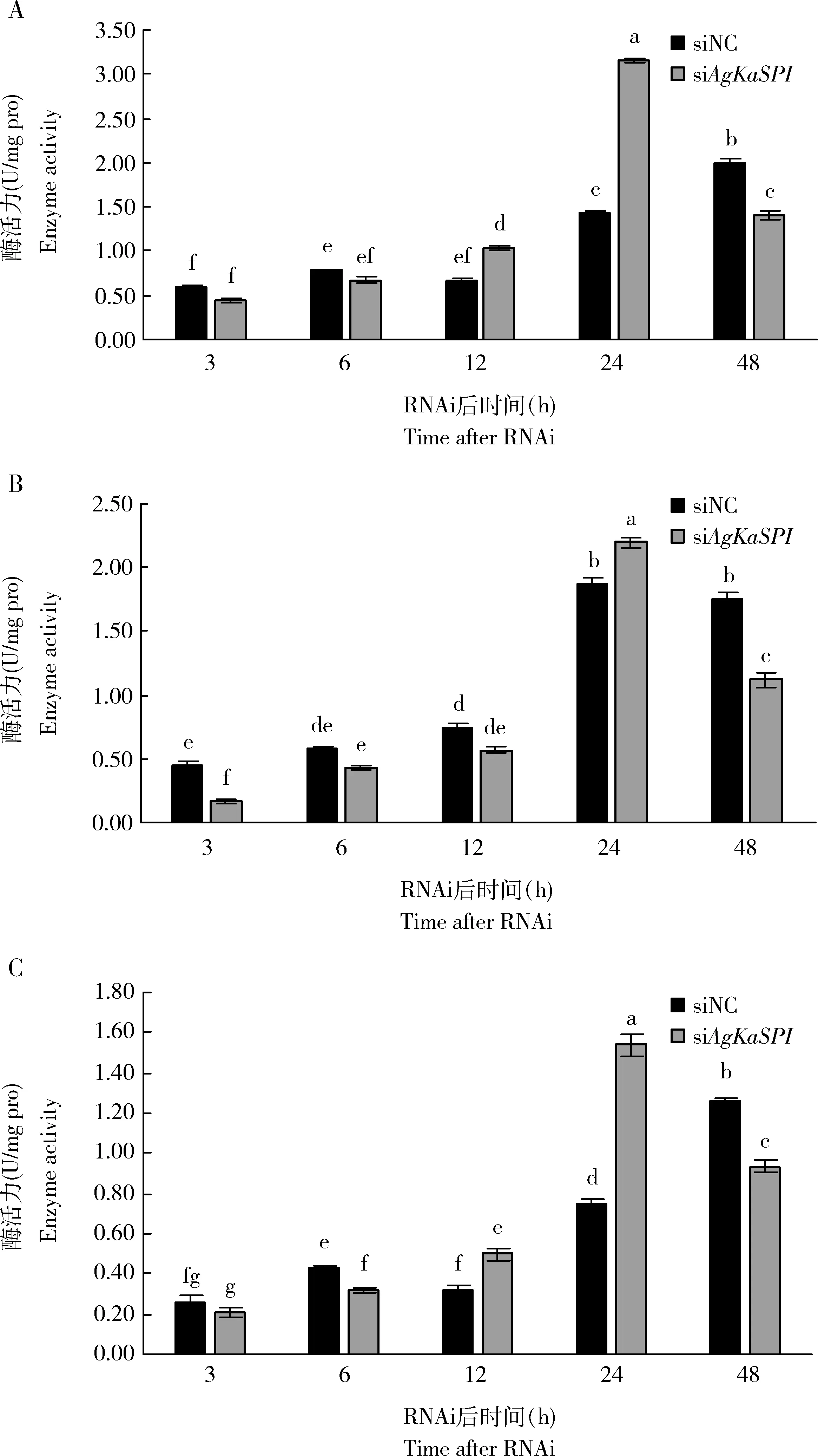
图10 RNAi干扰AgKaSPI对大豆蚜成虫体内丝氨酸蛋白酶(A)、胰蛋白酶(B)和胰凝乳蛋白酶(C)活性的影响Fig. 10 Effects of RNAi of AgKaSPI on the activities of serine proteinase (A),trypsin (B) and chymotrypsin (C) in Aphis glycines adults
2.8 AgKaSPI沉默对大豆蚜对蜡蚧刺束梗孢菌敏感性的影响
AgKaSPI沉默后(RNAi 6 h)的大豆蚜成虫经蜡蚧刺束梗孢菌侵染24, 48和96 h后,大豆蚜成虫死亡率与对照组相比差异均显著(P<0.05),分别提高了8.90%, 20.88%和21.48%(表3),证明AgKaSPI沉默后蜡蚧刺束梗孢菌对大豆蚜的侵染率显著提高。
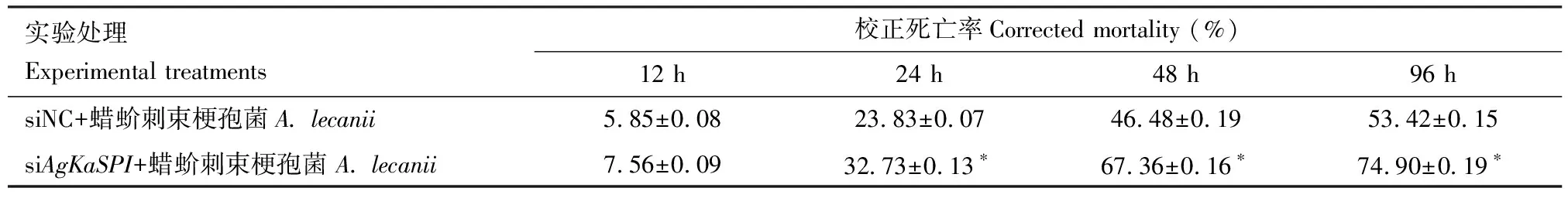
表3 RNAi干扰AgKaSPI后蜡蚧刺束梗孢菌侵染大豆蚜成虫的校正死亡率Table 3 Corrected mortality of Aphis glycines adults after infection by Akanthomyces lecanii following RNAi of AgKaSPI
3 讨论
本研究获得一条大豆蚜的具Kazal结构域的丝氨酸蛋白酶抑制剂基因的cDNA序列,命名为AgKaSPI(GenBank登录: MK440557)。根据Aymara最新分类方式(Cabrera-Muozetal., 2019),AgKaSPI属于经典型KaSPI,其推导的氨基酸序列含有一个保守的Kazal结构域。
AgKaSPI在大豆蚜不同发育阶段均有表达(图3)。昆虫丝氨酸蛋白酶抑制剂基因表达受病原菌正调控,大豆蚜经蜡蚧刺束梗孢菌孢子悬浮液处理后,AgKaSPI基因表达量显著上调(图4),AgKaSPI蛋白含量增加(图5),丝氨酸蛋白酶、胰蛋白酶和胰凝乳蛋白酶活性受到抑制(图6),说明AgKaSPI可能通过调节体内丝氨酸蛋白酶的活性来参与大豆蚜抵制病原菌的侵入;有研究表明,KaSPI不仅可以调节内源性丝氨酸蛋白酶,也可调控外源性丝氨酸蛋白酶(Wangetal., 2009),故也可能是AgKaSPI抑制了在蜡蚧刺束梗孢菌感染时分泌的真菌来源的丝氨酸蛋白酶的活性,使测得的丝氨酸蛋白酶的活性下降。柞蚕ApKTSPI基因在核型多角体病毒(nuclear polyhedrosis virus, NPV)、大肠杆菌Escherichiacoli和白僵菌免疫刺激后表达量都能上调(王磊等, 2014)。埃及伊蚊KaSPI在病毒的免疫刺激后表达量上调(Soaresetal., 2018)。这些研究结果均说明昆虫蛋白酶抑制剂参与了昆虫的免疫反应。
为进一步研究AgKaSPI在蜡蚧刺束梗孢菌诱导代谢中的作用,利用RNAi技术对AgKaSPI进行功能研究。Yan等(2020)采用dsRNA/纳米载体/洗涤剂配方,通过体壁渗透法可有效地抑制大豆蚜靶基因(dsATPD+dsATPE)的表达,沉默效率可达86.86%,死亡率高达81.67%。本研究通过将体外合成的siRNA/纳米载体/洗涤剂复合液滴至大豆蚜成虫的背部进行RNAi。qRT-PCR结果表明AgKaSPI表达量(图7)和KaSPI蛋白含量(图9)均明显下降,同时丝氨酸蛋白酶和胰凝乳蛋白酶活性显著增强(图10),产蚜量明显降低(图8),说明AgKaSPI沉默会引起相关蛋白和酶活性的变化,甚至对大豆蚜的繁殖产生影响。在东亚飞蝗Locustamigratoriamanilensis中也发现了一种与生殖有关的Kazal型丝氨酸蛋白酶抑制剂基因Greglin,通过降低蝗虫雌虫中Greglin的含量,导致东亚飞蝗卵母细胞成熟受阻,卵巢生长停滞和卵泡上皮细胞萎缩,以及产卵量和孵化率下降,表明该基因参与了蝗虫的生殖过程(Guoetal., 2019)。本研究中AgKaSPI沉默后进行蜡蚧刺束梗孢菌侵染,大豆蚜成虫的死亡率明显提高(表3),推断AgKaSPI对蜡蚧刺束梗孢菌具有抑制作用。在其他昆虫中也报道了KaSPI的抑菌作用,如在家蚕中发现包含3个Kazal结构域的BmSPI能有效抑制枯草杆菌蛋白酶,推测其在家蚕抵抗病原体入侵方面发挥着重要作用(Zhengetal., 2007);蜜蜂AcVSPI可与细菌和真菌表面结合,并表现出对真菌以及革兰氏阳性和革兰氏阴性细菌的抗微生物活性(Kimetal., 2013),可见昆虫中KaSPI在抵抗病原菌入侵方面起着重要作用。
本研究测定分析了蜡蚧刺束梗孢菌处理对大豆蚜AgKaSPI基因表达水平以及AgKaSPI酶活性的影响,结果说明AgKaSPI能够作为负调控因子控制病原真菌对大豆蚜侵染引起的免疫反应。利用体壁渗透法进行的RNAi将在病虫害防治领域显示出了很大的潜力,将推动基于RNAi的害虫防治的实践与发展。

