植食性昆虫唾液效应子和激发子的研究进展
董玉妹, 张美倩, 沈 慧, 黄兴革, 杨玉霞, 李继芬, 张文丹,沈丹宇, 景茂峰, 窦道龙, 夏 爱
(南京农业大学植物保护学院, 南京 210095)
全世界已记录的昆虫大约有100万种,其中50%是植食性昆虫,它们严重影响农作物的产量和品质,引起巨大的经济损失(姜玉英等, 2020)。为控制农业病虫害,我国化学农药的使用面积已高达5.61亿公顷次,不当的化学农药使用给生态环境、害虫抗药性和食品安全等带来一系列的问题(张杰等, 2019)。在绿色植保理念下,培育抗虫新品种成为了农作物害虫防控的必要和重要手段,深入研究植物防御和昆虫反防御的分子机制将为抗虫育种奠定重要的理论依据(王杰等, 2018)。相比于植物免疫受体、信号转导机制和植物病原菌效应子的机制等方面取得的突破性成就(张杰等, 2019),植食性昆虫与植物互作的研究相对薄弱,但最近几年来国内外学者在昆虫唾液效应子、激发子和调控寄主免疫机制方面已取得了一系列研究进展(Stahletal., 2018; Erb and Reymond, 2019; Chen and Mao, 2020; Duetal., 2020)。本文主要综述了在植物与植食性昆虫互作的防御和反防御过程中,昆虫唾液效应子和激发子在植物取食过程中的关键作用以及最新研究进展,重点阐述了昆虫效应子调控寄主植物免疫反应的分子机制。
1 昆虫唾液效应子和激发子在植物与昆虫“防御-反防御”中的作用
在植物与昆虫数百万年的协同进化过程中,植物为了躲避和抵御植食性昆虫造成的伤害,逐渐进化形成了一套高效的抗虫免疫防御策略(Schuman and Baldwin, 2016),但植食性害虫为了从植物汲取营养维持生存和繁衍,则进化出一系列的反防御手段去操控寄主植物的免疫防卫反应(Stuart and Jeff, 2015),这场“防御-反防御”的军备竞赛(arms race)也可以用病原菌与植物互作的经典模型——之字形模型(zig-zag model)来诠释(Wangetal., 2019)。植物主要利用自身的两道防线来抵御昆虫的侵害。
第一道防线依赖于植物细胞膜表面的模式识别受体(pattern recognition receptors, PRRs),其通过识别昆虫取食时释放的损伤相关分子模式(damage associated molecular patterns, DAMPs)、昆虫口腔分泌物(oral secretion, OS)中的植食性昆虫相关分子模式(herbivore associated molecular patterns, HAMPs)或激发子(elicitors)而激活植物一系列的早期免疫防御反应,即植食性昆虫相关分子模式触发的免疫(HAMP-triggered immunity, HTI)(Erb and Reymond, 2019)。植物HTI的防御信号主要包括细胞质膜表面跨膜电位的去极化、胞质钙离子(Ca2+)浓度的升高、活性氧(reactive oxygen species, ROS)爆发和促细胞分裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)通路等(Wu and Baldwin, 2010)。植物的第一道防线能够迅速有效地击退大多数昆虫,然而植食性昆虫会从口腔分泌效应子(effectors)到植物体内抑制HTI,被称为效应子激发的感病性(effector-triggered susceptibility, ETS),实现对寄主植物的成功取食(Hogenhout and Bos, 2011)。由于效应子在昆虫和植物互作中的关键反防御作用,植食性昆虫效应子的研究成为昆虫与植物互作的核心内容,近10年来取得了一系列的突破性研究进展(Bruce, 2015; Stahletal., 2018; Duetal., 2020)。
进化的压力迫使寄主植物升级了对昆虫的反防御策略,抗性植物则启动防御昆虫的第二道防线,进化出特异性的抗性(R)蛋白去识别植物细胞内的昆虫无毒效应子(avirulence effectors, Avr effectors),由此引发效应子诱导的免疫反应(effector-triggered immunity, ETI)(Guiguetetal., 2016)。植物典型的R蛋白为含有核苷酸结合位点和亮氨酸重复序列(nucleotide-binding leucine-rich repeat receptors, NLRs)的蛋白,可以特异性识别某个昆虫种群的某个效应子或者某一类效应子,从而对效应子功能进行干扰,产生强于HTI的免疫反应ETI(Tamborski and Krasileva, 2020)。例如马铃薯借助体内R基因Mi-1.2编码的蛋白实现对马铃薯蚜虫Macrosiphumeuphorbiae、1种木虱、3种线虫和粉虱的2种生物型的抗性(Rossietal., 1998)。植食性昆虫又进化出多种方式去逃避R蛋白的识别或者抑制ETI。总之,植物和植食性昆虫的互作过程是一场军备竞赛,对立的两者采用各种策略试图压制对方而有利于自己,其中昆虫效应子和激发子在昆虫的取食过程中起着决定性的作用。
2 昆虫唾液成分在调控植物免疫中的关键作用
植食性昆虫根据取食方式和行为的不同主要分为咀嚼式口器和刺吸式口器害虫。咀嚼式口器昆虫如鳞翅目的幼虫、直翅目的蝗虫和鞘翅目的甲虫等,啃食作物的各个部位形成明显的缺口和伤残,造成寄主植物细胞的大面积破坏,破损细胞释放出的DAMPs能被植物细胞膜表面的PRRs识别诱发植物的免疫防御反应(Erb and Reymond, 2019)。咀嚼式口器昆虫取食过程中,由成对的下颌腺和唇腺分泌唾液成分到植物体内。有证据表明,这些唾液成分对昆虫调控寄主植物免疫反应和促进取食发挥着重要作用。例如,它们唾液中的大量消化酶和解毒酶等可以降解植物产生的有害次级代谢物;产生的抗氧化酶可以通过减少活性氧物质来避免昆虫被植物识别;合成的挥发性物质可影响植物吸引天敌的能力;此外唾液中包含的润滑、免疫等相关蛋白还可能有利于昆虫与自然环境中的植物和微生物的互作(Rivera-Vegaetal., 2017; Basuetal., 2018)。
刺吸式口器害虫包括半翅目的蚜虫、飞虱、叶蝉、蝽象、盲蝽等,为了避免造成大面积植物损伤诱发的植物免疫防卫反应,则进化出精细的针式口器尽量沿着植物表皮细胞和叶肉细胞间隙穿行,最终到达植物韧皮部或木质部汲取营养丰富的流动的汁液(Jiangetal., 2019)。与咀嚼式口器害虫相比,对刺吸式昆虫取食过程和唾液成分的研究更为详尽,已有相关文献对蚜虫和飞虱的唾液成分类型、研究方法(van Bel and Will, 2016; Huangetal., 2019b)以及唾液成分对筛孔阻塞的作用(Mondal and Ali, 2017; Garzoetal., 2018)等分别作了综述。刺吸式害虫整个取食过程中分泌两种唾液成分到寄主植物体内,其中分泌后很快形成口针鞘包裹口针的唾液成分为胶状唾液(gel saliva),起着润滑保护口针和帮助口针定位防止移动的作用(Erb and Reymond, 2019)。研究发现,蚜虫胶状唾液结构蛋白和褐飞虱Nilaparvatalugens唾液鞘蛋白NlShp是昆虫成功取食所必需的(Will and Vilcinskas, 2015)。深入研究还表明胶状唾液在抑制植物防御反应方面具有重要的地位,主要体现在其可以填充口针穿刺取食时造成的微小细胞伤口,避免诱发植物的免疫防卫反应(Huangetal., 2019b)。同时胶状唾液还可以防止钙离子由伤口运输到筛管内腔而抑制筛管阻塞,从而可以保障昆虫顺利吸取筛管细胞内流动的汁液(Vincentetal., 2017)。胶状唾液不仅有利于昆虫的取食过程,还可以被植物识别而激发早期免疫反应(Willetal., 2013)。刺吸式昆虫整个取食过程中释放的另一种唾液成分为水状唾液(watery saliva) (Mugfordetal., 2016),主要成分为蛋白质和酶 (Chenetal., 2019),类似于咀嚼式口器昆虫分泌的唾液成分,含有参与调控寄主植物防御免疫反应的激发子和效应子(Bruce, 2015)。刺吸式害虫穿透植物表皮细胞到达韧皮部筛管取食,其唾液成分效应子和激发子在植物细胞中能调控植物免疫的反应(图1)。

图1 刺吸式昆虫取食过程中分泌效应子和激发子到寄主体内调控免疫模式图Fig. 1 Model of piercing-sucking insects secreting effectors and elicitors into hosts to regulate plant immunity during feeding刺吸式口器昆虫利用针式口针在植物细胞间隙穿梭,偶尔会刺穿植物表皮细胞和叶肉细胞的进行试探,以获得味觉线索,从而决定是否继续进食。有些害虫的口针会到达韧皮部,汲取筛管中流动的汁液获取营养来促进发育和繁殖。在整个取食过程中,刺吸式口器昆虫会遇到来自植物的免疫防卫反应而产生的各种屏障,而为了顺利取食,昆虫从唾液分泌大量效应子(红色圆圈)到植物细胞间隙或细胞内抑制植物免疫防卫反应。同时昆虫取食时分泌到细胞间隙的激发子(蓝色三角)会被植物细胞膜上的模式识别受体所识别而激发早期的免疫防卫反应。The piercing-sucking insects utilize their needle-like stylet to probe in the intercellular space of plant cells. Occasionally they will penetrate epidermal and mesophyll cells for taste cues to determine whether or not to continue feeding. Evolutionarily succeed pests will eventually pass epidermal and mesophyll cells, and reach plant sieve tube cells for successfully sucking plant sap to develop and reproduce. During this whole process, the piercing-sucking insects encounter various kinds of obstacles produced by the plant immune system, but they can secrete a large number of effectors (red circle) through saliva into the plant cells or intercellular spaces to suppress the plant immune response and help them successfully feeding. Meanwhile, the elicitors in the intercellular spaces (blue triangle) secreted by insects during feeding can be recognized by pattern recognition receptors on the plant cell membrane to trigger early immune defense responses.
咀嚼式和刺吸式昆虫都分泌唾液成分到寄主植物体内调控免疫反应,由于唾液成分中的激发子诱发的免疫行为提高植物的抗性,而效应子则在抑制植物免疫中起着决定性的作用,决定着昆虫的寄主范围以及能否成功获得所需的养分(Shah and Walling, 2017)。
3 昆虫效应子的研究进展及作用机制
昆虫取食或产卵时分泌到植物体内抑制寄主免疫防御反应或影响生理生化,有利于昆虫取食的蛋白质、多肽或其他物质统称为效应子。此定义类似于植物病原菌效应子(Hogenhoutetal., 2009),但不同之处在于昆虫效应子是昆虫取食或产卵时分泌到植物体内的,而植物病原菌效应子是通过分泌系统或吸器分泌到植物体内的。最早报道的昆虫效应子是从咀嚼式口器昆虫美洲棉铃虫Helicoverpazea中鉴定出来的葡萄糖氧化酶,它能通过抑制植物伤口诱发的尼古丁积累而干扰烟草的免疫反应(Musseretal., 2002)。刺吸式昆虫豌豆蚜Acyrthosiphonpisum中的C002效应子定位于主唾液腺的分泌细胞,该蛋白也能在蚜虫取食后的蚕豆叶片中检测到,其编码基因沉默后蚜虫在韧皮部的停留时间缩短(Muttietal., 2008)。近年来,效应子的鉴定及抑制寄主免疫机制的研究成了植物-昆虫互作研究领域的重点和热点。截止到目前为止,已经发表了相当数量的昆虫效应子并对其功能进行了深入研究,本文将已报道的昆虫效应子及其功能归纳总结为表1,并分别在下文进行讨论。叶螨不属于昆虫,但取食行为类似于刺吸式昆虫,因此本文中也包括了二斑叶螨Tetranychusurticae和伊氏叶螨T.evansi效应子的研究进展。
3.1 影响植物早期防御信号的昆虫效应子
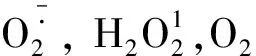
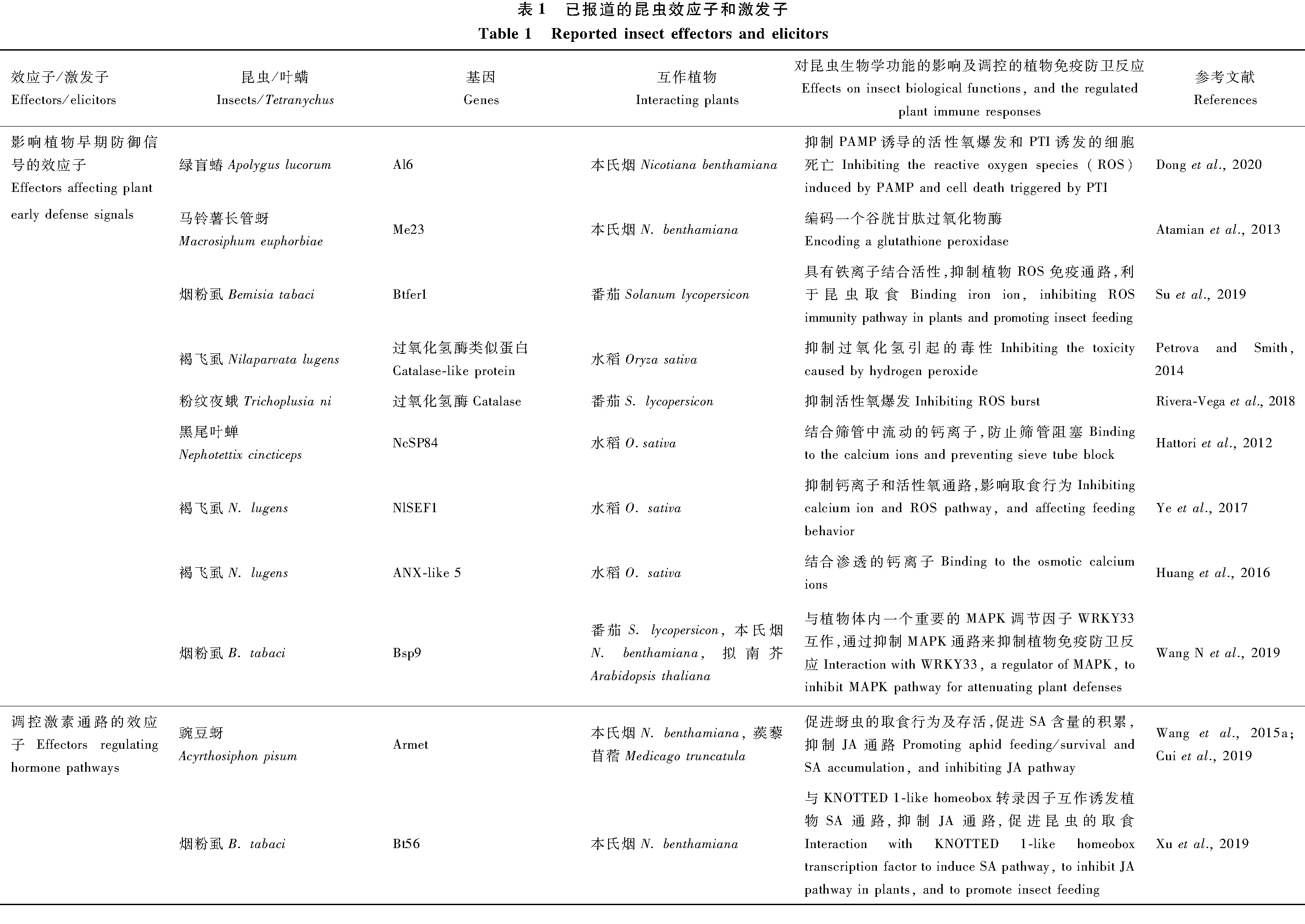


钙信号是植物早期防御的另一条信号通路,昆虫取食植物时在取食部位造成的伤口会诱发植物胞内钙离子浓度的快速升高,并从伤口运输到筛管内腔而阻塞筛管,从而阻碍昆虫汲取筛管细胞内流动的汁液(Vincentetal., 2017)。为了顺利取食,植食性昆虫会从唾液分泌钙离子结合蛋白,与流动的钙离子结合,抑制筛管的阻塞而促进取食(Willetal., 2007)。研究发现黑尾叶蝉Nephotettixcincticeps的NcSP84具有EF-hand Ca2+结合结构域,在黑尾叶蝉取食后的水稻筛管汁液中检测到了NcSP84蛋白,因此推测NcSP84可能分泌到韧皮部筛管中结合流动的钙离子,防止筛管阻塞(Hattorietal., 2012)。褐飞虱的ANX-like 5具有1~3个annexin repeats的钙离子结合结构域,沉默其编码基因显著地影响了昆虫在韧皮部和木质部汁液吸取时间,减少了蜜露的分泌,因此推测效应子ANX-like 5的功能是结合韧皮部渗透的钙离子(Huangetal., 2016)。钙离子不仅能够阻塞筛管,还是重要的二级信号转导分子,调控免疫反应(徐丽萍等, 2018)。研究表明褐飞虱的 NlSEF1蛋白具有EF-hand Ca2+结合活性,取食时通过分泌到水稻体内与Ca2+结合从而抑制PTI通路中的钙离子防御信号(Yeetal., 2017)。
MAPK级联通路也是植物应对昆虫取食的重要防御信号之一,在抗虫反应中发挥着极其重要的作用(徐丽萍等, 2018)。烟粉虱的Bsp9效应子能与拟南芥MAPK信号通路中的关键调控转录因子WRKY33进行互作,抑制MAPK免疫通路减弱拟南芥的抗虫反应(Wang Netal., 2019)。
3.2 调控激素通路的昆虫效应子
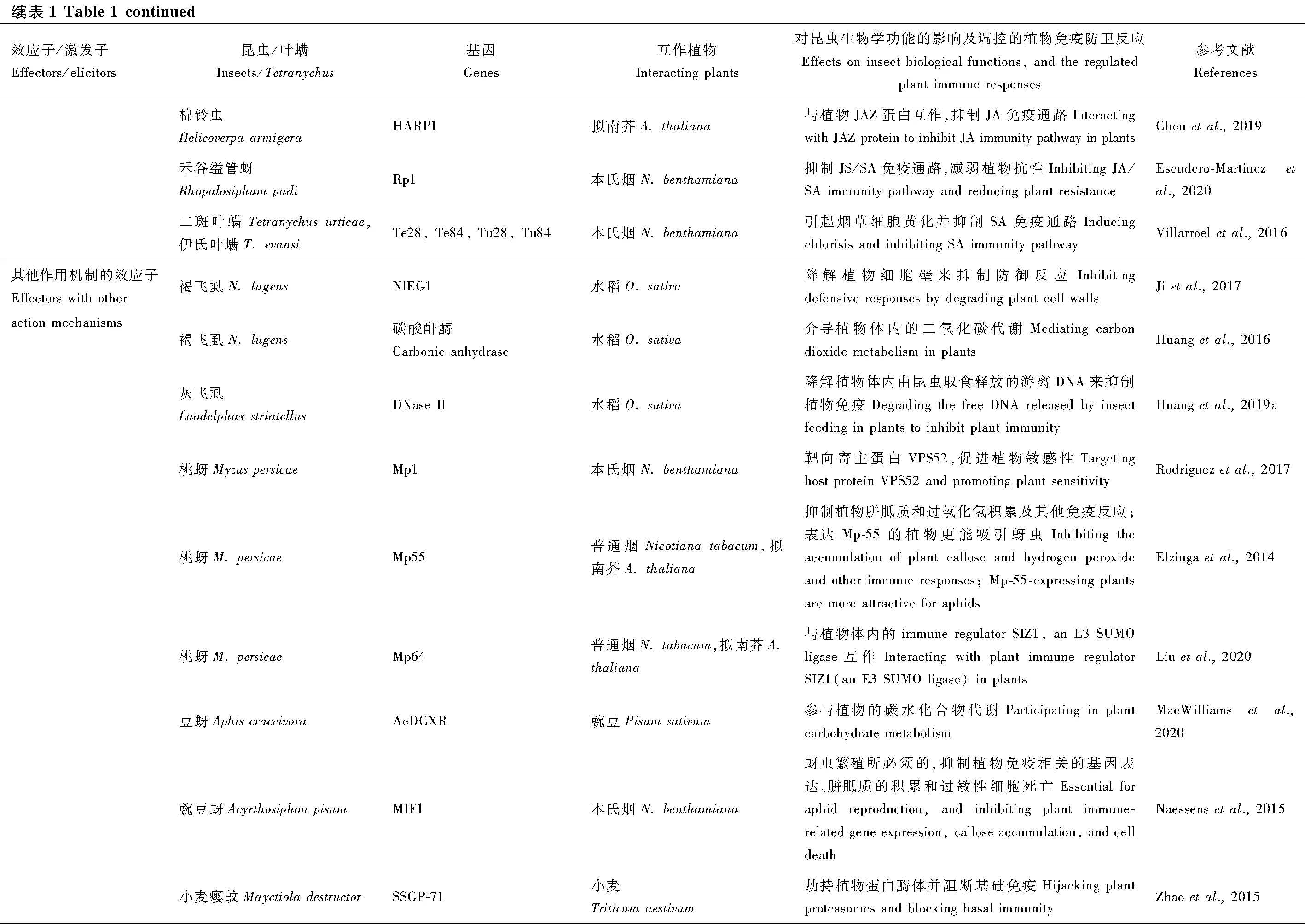
现有报道的干扰激素信号通路的昆虫效应子中,作用机制研究的相对比较清楚的有豌豆蚜的Armet、烟粉虱的Bt56和棉铃虫的HARP1(H.armigeraR-like protein 1)。豌豆蚜取食蚕豆时会分泌水状唾液中的Armet到蚕豆韧皮部汁液中(Wangetal., 2015a)。在烟草和蒺藜苜蓿中瞬时表达Armet能够激活植物的MAPK和水杨酸(salicylic acid, SA)通路,进一步的机制分析表明Armet通过调控烟草中的SAMT和SABP2来促进SA含量的积累抑制JA通路(Cuietal., 2019)。烟粉虱分泌小分子量蛋白Bt56到植物中去促进取食,在烟草中过表达Bt56激发SA信号通路,其作用机制为Bt56直接与烟草的KNOTTED 1-like homeobox transcription factor NTH202互作来诱导SA的积累(Xuetal., 2019)。报道的咀嚼式口器昆虫中效应子较少,2019年鉴定到棉铃虫口腔分泌物中一个毒液类似蛋白HARP1,它在植物细胞中与JAZ蛋白互作,阻止COI1-JAZ引起的JAZ的降解从而抑制JA诱导的免疫反应(Chenetal., 2019)。最近的研究还发现禾谷缢管蚜Rhopalosiphumpadi的Rp1能抑制JA和SA信号通路(Escudero-Martinezetal., 2020),而二斑叶螨的Te28, Te84, Tu28和Tu84抑制SA免疫通路(Villarroeletal., 2016),但这些基因抑制激素通路的具体机制尚不明确。
3.3 其他作用机制的昆虫效应子
植食性昆虫需要穿透植物的细胞壁到达韧皮部去汲取汁液,为了穿越这层物理屏障,昆虫会分泌大量酶类效应子如纤维素酶(endo-β-1,4-glucanase)和果胶酶等降解细胞壁成分促进取食。褐飞虱的纤维素酶NlEG1能降解水稻细胞壁中的纤维素,协助口针顺利到达韧皮部汲取汁液(Jietal., 2017)。昆虫效应子也可以调控植物的代谢通路,如褐飞虱的碳酸酐酶(carbonic anhydrase)参与植物的二氧化碳代谢(Huangetal., 2016),豆蚜Aphiscraccivora的AcDCXR基因编码一个脱氢酶/还原酶(dehydrogenase/reductase),参与植物碳水化合物代谢过程 (MacWilliamsetal., 2020)。昆虫取食植物时,取食部位附近的破损植物细胞会释放出DNA诱发植物的免疫反应,研究发现,灰粉虱Laodelphaxstriatellus从唾液腺分泌DNase II到寄主受伤部位,降解受伤植物释放的游离DNA来抑制其免疫促进昆虫的取食(Huangetal., 2019a)。昆虫效应子可以参与植物囊泡介导的运输过程来调控寄主的免疫,例如桃蚜Myzuspersicae的Mp1与寄主植物的液泡蛋白分选相关蛋白52(vacuolar protein sorting-associated protein 52, VPS52)相互作用,VPS52是GARP(Golgi-associated retrograde protein)复合体的一个组分,负责内涵体和高尔基体反面网状结构间的运输(Rodriguezetal., 2017)。
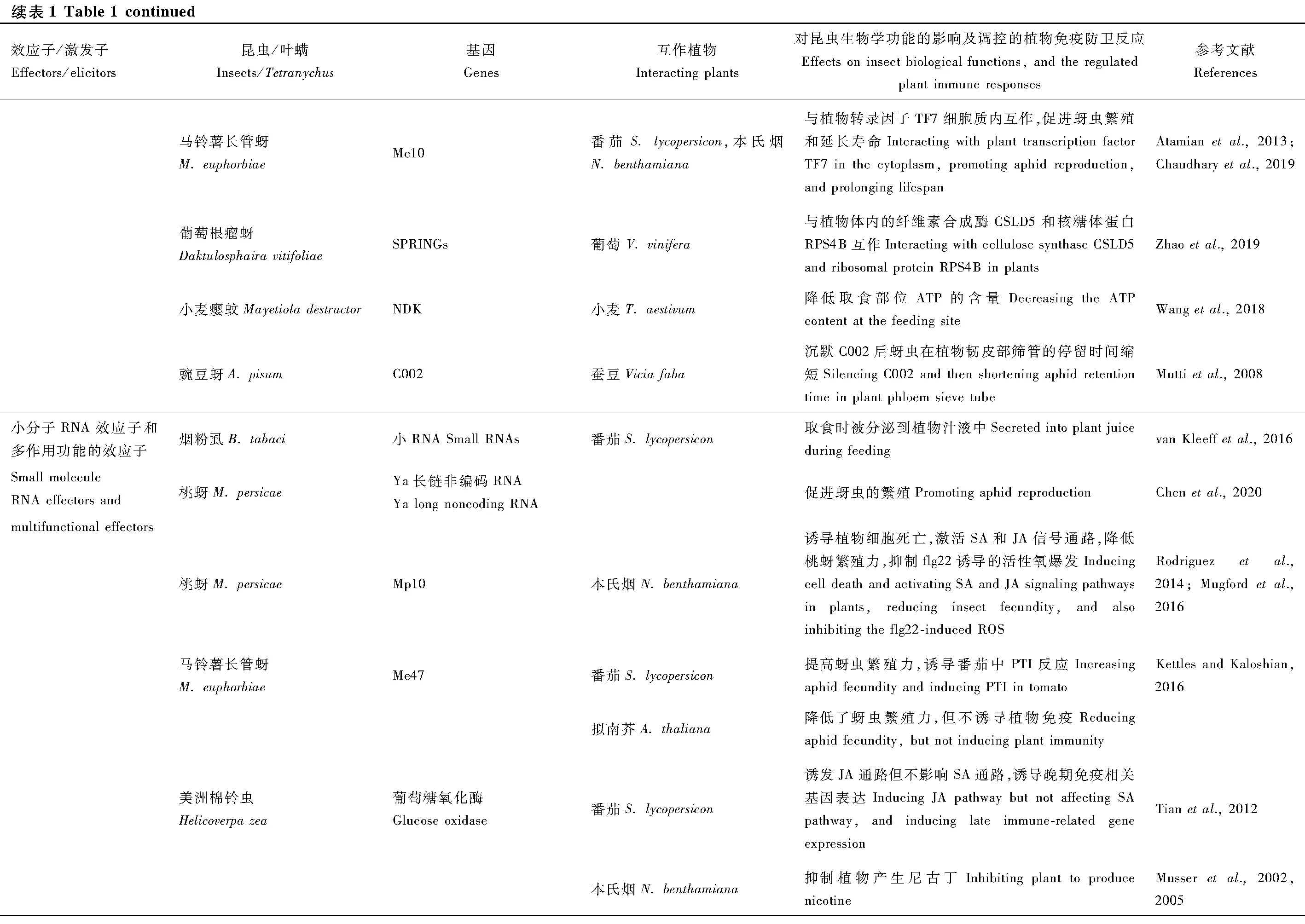
昆虫效应子也可以通过靶向植物的免疫重要节点因子,比如桃蚜的Mp64效应子通过靶向植物免疫调控因子SIZ1来抑制植物的抗性(Liuetal., 2020)。SIZ1是一个SUMO E3连接酶能够调节SA介导的免疫和EDS1/PAD4介导的抗性基因信号转导,也是植物病原菌和线虫的调控靶标,因此作者推测SIZ1是多种植物寄生物的免疫调控节点。小麦瘿蚊的SSGP-71效应子是一个E3泛素连接酶模拟蛋白,在小麦中劫持蛋白酶体阻断基础免疫(Zhaoetal., 2015)。脊椎动物和昆虫也有一类进化上高度保守的免疫调控因子,典型的例子是巨噬细胞迁移抑制因子(macrophage migration inhibitory factor, MIF),线虫和蜱等利用MIF去调控寄主植物的免疫反应(Bowenetal., 2010);豌豆蚜的唾液腺中也存在一个效应子MIF1,在烟草中表达MIF1基因能抑制植物免疫相关基因的表达、胼胝质的积累和过敏性细胞死亡(Naessensetal., 2015)。其他效应子还有桃蚜的Mp55能够抑制植物胼胝质和过氧化氢积累等免疫反应(Elzingaetal., 2014)。马铃薯长管蚜效应子Me10,在烟草和番茄中表达后能够增强取食转基因植物后的马铃薯长管蚜和桃蚜的繁殖力(Atamianetal., 2013),在烟草和马铃薯的互作蛋白是TFT7,但Me10-TFT7复合物调控的下游信号通路并不清楚(Chaudharyetal., 2019)。小麦瘿蚊Mayetioladestruotor的NDK效应子编码核苷二磷酸激酶,此效应子可能在取食部位抑制ATP含量的升高,通过调控ATP介导的免疫反应来促进取食(Wangetal., 2018)。
3.4 小分子RNA效应子和多作用功能的效应子
研究还发现昆虫效应子不仅是蛋白质或酶,也可以是小分子RNA,如烟粉虱取食时分泌小RNA到植物汁液中(van Kleeffetal., 2016)。桃蚜将Ya长链非编码RNA转移到植物体内,有利于蚜虫的繁殖(Chenetal., 2020)。还有一部分效应子则巧妙地进化出两个不同的结构域,既可以作为毒性基因诱发植物免疫也能抑制寄主的免疫防卫反应促进昆虫的取食行为,例如桃蚜的Mp10蛋白在烟草中表达后激活水杨酸和茉莉酸信号通路,诱导植物细胞局部死亡从而激发植物抗性,同时也能抑制植物病原菌PAMP flg22诱发的活性氧爆发(Bosetal., 2010; Rodriguezetal., 2014; Mugfordetal., 2016)。
对昆虫效应子的研究还发现同一个效应子在不同的寄主植物上发挥不同的生物学功能,例如美洲棉铃虫唾液腺分泌的葡萄糖氧化酶抑制烟草物理伤口诱发的尼古丁产生,作为效应子抑制免疫(Musseretal., 2002, 2005),但在番茄中作为激发子诱发JA的积累和晚期免疫相关基因例如蛋白酶抑制剂基因(Pin2)的表达(Tianetal., 2012)。马铃薯长管蚜的一个谷胱甘肽-S-转移酶(glutathione-S-transferase, GST)Me47在番茄中表达后能够提高蚜虫的繁殖力,诱导植物的PTI反应,而在拟南芥中不诱导植物免疫(Kettles and Kaloshian, 2016)。因此,这些研究结果表明昆虫效应子存在功能多样性和寄主适应性特异性。
3.5 机制不明的候选效应子
除了已知功能的效应子,近年来通过对昆虫分泌唾液蛋白组和唾液腺转录组数据分析还筛选出了大量的候选效应子,例如桃蚜M.persicae的Mp59, Mp60, Mp61, Mp62和Mp63(Elzingaetal., 2014)和二斑叶螨T.urticae的Te128, Te19, Tu128, Tu19和Tu90(Villarroeletal., 2016)。并尝试对这些候选效应子的功能进行解析,如桃蚜的MpPIntO1,被定位于蚜虫取食部位的唾液鞘,包围着口针(Mugfordetal., 2016)。褐飞虱的Salivap-3和Salivap-4是胶状唾液的重要组成部分(Huangetal., 2016)。研究还发现,豌豆蚜的血管紧张素转换酶(angiotensin-converting enzyme) ACE1和ACE2在蚜虫-植物互作中发挥着重要作用,沉默这些基因后影响蚜虫在植物里的取食行为(Wangetal., 2015b)。烟粉虱Bemisiatabaci的漆酶LAC1也参与了烟粉虱与植物的互作(Yangetal., 2017)。黑尾叶蝉N.cincticeps的NcSP75和NcLac3是昆虫在韧皮部取食所必需的(Matsumoto and Hattori, 2018; Matsumoto and Hattori, 2019)。最近,从柑橘木虱Diaphorinacitri中筛选到DCEF28, DCEF32, DCEF33和DCEF35,沉默这些候选效应子的基因后也会影响昆虫在寄主植物上的存活和取食(Pachecoetal., 2020)。但以上研究未能证明这些唾液蛋白是昆虫取食时分泌到植物体内的,并且在植物中的作用机制也未见报道,因此是一类重要的潜在效应子。
4 昆虫激发子及诱导的植物免疫反应
昆虫口腔分泌物、产卵液、沉积的粪便或分泌的蜜露中蛋白质、多肽或其他物质能被植物细胞质膜上的PRRs识别,激活防御信号通路的物质统称为激发子(Furstenberg-Haggetal., 2013; Aljbory and Chen, 2018; Warietal., 2019)。昆虫激发子与植物病原菌的激发子功能类似,都能被植物细胞质膜上的PRRs识别,激活植物的免疫防御反应增强寄主的抵抗力。前期已有文章对昆虫取食产生的DAMP (Schmelz, 2015; Erb and Reymond, 2019; Chen and Mao, 2020)和咀嚼式口器昆虫相关分子模式已经进行了系统综述(禹海鑫等, 2015; 张月白和娄永根, 2020)。本文进一步更新了昆虫激发子的最新研究进展,将发表的激发子归纳到表1中。目前已鉴定到的多种激发子成分主要为脂肪酸类、蛋白和酶类、多肽等(Uemura and Arimura, 2019)。其中研究最早且较详尽的一类是昆虫口腔分泌物中广泛存在的脂肪酸-氨基酸共轭物(fatty acid-amino acid conjugate, FAC),主要包括从甜菜夜蛾Spodopteraexigua幼虫和南美沙蝗Schistocercaamericana唾液中鉴定出来的激发子volicitin和caeliferin,它们都能诱导玉米幼苗释放特殊的挥发性萜类物质来抵抗昆虫取食(Albornetal., 1997, 2007; Maliketal., 2020)。植食性昆虫口腔分泌物中的酶类如美洲棉铃虫的葡萄糖氧化酶(Tianetal., 2012)、大菜粉蝶Pierisbrassicae的β-葡萄糖苷酶(β-glucosidase)(Mattiaccietal., 1995)、沙漠蝗Schistocercagregaria口腔的脂酶(Schäferetal., 2011)和草地贪夜蛾Spodopterafrugiperda的磷脂酶C(Acevedoetal., 2018)也是植物早期免疫信号的激发子,上述酶类通过诱导植物细胞胞内Ca2+浓度的升高、MAPK通路的激活以及H2O2、乙烯(ethylene, ET)和茉莉酸(jasmonic acid, JA)等信号物质的合成或者释放挥发性物质等来启动植物防御反应。研究还发现,草地贪夜蛾OS 中存在来自寄主植物叶绿体ATP合成酶 γ 亚基的一段序列,该肽段经内部二硫键的连接形成植物能够识别的激发子 inceptin,诱导防御相关激素茉莉酸和乙烯等的产生(Schmelzetal., 2006)。
对刺吸式口器昆虫激发子的研究尚处于初期阶段,麦长管蚜Sitobionavenae和麦二叉蚜Schizaphisgraminum唾液中的多酚氧化酶(polyphenol oxidase)能够诱导茉莉酸和萜(terpene)通路中的关键基因的表达,因此多酚氧化酶诱导了小麦的免疫防御反应(Maetal., 2010)。桃蚜的Mp42和Mp56-58蛋白都能降低桃蚜的繁殖力,激活本氏烟Nicotianabenthamiana的免疫反应,但具体作用机制不明(Elzingaetal., 2014; Rodriguezetal., 2014)。褐飞虱唾液中鉴定到一个mucin类似物蛋白(NlMLP),可以通过唾液分泌到植物韧皮部,能够诱导植物细胞的死亡,激发水稻防御基因的上调表达和诱导胼胝质积累,因此证明是个激发子(Shangguanetal., 2018)。褐飞虱的NI12, NI16, NI28, NI32, NI40和NI43也能诱导免疫相关基因的上调表达和胼胝质的积累(Raoetal., 2019)。褐飞虱的NISP1效应子能诱导水稻的细胞死亡、胼胝质的积累和其他免疫相关基因的表达(Shangguanetal., 2018; Huangetal., 2020)。但以上报道的激发子诱导植物免疫的机制及其受体并不清楚,最新研究发现桃蚜的一个半胱氨酸蛋白酶(cysteine protease)蛋白CathB3在烟草韧皮部与胞质EDR1-like(enhanced disease resistance 1-like)激酶互作,激发活性氧的积累,诱发烟草免疫提高抗虫性(Guoetal., 2020)。
5 小结与展望
在长期的植物-昆虫协同进化过程中,植物进化出多层次的防御机制抵御昆虫的取食和攻击,其中一道主要防线是由位于细胞质膜上的PRRs识别昆虫分泌或产卵等释放的HAMP/激发子而启动的PTI。近几年来,咀嚼式口器昆虫相关分子模式的研究已经取得了卓越进展,已经报道的HAMPs有昆虫口腔OS的inceptin、volicitin、caeliferin、葡萄糖氧化酶、脂酶、β-葡萄糖苷酶、磷脂酶C和β-半乳糖呋喃多糖等,并且随着褐飞虱NlMLP和桃蚜CathB3的相继发表,刺吸式口器害虫激发子的研究也取得了突破(表1)。作为反防御策略,昆虫从口腔分泌一系列效应子分别靶向植物PTI通路中的不同组分,通过抑制或操控植物的免疫反应促进取食。现已报道的已知功能的昆虫效应子有影响植物早期信号的绿盲蝽Al6和马铃薯长管蚜的Btfer1,都能抑制活性氧爆发(Suetal., 2019; Dongetal., 2020)。黑尾叶蝉的NcSP84和褐飞虱的NlSEF1通过结合游离的钙离子防止筛管的阻塞或抑制钙信号(Hattorietal., 2012; Yeetal., 2017)。烟粉虱的Bsp9与WRKY33互作抑制MAPK通路(Wang Netal., 2019)。还有其他作用机制的褐飞虱N1EG1和碳酸酐酶(Huangetal., 2016; Jietal., 2017)等以及小分子RNA效应子(van Kleeffetal., 2016; Chenetal., 2020)。
纵观昆虫效应子和激发子的最新研究进展,同时也给我们带来了一些值得思考的科学问题:(1)昆虫效应子的分泌特性是不是其功能发挥所必需的?现有的研究揭示了许多昆虫效应子没有典型的分泌信号肽(Kaloshian and Walling, 2016),例如50%的褐飞虱唾液腺蛋白基因不含信号肽序列(Huangetal., 2019b)。(2)昆虫效应子在寄主和非寄主植物上的作用机制是不是有所不同?甚至在不同的植物上功能不同?前期研究表明同一效应子在不同植物上的功能不同,例如美洲棉铃虫的葡萄糖氧化酶抑制烟草的尼古丁产生,抑制免疫(Musseretal., 2002, 2005),而在番茄中作为激发子诱发JA爆发和晚期免疫相关基因的表达(Tianetal., 2012)。马铃薯长管蚜的Me47诱导番茄的PTI反应,但不激发拟南芥的免疫反应(Kettles and Kaloshian, 2016)。因此推测这些效应子可能与昆虫在寄主植物上的适应性进化有关。(3)同一效应子具有多种功能。前期报道表明某些昆虫效应子是把双刃剑,既能抑制寄主植物的免疫通路,同时也能诱发植物的防卫反应,例如桃蚜的Mp10蛋白,在烟草中表达后激活SA和JA信号通路,诱导植物细胞局部死亡从而激发植物抗性,同时也能抑制植物病原菌PAMP flg22诱发的活性氧爆发(Bosetal., 2010; Rodriguezetal., 2014; Mugfordetal., 2016)。绿盲蝽的Al6蛋白既能抑制活性氧爆发同时也能诱导激素茉莉酸和水杨酸等的合成(Dongetal., 2020)。(4)昆虫取食不同植物时分泌组分不同的唾液蛋白,并且饲喂人工饲料的昆虫也分泌不同组分的唾液(Kaloshian and Walling, 2016),例如ACE1和ACE2效应子在蚜虫取食植物时有贡献,但对取食人工饲料无影响(Wangetal., 2015b; Boulainetal., 2018)。这说明昆虫会通过唾液效应子的快速进化来适应新的寄主植物。(5)昆虫无毒效应子是昆虫效应子研究领域的薄弱之处,现有报道的昆虫无毒效应子是小麦瘿蚊vH13, vH6和vH9(Kaloshian and Walling, 2016),并发表了少数抵抗昆虫的植物R蛋白,如马铃薯的Mi-1.2、水稻中抗褐飞虱蛋白Bph14和Bph9以及甜瓜Vat位点编码一个CC-NBS-LRR蛋白(Jiangetal., 2019; Duetal., 2020),但还没有成对的无毒效应子和植物R蛋白被鉴定出来。(6)昆虫激发子的植物模式识别受体的研究尚处于初期阶段,现仅有报道的PRR是inceptin的植物识别受体INR(Steinbrenneretal., 2020)。阐明上述科学问题,在理论上将能揭示植食性昆虫与寄主植物的互作机制和协同进化规律,对于指导作物虫害绿色防治和农药的减量增效具有重要意义。

