不同地理种群短额负蝗对环境温度的适应性
李文博, 高 宇, 崔 娟, 2, 唐佳威, 史树森,*
(1. 吉林农业大学植物保护学院, 长春 130118; 2. 吉林农业科技学院农学院, 吉林吉林 132101)
短额负蝗Atractomorphasinensis,属直翅目(Orthoptera)锥头蝗科(Pyrgomorphidae)负蝗属Atractomorpha,国外分布于日本、韩国、越南、缅甸、印度、不丹、尼泊尔等国家(Kevan and Lee, 1974; 夏凯龄, 1994; 姚世鸿, 2005; Kumaretal., 2014),自陈茂才(1965)首次报道我国江西省发现短额负蝗为害农作物以来,该虫已扩散至安徽、湖北、湖南、广西、广东、河南、陕西、山西、山东、河北等20多个省地区。该害虫以若虫、成虫取食双子叶类农作物的叶片,包括大豆、玉米、棉花、向日葵、白菜、油菜、番薯、花生、苜蓿、甜菜等,严重时将叶片食光,对农牧业生产影响较大(陈茂才, 1965; Kevan and Lee, 1974; 史树森, 2013)。田方文(2005)报道了自2000-2003年间山东滨州地区苜蓿地受到短额负蝗持续为害,密度均超过20头/m2。近年来,该虫在大豆田间发生量逐年上升,已成为重要食叶害虫(史树森, 2013)。
有关短额负蝗生物学方面研究已有一些报道,及尚文等(1995)系统研究了大同短额负蝗种群田间生活史、生活习性与防治措施;韩凤英(1999)测得短额负蝗太原种群卵的发育起点温度与有效积温分别为4.47℃和641.10日·度;李文博等(2020)测定延安种群卵的发育起点温度与有效积温分别为9.85℃和449.80日·度,并明确了温度过低或过高均对短额负蝗延安种群繁殖与增长产生了抑制作用。由于上述两个不同地理种群短额负蝗卵的发育起点温度和有效积温测定结果存在较大差异,对进一步研究短额负蝗区域分布及生产实际中田间发生世代预测带来困难。然而,关于短额负蝗不同地理种群对环境温度适应性差异及变化规律问题的研究未见报道。栖息地的环境因子直接影响昆虫种群表观形态、生物学特性、生理代谢等方面的变化。其中,温度胁迫是昆虫种群适应环境的重要动力,甚至导致物种分化(Sørensenetal., 2003)。发育起点温度与有效积温是决定昆虫在特定生境能否完成生长发育及预测其种群发生动态的重要生物学参数,有助于准确预测区域内害虫发生期和发生代数(Jarosiketal., 2002; Wangetal., 2016; Lietal., 2020)。本研究选择陕西延安、河南郑州、四川成都、云南曲靖和广东广州5个不同地理纬度环境的短额负蝗种群,在室内恒温条件下,系统观测比较各种群生物学参数,包括发育历期、发育速率、发育起点温度及有效积温,分析不同地理种群相关生物学参数与栖息地环境温度的相关性,为预测不同地区短额负蝗种群田间动态提供科学依据,也为进一步研究其种群遗传分化奠定基础。
1 材料与方法
1.1 供试虫源
2018年8-9月间,短额负蝗成虫分别采自陕西延安市、河南郑州市、四川成都市、云南曲靖市、广东广州市,在吉林农业大学昆虫生物学研究室扩繁建立实验种群,饲养条件为温度25±1℃、相对湿度70%±5%、光周期16L∶8D。取F1代雌雄个体用于实验,选用盆栽大豆(吉农38)寄主鲜叶片饲养。
1.2 虫源栖息地大尺度地理气象参数
虫源不同地理种群栖息地地理坐标、海拔及2015-2019年环境温度参数(源自中国天气网),详见表1。其中,环境温度参数指标年平均气温与日平均最高、最低气温间相关性如图1所示。可以看出,日平均最高、最低气温与年平均气温间均呈极显著正相关,日平均最高气温y日平均最高气温=5.548+1.039x(R2=0.958,P=0.0038);日平均最低气温y日平均最低气温=8.714+1.240x(R2=0.976,P=0.0016)。可见,年平均气温指标可代表不同地区的上述3个环境温度特征。

表1 短额负蝗不同地理种群样本采集地的地理和气象参数Table 1 Geographical and meteorological parameters of sampling localities of differentgeographical populations of Atractomorpha sinensis
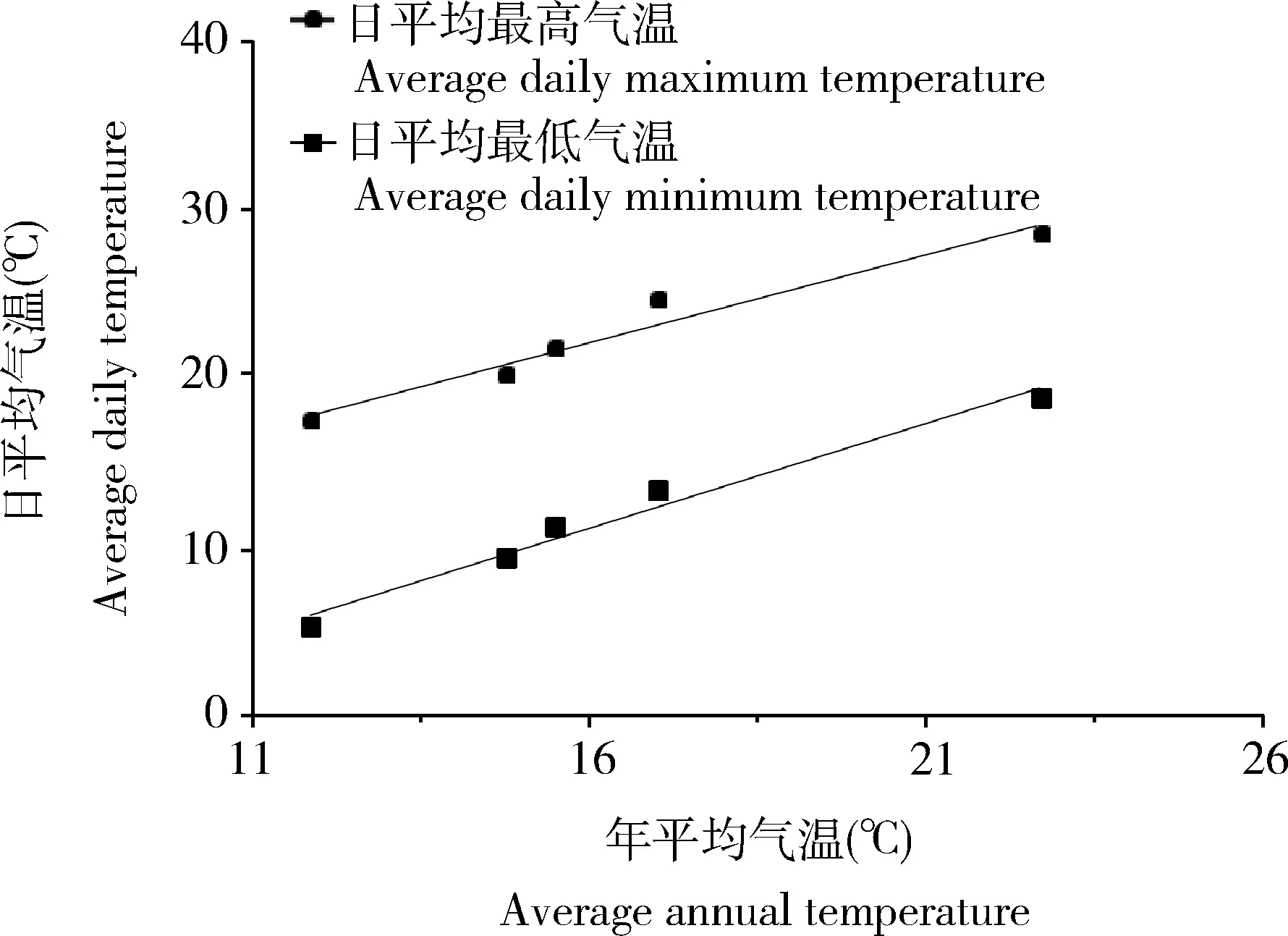
图1 短额负蝗栖息地年平均气温与日平均气温间关系Fig. 1 Relationship between annual average temperatureand daily average temperature in habitat ofAtractomorpha sinensis
1.3 发育历期测定
实验设置16, 20, 24, 28和32℃ 5个恒温处理,相对湿度70%±5%,光周期16L∶8D。将灭菌后的营养土、细沙混匀成产卵基质,铺于养虫罐底部,基质层厚度5 cm,选取健康雌雄成虫个体分组配对,移至养虫罐并饲喂新鲜豆叶后,再放入气候箱内。每天定时(8∶00和20∶00)观察记录雌性成虫产卵时间与卵块孵化情况,直至无若虫孵出,将卵囊挖出,记录未孵化卵粒数量,每个温度处理3次重复,每个重复至少30粒卵。将各温度处理下初孵蝗蝻置于放有新鲜豆叶的50 mL离心管中单头饲养,为确保离心管通气性,用昆虫针将离心管管壁扎70个孔,实验中及时更换豆叶,清洁管内虫粪,每天观察记录蝗蝻蜕皮与死亡情况,直至全部羽化成虫。
1.4 发育速率计算与回归分析
将各温度处理下的短额负蝗各虫态(龄期)发育历期N加权平均,计算平均发育速率V(V=1/N)。采用直线回归法(y=a+bx,其中b>0为正相关,b<0为负相关)对种群发育速率y与环境温度x之间进行回归分析。
1.5 发育起点温度和有效积温的计算
依据直接最优法计算得出短额负蝗各虫态的发育起点温度C和有效积温K(李典谟和王莽莽, 1986)。
式中,Ti为实验设定的温度(℃),Di为在Ti温度条件下的发育历期(d),Ki为发育起点温度是C时的有效积温(d·℃)。
1.6 地理种群生物学特征指标与栖息地环境温度特征指标的关性分析
采用直线回归法(同1.4节),以种群栖息地年平均气温指标代表环境温度特征与不同地理种群发育速率、发育起点温度和有效积温等生物学特征指标进行相关性分析。
1.7 数据分析
采用SPSS18.0(IBM,美国纽约州阿蒙克市)统计软件进行单因素方差分析(one-way ANOVA)并结合Tukey氏法检验分析不同地理种群短额负蝗各虫态的发育历期、发育起点温度、有效积温等与温度间关系,应用GraphPad Prism 8.0软件构建模型图形。
2 结果
2.1 不同地理种群短额负蝗对温度变化的生物学响应
2.1.1不同地理种群短额负蝗在不同环境温度下发育历期的差异性分析:不同地理种群短额负蝗在不同温度下各虫态发育历期的结果见图2。在16~32℃条件下,不同地理种群各虫态及世代发育历期总体随着温度升高而下降。不同地理种群对环境温度变化的生物学响应表现出差异性,在32℃下,曲靖种群亲代雌虫不能产卵,广州种群世代历期最短,显著短于其他种群(F=50.046,df=174,P<0.05);24℃条件下,郑州、成都和广州种群成虫期差异不显著,但都显著短于曲靖种群(F=5.264,df=315,P<0.05);在20℃下,延安、郑州种群的卵和世代发育历期明显短于成都、曲靖和广州种群;16℃条件下,成都和广州种群个体不能完成生长发育,曲靖种群与延安和郑州种群卵的历期无显著差异,但成虫历期则显著长于延安和郑州种群(F=6.111,df=104,P<0.05),世代历期与郑州种群相似而显著长于延安种群(F=9.253,df=112,P<0.05)。
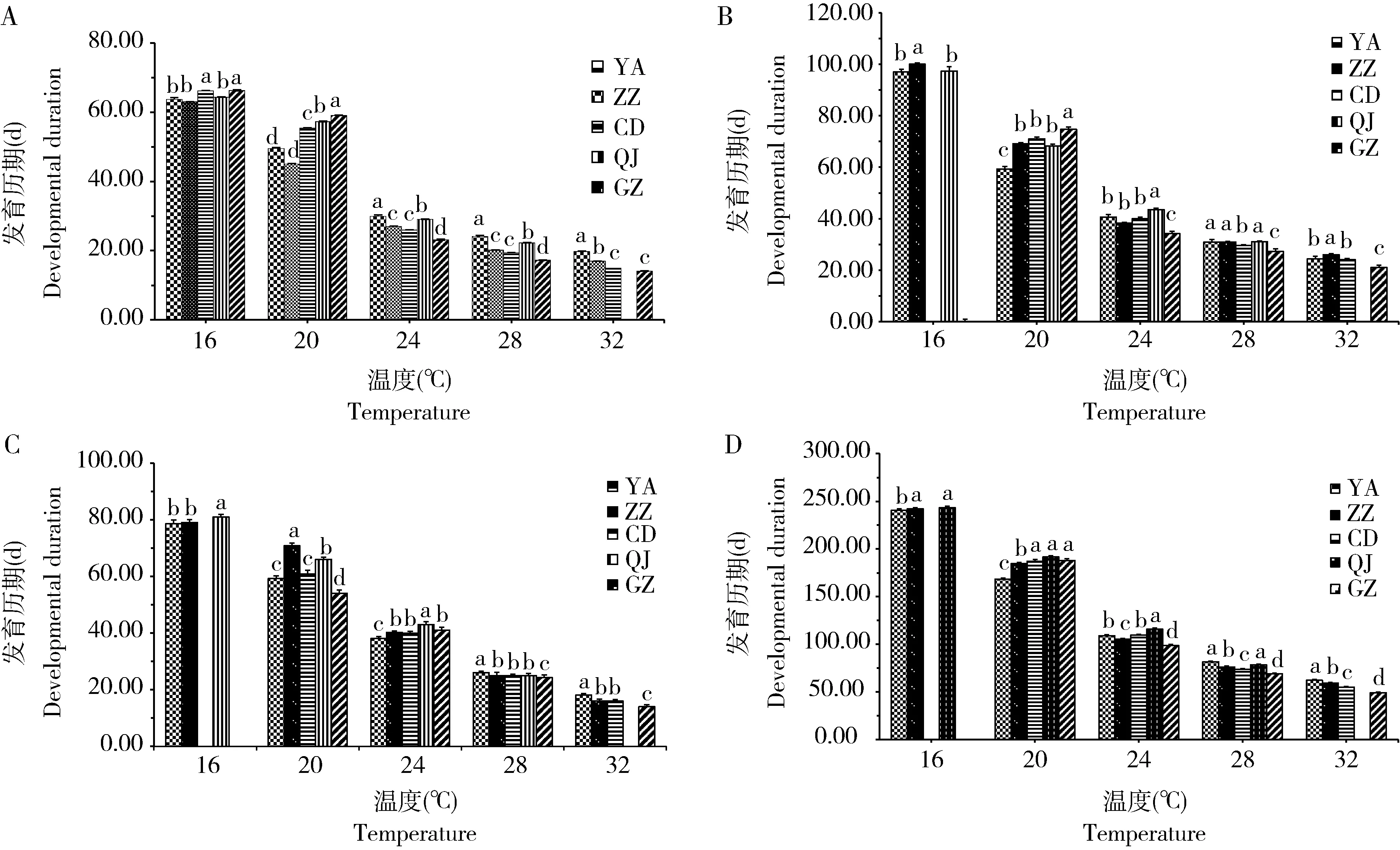
图2 不同温度下短额负蝗各虫态发育历期Fig. 2 Developmental duration of various developmental stages of Atractomorpha sinensis under different temperaturesA: 卵Egg; B: 若虫Nymph; C: 成虫Adult; D: 世代Generation. 种群信息见表1;下同。For population information, see Table 1. The same below.
2.1.2不同地理种群短额负蝗各发育阶段发育速率及其与环境温度间关系:不同地理种群短额负蝗各发育阶段的发育速率与温度间关系结果见图3。在16~32℃范围间,不同地理种群各虫态发育速率均随着温度升高加快,世代完成时间随之缩短,但不同种群间存在显著差异。温度高于20℃时,各发育阶段发育速率快速上升,延安、郑州、成都、曲靖、广州种群的卵期、若虫期和成虫期发育速率差异均显著(卵期: 24℃,F4,495=1 122.713,P<0.05; 28℃,F4,495=1 091.964,P<0.05; 32℃,F3,396=3 951.025,P<0.05; 若虫期: 24℃,F4,315=63.733,P<0.05; 28℃,F4,281=24.184,P<0.05; 32℃,F3,175=27.905,P<0.05; 成虫期: 24℃,F4,311=3.440,P<0.05; 28℃,F4,272=4.039,P<0.05; 32℃,F3,171=7.905,P<0.05)。可以看出,短额负蝗较低纬度的广州种群和成都种群在20℃以下低环境温度生长发育速度显著低于郑州、延安和曲靖种群,而在28℃以上高环境温度生长发育速率则显著高于郑州、延安和曲靖种群。
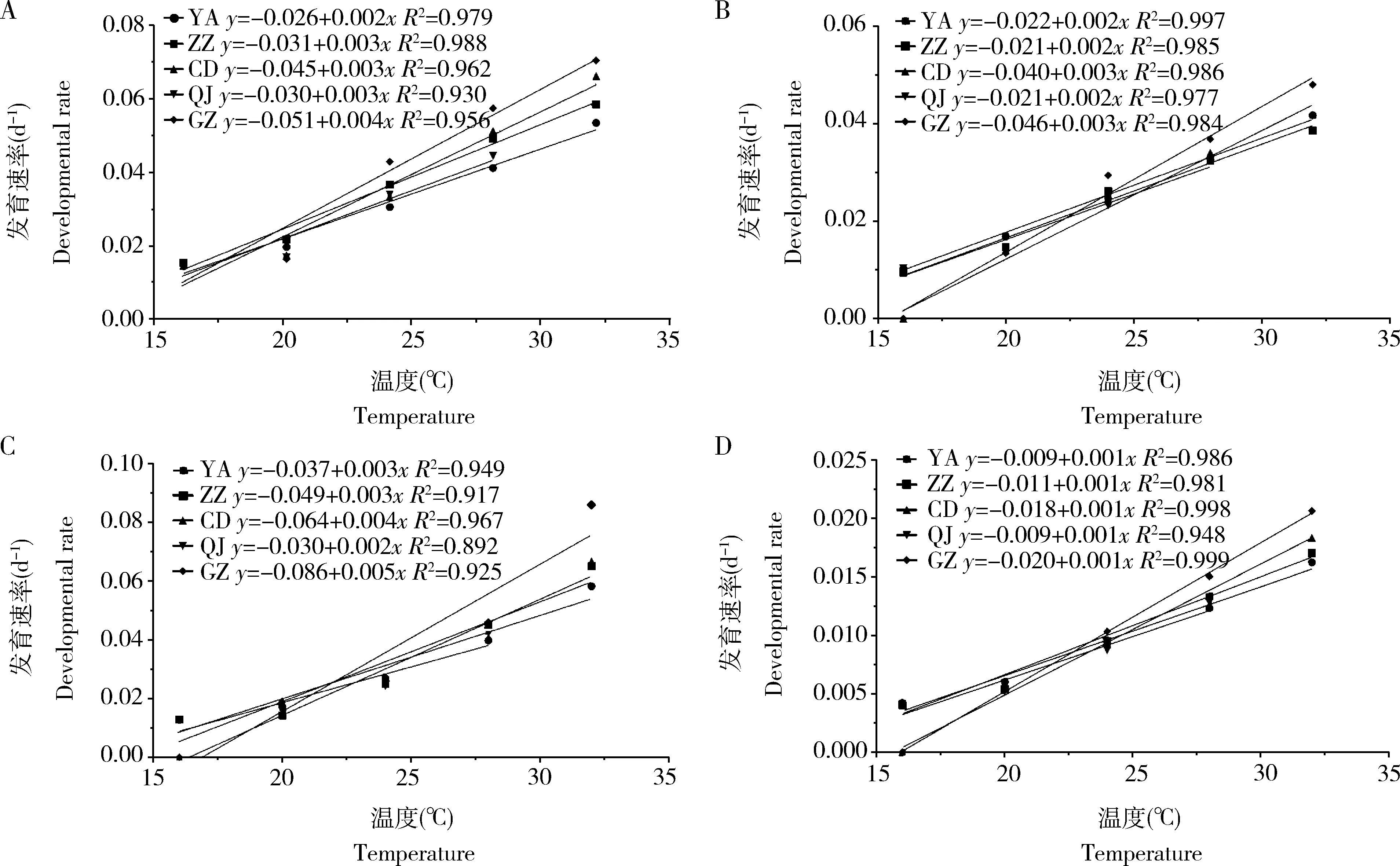
图3 不同温度下短额负蝗各虫态发育速率Fig. 3 Developmental rates of various developmental stages of Atractomorpha sinensis under different temperaturesA: 卵Egg; B: 若虫Nymph; C: 成虫Adult; D: 世代Generation.
2.2 不同地理种群各发育阶段的发育起点温度与有效积温
不同地理种群短额负蝗各发育阶段的发育起点温度与有效积温结果见表2。不同种群间各发育阶段的发育起点温度和有效积温均存在差异。5个种群的卵期、世代发育起点温度差异均显著(卵期:F4,10=66.696,P<0.05; 世代:F4,10=166.281,P<0.05),而曲靖、郑州和延安种群之间(F2,6=3.324,P>0.05),以及广州与成都种群间(F=1.063,P>0.05)的若虫期发育起点温度差异则不显著;成虫期发育起点温度的趋势与若虫期相近,曲靖与延安种群之间(F=3.079,P>0.05),以及广州与成都种群间(F=1.120,P>0.05)差异也不显著。
各地理种群之间卵期有效积温也存在显著差异(F4,10=61.521,P<0.05),广州与成都种群间(F=1.825,P>0.05),曲靖、郑州与延安种群间(F2,6=2.026,P>0.05)的若虫期有效积温差异不显著。成虫期有效积温趋势与卵期相似(F4,10=27.267,P<0.05),世代周期的有效积温波动范围由大到小的趋势为:曲靖种群<延安种群<郑州种群<成都种群<广州种群,其中曲靖种群的有效积温值最大,分别是延安、郑州、成都和广州种群的1.04, 1.14, 1.54和1.79倍,各种群间世代周期有效积温均呈显著性差异(F4,10=131.279,P<0.05)。可见,不同纬度地理种群对环境温度的生理适应性也存在显著差异。
2.3 地理种群生物学特征与栖息地环境温度特征的相关性
2.3.1地理种群发育速率与栖息地环境温度(年平均气温)特征的关系:短额负蝗地理种群在不同温度下各发育阶段的发育速率与栖息地年平均气温的相关性结果见图4,各虫态的发育速率与栖息地年平均气温的关系能较好地用线性模型拟合。在20℃条件下除成虫期外,各种群的卵期、若虫期与世代发育速率均随着栖息地年平均气温升高而降低,说明种群栖息地环境气温越高(纬度越低)生长发育速度受到低环境温度的抑制越明显,种群发育历期延长。然而随着温度逐渐升高,地理种群的卵期、若虫期、成虫期及世代发育速率在28~32℃范围间与年平均气温呈正相关关系,表明种群栖息地环境气温越低(纬度越高)生长发育速度受到高环境温度的抑制越明显,种群发育历期延长。24℃下除卵期外,地理种群的若虫期、成虫期和世代的发育速率与栖息地年平均气温的线性模型方程的斜率趋近于零,表明24℃是5个地理种群比较适宜的温度。
2.3.2地理种群发育起点温度与栖息地环境温度(年平均气温)特征的关系:短额负蝗地理种群各发育阶段的发育起点温度与栖息地年平均气温相关性结果见图5。卵期、若虫期、成虫期、世代的发育起点温度与栖息地年平均气温的线性方程分别为:y卵=5.853+0.355x,R2=0.924,P=0.0092;y若虫=3.931+0.511x,R2=0.792,P=0.0431;y成虫=5.878+0.465x,R2=0.696,P=0.0788;y世代=4.119+0.522x,R2=0.747,P=0.050,各直线方程的斜率均>0。可见,地理种群各虫态发育起点温度均与其栖息地年平均气温呈显著正相关,即随栖息地年平均气温升高而逐渐升高。
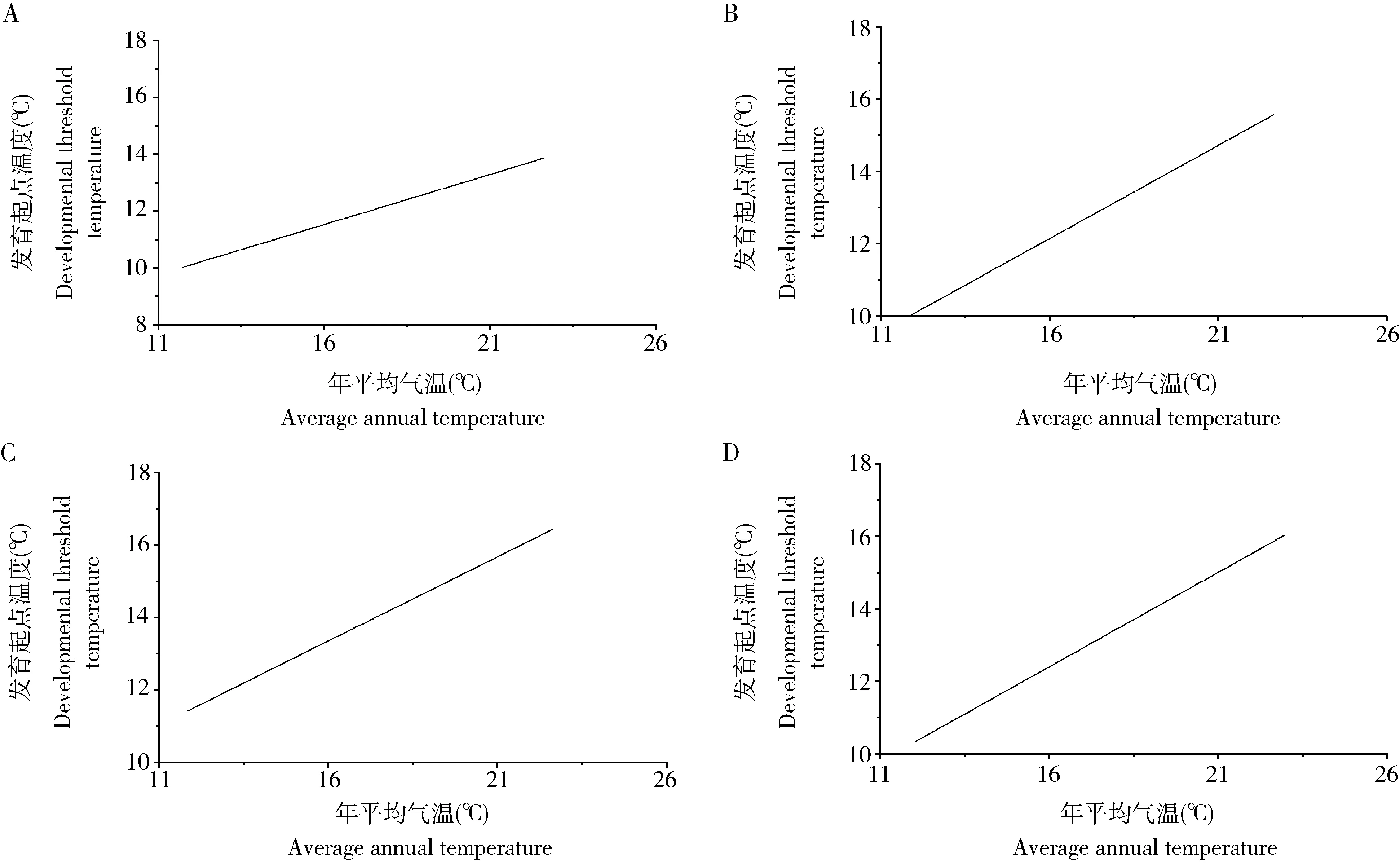
图5 短额负蝗各虫态发育起点温度与栖息地年平均气温关系Fig. 5 Relationship between developmental threshold temperature of Atractomorpha sinensis at various developmental stagesand average annual temperature of habitatA: 卵Egg; B: 若虫Nymph; C: 成虫Adult; D: 世代Generation.
2.3.3地理种群有效积温与栖息地年平均气温特征的关系:短额负蝗地理种群各发育阶段的有效积温与栖息地年平均气温相关性结果见图6。卵期、若虫期、成虫期和世代的有效积温与栖息地年均气温的线性方程分别为:y卵=630.60-16.55x,R2=0.946,P=0.0054;y若虫=849.90-22.51x,R2=0.741,P=0.0610;y成虫=654.10-17.69x,R2=0.612,P=0.1180;y世代=2 214.00-62.06x,R2=0.729,P=0.0661,各直线方程的斜率均<0。可见,地理种群各发育阶段的有效积温与其栖息地年平均气温呈显著负相关,即随栖息地年均气温升高呈降低趋势。

图6 短额负蝗各虫态有效积温与栖息地年平均气温关系Fig. 6 Relationship between effective accumulated temperature of Atractomorpha sinensis at various developmental stagesand average annual temperature of habitatA: 卵Egg; B: 若虫Nymph; C: 成虫Adult; D: 世代Generation.
3 讨论
温度是影响昆虫种群生长发育所必需的非生物因子,影响包含发育历期、发育速率、发育起点温度等在内的生物学参数(Brustetal., 2009; Wangetal., 2013; Lindmarketal., 2018)。昆虫都具有利于其种群生存繁殖的适温区间(张晨等, 2019)。昆虫栖息地的环境温度变化常常呈现出纬度梯度,迫使昆虫为适应环境的变更进化出不同生长发育策略,广布种昆虫表现出的生活史地理差异就被视为环境因素与种群遗传性状相互作用的结果(Taylor, 1981; Quetal., 2011; Huangetal., 2013; Golikhajehetal., 2018)。已有大量研究阐明昆虫不同地理种群的发育历期存在差异,且高纬度种群发育历期常常长于低纬度种群,例如在19~31℃范围内,灰飞虱Laodelphaxstriatellus若虫期与栖息地纬度呈负相关(朱文超等, 2014);异色瓢虫Harmoniaaxyridis3个地理种群的卵期均随纬度升高而延长(曲淑贤, 2016)。但是有的昆虫发育历期却出现相反趋势,在29°02′~41°20′N范围内棉铃虫Helicoverpaarmigera各种群的幼虫发育历期随着纬度升高而缩短(陈元生, 2017)。本研究结果表明,在16~32℃范围内,同一种群短额负蝗各发育阶段的发育历期均随温度升高而缩短,但温度低于20℃以下时高纬度种群世代发育历期明显短于低纬度种群。随着温度升高,不同种群的各发育阶段发育速率与栖息地年平均气温皆呈显著正相关,较低纬度(广州)种群在32℃条件下的发育速率明显快于较高纬度种群。
地理环境温度特征除受纬度影响外还与海拔有关,一般同纬度地域海拔越高气温越低。我国气候属季风性气候,冬夏两季大部分地区分别受蒙古高压与热带洋面上的副热带高压的控制,造成季节性气温的空间分布存在不同的规律,传统模型理论上认为动植物在海拔上的分布差异应与在地理纬度上的分布差异接近。周婉诗等(2020)对Blandford等(2008)建立的海拔与纬度相互关系模式进行了校正,即纬度北移1°温度下降约0.7℃,海拔每上升100 m,大尺度(年平均)温度下降约0.3℃,小气候温度下降约0.8℃,相当于海拔每升高233.33 m纬度增加1°大尺度环境温度效应,海拔每升高87.50 m纬度增加1°小气候环境温度效应。昆虫体内热量需求与其栖息环境温度密切相关,一般而言,随着地理纬度增加,发育起点温度降低,有效积温增加,二者呈负相关关系(Trudgill, 1995; Honěk, 1996; Chenetal., 2017)。短额负蝗不同地理种群各虫态的发育起点温度与栖息地年平均气温呈显著正相关,而有效积温则相反,表现为发育起点温度随纬度升高而降低,有效积温则随纬度升高而增加的趋势,符合上述一般规律。其中,卵的发育起点温度最低,说明卵的耐低温能力强于其他虫态,且随着种群栖息环境纬度的升高而呈降低趋势,从广州种群的13.66℃降低至延安种群的9.89℃,这应该与负蝗以卵在土中越冬的生物学特征有关。关于短额负蝗发育起点温度的研究鲜有报道,韩凤英(1999)研究发现短额负蝗太原(37°54′N)种群卵的发育起点温度为4.47℃,虽然与本研究结果中和太原纬度接近的延安(36°35′N)种群存在较大差异,但仍然符合上述规律。此外,本研究中曲靖种群所处纬度虽然低于成都,但因曲靖的海拔比成都高1 393 m,相当于与成都同海拔高度大尺度温度特征的纬度北移了5°97′(等于31°14′N),从而高于成都的30°34′N;比郑州海拔高1 759 m,相当于与郑州同海拔高度大尺度温度特征的纬度北移了7°54′(等于32°71′N),从而低于郑州的34°44′N,而曲靖的年平均气温15.50℃,介于成都的17.03℃与郑州的14.78℃之间;从小尺度(小生境)看,曲靖相当于与郑州同海拔高度小尺度(小生境)温度特征的纬度北移了20°10′(等于45°27′N),从而高于郑州的34°44′N,导致其短额负蝗种群世代发育起点温度(10.76℃)低于郑州种群的11.46℃,有效积温(1 482.94 d·℃)则高于郑州种群的1 295.80 d·℃。短额负蝗不同地理种群各发育阶段的有效积温与其栖息地年平均气温呈显著负相关,发育起点温度与其栖息地年平均气温呈显著正相关,较低纬度的广州(23°07′N)和成都(30°34′N)种群在20℃较低环境温度下生长发育速度显著低于较高纬度的郑州(34°44′N)、延安(36°35′N)种群和纬度较低而较高海拔的曲靖(25°17′N;1 878 m)种群,而在28℃以上较高环境温度生长发育速率则显著高于较高纬度的郑州、延安和较高海拔的曲靖种群。16℃条件下,低纬度的成都和广州种群则不能完成个体生长发育。32℃条件下,高海拔的曲靖种群亲代雌虫则不能产卵。短额负蝗这一环境温度适应性结果符合栖息地温度与纬度海拔关系的传统认知。通常生活在高纬度地区昆虫的耐低温能力更强,例如桃蚜Myzuspersicae寒带地区种群的耐寒性明显高于温带地区种群(Hazell, 2010)。Jing和Kang(2003)比较28°13′-40°06′N范围内的东亚飞蝗Locustamigratoria种群卵的耐寒性时发现北方种群耐低温能力也较强于南方种群。本研究结果进一步明确了短额负蝗不同地理种群对较低环境温度适应能力总体随着种群栖息地纬度和海拔上升而增强,发育速率温度随栖息地年均气温升高而逐渐升高,而对较高环境温度的适应能力则相反。在全球气候变暖的大趋势下,相比20世纪,21世纪全球温度上升速率提高了近1倍(Karletal., 2015),高纬度及高海拔地区的气温升幅更加明显(Peuelasetal., 2013)。短额负蝗种群分布将进一步向高纬度高海拔地区扩展。这些结果与自然选择下昆虫环境适应性甚至与遗传分化密切相关(Bubliy, 2002; Pengetal., 2017)。
根据害虫种群发育起点温度和有效积温可预测其分布区域范围及某一分布区域可能发生的世代数。李新畅等(2018)通过有效积温法推算了豆卷叶螟在海南三亚地区理论发生代数与实际发生代数基本一致。关于短额负蝗生活史研究发现,山西大同每年发生1代(及尚文等, 1995),河北白洋淀、山东滨州地区每年可发生1~2代(李虎群等, 2008; 田方文, 2005),安徽宣城每年发生2代(杨辅安等, 1996),江西莲塘地区可发生2~3代(陈茂才, 1965; 杨辅安等, 1996)。其中山西大同纬度40°14′N,海拔1 026 m与陕西延安纬度36°35′N,海拔1 270 m的地理环境特征相比偏北,根据作物生长季节5-9月份的月平均气温,按延安种群世代发育起点温度和有效积温推算,短额负蝗在山西大同可发生0.9个世代;而河北白洋淀纬度38°56′N,海拔11 m,与陕西延安的地理环境特征相比偏南,根据作物生长季节4-10月份的月平均气温,按延安种群世代发育起点温度和有效积温推算,短额负蝗在河北白洋淀可发生1.6个世代;安徽宣城参照成都推算可发生世代数为1.9个世代;江西莲塘参照广州推算可发生世代数为2.5个世代。可见,根据本研究结果推算上述各地短额负蝗发生世代数与上述文献报道基本吻合。
本研究结果表明,短额负蝗种群发育起点温度随栖息地环境年平均气温升高而升高,有效积温则随栖息地环境年平均气温升高而降低,表现为对低环境温度的适应能力总体随着种群栖息地纬度和海拔上升而增强,而对较高环境温度的适应能力则相反。该结果可为不同地区田间预测该害虫种群动态,制定防治措施提供科学依据。关于短额负蝗地理种群因适应不同环境温度而产生遗传分化等分子机制有待深入研究。

