家蚕BmlncR2036调控P25基因启动子活性及参与中肠发育调控
霍春月, 程 浩, 付 裕, 常美玲, 王 艺, 阚云超, 李丹丹
(南阳师范学院, 河南省伏牛山昆虫生物学重点实验室, 河南南阳 473061)
长链非编码RNA (long non-coding RNA, lncRNA)是长度大于200 nt不编码蛋白质的一大类RNA。lncRNA依据其在基因组上的位置可分为五大类(Jarrouxetal., 2017):反义lncRNA (Katayamaetal., 2005; Heetal., 2008; Faghihi and Wahlestedt, 2009; Weryetal., 2018)、双向lncRNA(Hamazakietal., 2017)、增强子相关lncRNA (Kimetal., 2010; Wangetal., 2011; Dingetal., 2018)、基因间lncRNA(Guttmanetal., 2009; Cabilietal., 2011; Ulitskyetal., 2011; Ulitsky and Bartel, 2013)和假基因lncRNA (Balakirev and Ayala, 2003; Pinketal., 2011; Tutar, 2012)。lncRNA能够在表观遗传学水平调控基因表达,参与生物体生长、发育、生殖、分化等过程(Engreitzetal., 2016b; Kim and Shiekhattar, 2016; Robinsonetal., 2020),如:改变DNA甲基化、组蛋白修饰状态(Akhadeetal., 2017; Dykes and Emanueli, 2017),作为酶的辅因子调控转录因子活性,与编码蛋白质的mRNA形成双链杂交体干预mRNA的剪切,参与调节mRNA稳定性(Engreitzetal., 2016a),作为内源竞争RNA (competing endogenous RNAs, ceRNA)与miRNA竞争性结合mRNA,作为小分子RNA的前体(Tayetal., 2014)等。最近研究表明,一些lncRNA能够编码小肽,表明它们可能兼具肽编码能力和非编码RNA功能(Rohrigetal., 2002; Andersonetal., 2015; Nelsonetal., 2016; Legninietal., 2017; Matsumotoetal., 2017; Razookyetal., 2017; Linetal., 2020; Wuetal., 2020; 赵念念等, 2020)。
家蚕Bombyxmori是鳞翅目的模式昆虫,丝腺作为重要的产丝场所,在其经济价值实现中具有重要作用。蚕丝蛋白由丝素和丝胶两种成分组成,丝素在后部丝腺合成,编码丝素蛋白的基因主要有Fib-L,Fib-H和P25;丝胶在中部丝腺分泌,编码丝胶蛋白的基因主要有Ser1,Ser2和Ser3 3种 (Yamaguchietal., 1989; Inoueetal., 2000; Asakuraetal., 2007)。宋菲等(2014)发现miR-2739对丝素重链基因Fib-H的表达具有调控作用;Huang等(2011)发现miR-2b与P25基因在表达上存在着相反的关系,可能调控P25基因的表达。另外Qian等(2018, 2020)发现miR-2780a和miR-275能够特异性存在于中部丝腺中,靶向调控丝胶蛋白基因Ser1和Ser2的表达。长链非编码RNA作为一种重要的调控因子,在家蚕变态发育及抗病毒过程中发挥重要作用,目前在家蚕中已发现10 000余条lncRNA序列(Wuetal., 2016; Zhouetal., 2016, 2018; Dykes and Emanueli, 2017; Yinetal., 2020)。来源于家蚕性别决定基因dsx反义链上的lncRNA Bmdsx-AS1能够参与dsx基因的选择性剪接(Xuetal., 2019)。感染核型多角体病毒(nuclear polyhedrosis virus, NPV)后,家蚕中4 450个lncRNAs出现显著差异表达,其中上调表达2 837个和下调表达1 613个,表明lncRNA参与了家蚕病毒感染过程(Yinetal., 2020)。另外,lncRNA可作为miRNA的ceRNA发挥调控作用,Wu等(2016)从家蚕基因组中获得11 810个lncRNA,其中104个lncRNA具有内源竞争性RNA的潜力,可能作为ceRNA发挥作用。
在前期研究中我们构建了家蚕4龄眠和5龄第3天幼虫丝腺非编码RNA文库,发现了大量lncRNA在这两个龄期的丝腺中存在显著差异表达,其中在5龄第3天幼虫丝腺中高表达的一个lncRNA BmlncR2036位于丝素基因P25上游,可能参与P25基因的调控。为进一步探索BmlncR2036在家蚕丝腺及变态发育中的功能,本研究对其在家蚕幼虫不同组织和不同发育阶段丝腺中的表达谱进行了鉴定,同时对BmlncR2036作为ceRNA的功能和参与P25基因启动子调控的机制进行了初步研究,最后在家蚕个体中干涉BmlncR2036表达,对其参与家蚕丝腺及中肠发育调控的机制进行了初步探索,为进一步研究lncRNA功能提供了实验证据。
1 材料与方法
1.1 试虫来源
家蚕品系为大造P50,由中国农业科学院蚕业研究所李木旺研究员惠赠。
1.2 家蚕饲养及取样
家蚕饲养在温度25℃,相对湿度60%,光周期12L∶12D,用新鲜桑叶饲养。取5龄第3天家蚕幼虫,解剖后收集体壁、脑、神经、精巢、卵巢、丝腺、马氏管、血淋巴、脂肪体和中肠10种组织,分别置于液氮中速冻保存。取4龄第3天幼虫、4龄眠和5龄第1-2天幼虫,解剖后取整个丝腺速冻于液氮中;取5龄第3-5天幼虫及5龄熟蚕解剖虫体,将丝腺分为前丝腺、中丝腺和后丝腺3个部分,分别置于液氮中速冻保存。
1.3 qPCR检测BmlncR2036的表达谱
在前期构建的家蚕4龄眠和5龄第3天丝腺非编码RNA文库中,发现一个高表达的lncRNA BmlncRNA2036位于P25上游9.47 kb的互补链上,转录方向与P25相反(王立方, 2015)。BmlncR2036及P25基因表达谱检测同杨宗霖等(2019)方法:将1.2节各样品用TRIzol法提取总RNA,取总RNA 2 μg使用PrimeScriptTMII 1st Strand cDNA Synthesis Kit(TaKaRa)合成cDNA第1链。基于内参基因actin, BmlncR2036及P25基因序列用Primer Premier 5.0软件设计引物,PCR反应体系: cDNA 0.5 μL, 上下游引物终浓度为0.5 μmol/L, FastStart Universal SYBR Green Mix (Roche) 5 μL。PCR反应条件: 95℃变性30 s, 5℃退火30 s, 72℃延伸30 s, 40个循环。所用引物及miRNA模拟物见表1。实验设置生物学重复3次,每个样品技术重复3次。
1.4 靶向P25基因和BmlncR2036的miRNA预测
使用miRanda(Enrightetal., 2003)和RNAhybrid(Rehmsmeieretal., 2004)软件预测能够同时靶向P25基因和BmlncR2036的miRNA。
1.5 荧光素酶检测法检测miRNA与P25基因的体外互作
P25基因3′UTR荧光素酶报告基因载体psiCHECK-2[P25]构建同杨宗霖等(2019)。以家蚕5龄幼虫后丝腺RNA为模板,使用PrimeScriptTMII 1st Strand cDNA Synthesis Kit (TaKaRa)合成cDNA第1链,扩增P25基因3′UTR 413 bp序列,引物序列见表1。PCR反应体系(20 μL): cDNA 1 μL, 上下游引物终浓度为0.5 μmol/L, Premix Ex TaqTMHot Start Version (TaKaRa) 10 μL。PCR反应条件: 95℃变性30 s, 55℃退火30 s, 72℃延伸1 min, 30个循环。使用琼脂糖凝胶DNA回收试剂盒(Axygen)回收目的条带,连接pMD19-T Simple载体(TaKaRa)。转化后,菌液PCR检测连接效果,送菌液至苏州泓迅生物科技股份有限公司测序。测序正确的菌液提质粒,用XhoⅠ和NotⅠ双酶切后连接到psiCHECK-2荧光素酶报告基因载体(Promega)上。经转化、菌液PCR检测、测序等步骤确定载体是否构建成功。测序正确的菌液重新摇菌,用去内毒素质粒提取试剂盒(Omega)提取质粒。
基于miR-2739和miR-279a成熟miRNA序列设计引物,由上海吉玛制药技术有限公司合成miRNA mimics和阴性对照(NC),引物序列见表1。
细胞转染及荧光素酶测定方法同杨宗霖等(2019)。人胚胎肾细胞HEK293T细胞(由衡阳师范学院唐青海博士惠赠)在含有10%胎牛血清(Gibco)的DMEM培养基(Biological Industry)中培养瓶传代培养,温度37℃,CO2浓度5%。按每孔2×105个细胞铺24孔板,使用X-tremeGENE siRNA Transfection Reagent(Roche)转染miRNA mimics和P25基因荧光素酶报告基因载体。miRNA mimics转染浓度为100 nmol/孔,P25基因荧光素酶报告基因载体质粒转染浓度为100 ng/孔。实验设置5组:无任何处理的HEK293T细胞;转染psiCHECK-2[P25]空载体;共转染psiCHECK-2[P25]与miR-2739 mimics;共转染psiCHECK-2[P25]与NC mimics;共转染psiCHECK-2[P25]与miR-279amimics。每组设样品重复3个,实验重复3次。转染48 h后,用细胞裂解液裂解细胞,取20 μL细胞裂解液按照双荧光素检测试剂盒Steady-Glo® Luciferase Assay System(Promega)步骤,检测样品荧光值。P25基因位于Firefly荧光素酶基因下游,因此用获得的Firefly荧光素酶活性(F)/内参Renilla荧光素酶活性(R),获得每组3个样品及3个重复的R/F值,均一化后用Excel软件进行作图(杨宗霖等, 2019)。
1.6 P25基因启动子活性检测
BmlncR2036位于P25基因上游,那么其可能通过影响P25基因启动子活性参与P25基因表达调控。取家蚕5龄熟蚕后丝腺,用DNAzol(MRC)提取基因组DNA,参照Nony等(1995)方法,使用表1引物扩增P25基因上游1 251 bp序列,构建P25基因启动子区荧光素酶报告基因载体。PCR反应体系及反应条件同1.5节,目的条带回收,连接pMD19-T Simple载体,测序,测序正确的菌液提质粒,用KpnⅠ和HindⅢ双酶切后连接在pGL3-Enhancer载体(Promega)上,构建P25基因启动子载体pGL3-Enhancer[P25-promoter],经转化、菌液PCR检测、测序等步骤确定载体是否构建成功。测序正确的菌液重新摇菌,用去内毒素质粒提取试剂盒(Omega)提取质粒备用。
取家蚕5龄熟蚕后丝腺RNA反转录cDNA,使用表1引物扩增BmlncR2036基因全长704 bp序列。PCR反应体系及反应条件同1.5节,目的条带回收,连接pMD19-T Simple载体,测序,测序正确的菌液提质粒,用KpnⅠ和EcoRⅠ双酶切后连接在pcDNA3.1(+)载体(Promega)上构建BmlncR2036过表达载体pcDNA3.1(+)[BmlncR2036],经转化、菌液PCR检测、测序等步骤确定载体是否构建成功。测序正确的菌液重新摇菌,用去内毒素质粒提取试剂盒(Omega)提取质粒备用。
HEK293T细胞培养及铺板同1.5节,实验设置2组:共转染pGL3-Enhancer [P25-promoter]和pcDNA3.1(+)空载体组;共转染pGL3-Enhancer [P25-promoter]和pcDNA3.1(+)[BmlncR2036]组。每组设样品重复3个,实验重复3次。转染48 h后,取100 μL细胞,按照Steady-Glo® Luciferase Assay System (Promega)步骤检测萤火虫荧光素酶活性,检测BmlncR2036对P25基因启动子活性的影响,P25基因启动子连接在萤火虫荧光素酶基因上游,因此比较获得的每组3个样品及3个重复的Firefly荧光素酶活性(F),均一化后用Excel软件进行比较作图。
1.7 RNAi干涉BmlncR2036
取家蚕5龄熟蚕后丝腺RNA,使用表1带有T7启动子的引物扩增BmlncR2036基因351 bp片段,PCR反应体系(20 μL): cDNA 1 μL, 上下游引物终浓度为0.5 μmol/L, Premix TaqTM(Ex TaqTMVersion 2.0, TaKaRa) 10 μL。PCR反应条件: 95℃变性30 s, 55℃退火30 s, 72℃延伸30 s, 30个循环。用PCR产物纯化试剂盒(Axygen)纯化目的片段,用T7体外转录试剂盒(Promega)转录合成dsRNA,体系(20 μL):带T7启动子的BmlncR2036基因PCR产物0.5~1 μg, 2×T7 Buffer 10 μL, Enzyme Mix 2 μL。37℃反应30 min,70℃ 10 min,室温20 min使反转录的RNA形成双链。DNase (Thermo Fisher) 37℃ 30 min去除模板DNA。体外转录dsRNA用等体积的异丙醇进行浓缩纯化。阴性对照为EGFP基因,以piggyBac[EGFP]载体为模板扩增携带有T7启动子的EGFP基因,其dsRNA合成方法同上。
选择家蚕5龄第3天幼虫,利用显微注射针将dsRNA沿背部血淋巴注射入家蚕体内,每头注射5 μg,每个基因注射3组,每组5头。48 h后取家蚕个体,解剖虫体,除去肠道内容物,将虫体分为丝腺和非丝腺两部分,液氮研磨,TRIzol法提取RNA,qPCR检测dsRNA干涉效果。qPCR检测同杨宗霖等(2019)方法:分别取注射BmlncR2036和EGFPdsRNA的丝腺或非丝腺样品总RNA 2 μg,使用PrimeScriptTMII 1st Strand cDNA Synthesis Kit(TaKaRa)合成cDNA第1链。内参基因为actin。PCR反应体系(10 μL): cDNA 0.5 μL, 上下游引物终浓度为0.5 μmol/L, FastStart Universal SYBR Green Mix (Roche) 5 μL。PCR反应条件: 95℃变性30 s, 55℃退火30 s, 72℃延伸30 s, 40个循环。所用引物见表1。qPCR实验设置生物学重复3次,每样品技术重复3次。未取样幼虫饲养至羽化,发现长势缓慢或形态异常幼虫,解剖虫体,观察RNAi处理后家蚕丝腺及中肠形态及内容物的变化。
1.8 数据分析
数据分析同杨宗霖等(2019)方法。PCR结果采用2-ΔΔCt法计算相对表达量高低,Ct为循环阈值,表示每一个反应管内的荧光信号到达设定的阈值时所经历的循环数,ΔCt=目的基因的平均Ct值-内参基因的平均Ct值,ΔΔCt=ΔCt处理样本-ΔCt对照样本。实验独立生物学重复3次,每样品测定技术重复3次,数据为3次独立生物学实验平均值分析结果。数据采用SPSS Statistics 22.0软件进行处理,以平均值±标准误表示,并采用单因素方差分析和t检验检测不同处理间的差异显著性。
2 结果
2.1 BmlncR2036在家蚕幼虫不同组织及不同发育阶段丝腺中的表达谱
qPCR检测结果表明BmlncR2036在家蚕5龄第3天幼虫和5龄熟蚕的后丝腺中高表达(图1: B),与P25基因在后丝腺高表达(Zhongetal., 2005; Maetal., 2013)呈现较一致的表达趋势。BmlncR2036在家蚕5龄第3天幼虫不同组织中的表达谱表明,BmlncR2036除在精巢和中肠中高表达外,在其他组织中表达量较低(图1: A),表明lncRNA BmlncR2036可能具有多样化的功能。
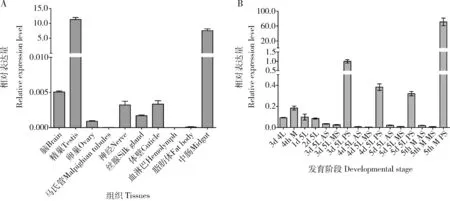
图1 qPCR检测BmlncR2036在家蚕5龄幼虫不同组织(A)和不同龄期丝腺(B)中的表达谱Fig. 1 Expression profiles of BmlncR2036 in different tissues of the 5th instar larvae (A) and silk glandsat different developmental stages (B) of Bombyx mori by qPCR3d 4L: 4龄第3天幼虫Day-3 4th instar larva; 4th M: 4龄眠4th instar molting larva; 1-5d 5L: 分别为5龄第1-5天幼虫Day-1-5 5th instar larvae, respectively; AS: 前丝腺Anterior silk gland; MS: 中丝腺Middle silk gland; PS: 后丝腺Posterior silk gland; 5th M: 5龄熟蚕Mature 5th instar larva. 4龄第3天、4龄眠和5龄第1-2天幼虫取整个丝腺。The whole silk gland was sampled from the day-3 4th instar larvae, 4th instar molting larvae and day-1-2 5th instar larvae. 图中数据为平均值±标准误。Data in the figure are mean±SE.
2.2 靶向P25基因和BmlncR2036的miRNA
预测结果表明,在靶向P25基因的miRNA中,能与BmlncRNA2036匹配的主要有miR-2739和miR-279a。为进一步验证P25基因与两个miRNA是否存在互作,我们利用荧光素酶检测系统体外验证二者的互作。首先构建靶标基因P25 3′UTR区荧光素酶报告基因过表达载体psiCHECK-2[P25],P25 3′UTR扩增结果如图2(A)所示,PCR产物电泳条带单一(条带1),413 bp位置正确。psiCHECK-2[P25]双酶切结果为条带2,能够酶切出正确的P25 3′UTR条带,测序结果正确。共转染miR-2739和miR-279a模拟物和P25 3′UTR过表达载体psiCHECK-2[P25]后,细胞荧光素酶活性与NC相比无显著变化 (图2: B),表明P25不是miR-2739和miR-279a的真实靶标。
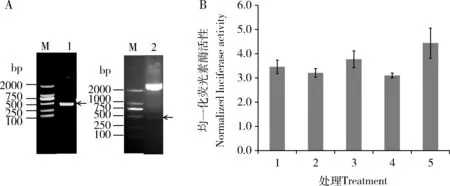
图2 荧光素酶检测系统体外验证P25基因与miRNAs的互作Fig. 2 Verification of the interaction between P25 gene and miRNAs by luciferase assay in vitroA: P25 3′UTR PCR扩增结果及psiCHECK-2[P25]酶切结果PCR amplification result of P25 3′UTR and the double digestion result of psiCHECK-2[P25]; M: DL2000 marker; 1: P25 3′UTR扩增产物 Amplification product of the 3′UTR of P25 gene; 2: 载体psiCHECK-2[P25]双酶切结果Double digestion result of psiCHECK-2[P25] vector. B: HEK293细胞系中荧光素酶活性实验检测miR-2739和miR-279a与靶基因P25的互作Verification of interaction between target gene P25 and miR-2739 and miR-279a by luciferase assay in HEK293 cells; 1: 无任何处理的HEK293细胞对照The normal HEK293 cells as the control; 2: 转染psiCHECK-2[P25]载体Transfected with psiCHECK-2[P25]; 3: 共转染psiCHECK-2[P25]+miR-2739 mimics Cotransfected with psiCHECK-2[P25] and miR-2739 mimics; 4: 共转染psiCHECK-2[P25]+NC mimics Cotransfected with psiCHECK-2[P25] and NC mimics; 5: 共转染psiCHECK-2[P25]+miR-279a mimics Cotransfected with psiCHECK-2[P25] and miR-279a mimics. 图中数据为平均值±标准误。Data in the figure are mean±SE.
2.3 BmlncR2036对P25启动子活性的影响
P25启动子序列和BmlncR2036扩增结果如图3(A)所示,PCR产物电泳条带单一,位置正确。pGL3-Enhancer [P25-promoter]和pcDNA3.1(+) [BmlncR2036]双酶切结果如图3(B),能够酶切出正确的P25启动子条带和BmlncR2036全长,测序结果正确。在HEK293T细胞中共转染pGL3-Enhancer [P25-promoter]和pcDNA3.1(+) [BmlncR2036]后,细胞中BmlncR2036实现显著过表达(图3: C)。细胞荧光素酶活性比单独转染pGL3-Enhancer [P25-promoter]细胞的下降了52% (图3: D),达极显著水平(P<0.01),表明BmlncR2036对P25启动子区存在负调控作用。
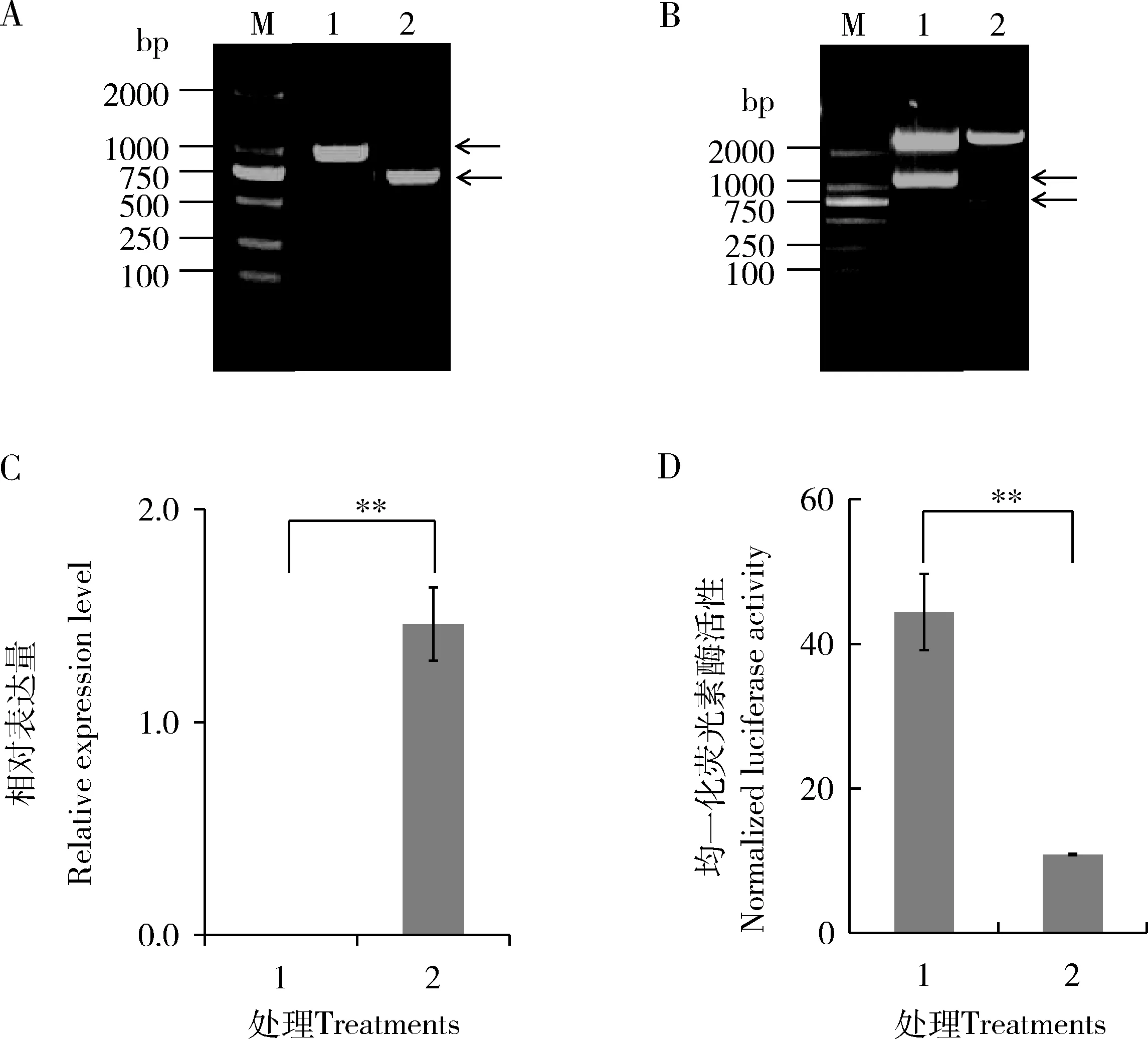
图3 BmlncR2036和P25启动子互作结果Fig. 3 Interaction result of BmlncR2036 and the promoter of P25A: P25启动子和BmlncR2036全长PCR扩增结果 PCR result of P25 promoter and the full-length of BmlncR2036; M: DL2000 marker; 1: P25 启动子扩增产物 Amplification product of the promoter of P25 gene; 2: BmlncR2036全长扩增产物 Amplification product of the full-length of BmlncR2036. 箭头示PCR扩增产物Arrows show PCR products. B: 载体pGL3-Enhancer [P25-promoter]和pcDNA3.1(+)[BmlncR2036]双酶切鉴定Double digestion of vectors pGL3-Enhancer [P25-promoter] and pcDNA3.1(+)[BmlncR2036]; M: DL2000 marker; 1: pGL3-Enhancer [P25-promoter]双酶切产物Double digestion product of pGL3-Enhancer [P25-promoter]; 2: pcDNA3.1(+)[BmlncR2036]双酶切产物Double digestion product of pcDNA3.1(+)[BmlncR2036]. 箭头分别示酶切获得的P25启动子序列 1 251 bp和BmlncR2036 704 bp全长序列Arrows show the digested 1 251 bp P25 promoter sequence and 704 bp BmlncR2036 full-length sequence, respectively. C: HEK293细胞系中BmlncR2036过表达结果Overexpression result of BmlncR2036 in HEK293 cells; D: HEK293细胞系中荧光素酶活性实验检测BmlncR2036对P25基因启动子活性影响 Verification of the effect of BmlncR2036 on the promoter activity of P25 by detection of the luciferase activity in HEK293 cells; 1: 转染pGL3-Enhancer [P25-promoter]载体和pcDNA3.1(+)空载体Transfected with vector pGL3-Enhancer [P25-promoter] and blank vector pcDNA3.1(+); 2: 转染载体pGL3-Enhancer [P25-promoter]和pcDNA3.1(+)[BmlncR2036] Transfected with vectors pGL3-Enhancer [P25-promoter] and pcDNA3.1(+)[BmlncR2036]. 图中数据为平均值±标准误;柱上双星号表示差异极显著(P<0.01, 单因素方差分析, t检验)。Data in the figure are mean±SE. Double asterisk above bars represents extremely significant difference (P<0.01, one-way ANOVA, t-test). 下同The same below.
2.4 RNAi干涉家蚕幼虫中BmlncR2036表达
在家蚕5龄第3天幼虫血淋巴中注射BmlncR2036 dsRNA发现,48 h后BmlncR2036在非丝腺组织中的表达量下降了84%,丝腺组织中表达量无明显变化(图4: A)。注射BmlncRNA2036 dsRNA的家蚕个体发育迟缓,上簇后体色变暗,后逐渐死亡(图4: B),解剖后发现,中肠有大量内容物残留,马氏管颜色发白,但丝腺无明显异常(图4: C),表明BmlncR2036可能在家蚕中肠发育过程中发挥调控作用。
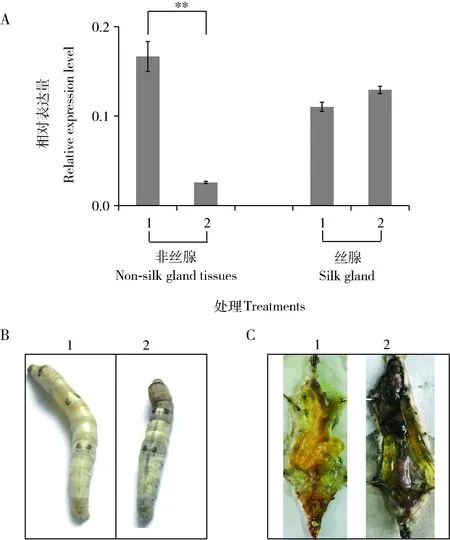
图4 家蚕5龄幼虫中通过RNAi敲低BmlncR2036表达后的结果Fig. 4 Result of knocking down the expression of BmlncR2036 in the 5th instar larvae of Bombyx mori by RNAiA: 注射dsRNA后不同组织中BmlncR2036表达结果 Expression result of BmlncR2036 in different tissues after dsRNA injection; B: 注射BmlncR2036 dsRNA后家蚕表型Phenotype of B. mori after dsRNA injection of BmlncR2036; C: 注射BmlncR2036 dsRNA后家蚕解剖结果Dissection result of B. mori after injection of BmlncR2036 dsRNA. 1: 注射EGFP dsRNA的对照Injection of EGFP as the control; 2: 注射BmlncR2036 dsRNA Injection of BmlncR2036 dsRNA.
3 讨论
我们在前期研究中从家蚕幼虫丝腺中鉴定到大量新的长链非编码RNA,并对其在丝腺发育过程的表达谱进行了研究(王立方, 2015),发现一个在丝素P25基因上游存在的lncRNA BmlncR2036在家蚕后丝腺中高表达。BmlncR2036在幼虫的后丝腺中高表达(图1: B),已知P25基因也在幼虫尤其是5龄幼虫后丝腺中富集(Zhongetal., 2005; Maetal., 2013),表明其可能作为P25的竞争性内源RNA发挥作用。通过分析其作为内源性竞争miRNA发现,同时靶向BmlncR2036和P25基因的miRNAmiR-2739和miR-279a并不能在体外与P25基因产生互作(图2: B),表明BmlncR2036可能不是通过作为miR-2739和miR-279a这两个miRNA的ceRNA对P25发挥作用,即miR-2739和miR-279a可能有其他靶标,而P25也有可能存在其他BmlncR2036起ceRNA作用的miRNA分子,具体机制还需进一步实验验证。
分析BmlncR2036对P25基因启动子活性影响发现,BmlncR2036对P25基因启动子的转录存在负调控(图3: C, D)。基因上下游存在为数众多的lncRNA,包括增强子RNA,启动子相关lncRNA,上游反义链RNA,启动子上游lncRNA,端粒重复区lncRNA等(St Laurentetal., 2015)。Wang等(2015)在骨骼肌成肌细胞中鉴定出一个位于发育多能性相关基因2 (developmental pluripotency-associated 2,Dppa2)上游的发育多能性相关基因2上游肌相关lncRNA (developmental pluripotency-associated 2 upstream binding muscle lncRNA, lncRNA-Dum),该lncRNA能够顺式募集DNA甲基转移酶1(DNA methyltransferase1, DNMT1), DNMT3A和DNMT3B等至Dppa2基因的启动子区,并造成该区域甲基化沉默,从而抑制Dppa2的表达,造成骨骼肌成肌细胞向肌细胞分化。BmlncR2036是位于P25基因上游的lncRNA,其是否具有类似的机制,还需进一步垂钓能够与BmlncR2036结合的蛋白,判断其是否通过募集蛋白至P25基因的启动子区从而参与P25基因的表达调控。因此对BmlncR2036功能的探索还需更多的实验证据。
个体中RNAi干涉BmlncR2036表达(图4: B, C),发现家蚕发育受阻,中肠内容物滞留,最后产生死亡现象,表明BmlncR2036可能具有除调控P25基因外多样化的功能,其可能参与家蚕中肠的发育调控。本研究从ceRNA和调控启动子活性两个角度探索了BmlncR2036参与家蚕发育的可能机制,为研究lncRNA的调控机制提供了实验依据,但对BmlncR2036详细的功能探索还需要更多的实验证据。

