表皮生长因子受体酪氨酸激酶抑制剂AG1478 对卵巢癌细胞生物活性及纤溶酶原激活物抑制物1 的作用机制研究△
丁伯勇,王玮,昝瑛
商洛市中心医院1肿瘤科,2妇科,陕西 商洛 726000 3西安交通大学第二附属医院肿瘤科,西安 721000
卵巢癌是女性常见的恶性肿瘤,根据中国恶性肿瘤数据分析,中国有超过5 万患者患有卵巢癌,病死率超过50%。卵巢位置隐蔽,多数患者确诊时往往失去最佳治疗时机,化学治疗成为改善卵巢癌患者预后的主要治疗方法。卵巢癌细胞生长速度快,向邻近器官及淋巴结转移较快,化疗能够通过增加肿瘤细胞DNA 链损伤而抑制DNA 复制及转录,减少卵巢癌细胞活性及生长。但是随着临床的应用,部分患者出现药物不耐受或化疗耐药,导致临床疗效较差,因此,如何抑制卵巢癌细胞增殖,加快凋亡仍是众多研究者探讨的难题。卵巢癌的产生是由多因素、多因子共同作用的结果,纤溶酶原激活物抑制物1(plasminogen activator inhibitor type 1,PAI-1)主要位于人体第7 号染色体上,是丝氨酸蛋白酶抑制物的成员之一,主要在内皮细胞中被合成,具有抑制纤溶酶原激活物,增加恶性肿瘤细胞活性的作用。卵巢癌细胞中PAI-1 表达升高,临床发现PAI-1 可以特异性结合某信号后发挥抗肿瘤细胞侵袭作用。目前,随着卵巢癌分子机制的研究,多种致癌基因及抑癌基因在肿瘤中的作用机制逐渐被阐明,靶向治疗将成为攻克卵巢癌的主要方法。在卵巢癌分子机制深入研究中,酪氨酸激酶受体家族及其转导信号的功能失常导致卵巢癌细胞生物学行为异常,表皮生长因子受体(epidermal growth factor receptor,EGFR)是酪氨酸激酶受体家族成员之一,存在酪氨酸激酶活性,能够结合表皮生长因子(epidermal growth factor,EGF)发挥细胞信号转导作用而影响细胞生物学行为。卵巢癌组织中EGFR 表达是正常组织的多倍以上,因此,EGFR 抑制剂能够成为治疗卵巢癌的潜在靶点。AG1478 是EGFR 高效选择性酪氨酸激酶抑制剂,已经证实具有抗肺癌、肝癌细胞生长及促进凋亡作用。但是关于AG1478对卵巢癌的体外干预研究比较少见,所以,本研究以此作为创新点分析AG1478 对卵巢癌细胞生物学行为及PAI-1 的作用机制。
1 材料与方法
1.1 细胞、主要试剂与仪器
CaOV-3 细胞购自上海名劲生物科技有限公司;AG1478 购自上海甄准生物科技有限公司。胎牛血清购自上海冰晴生物科技有限公司;PAI-1 抗体购自上海信裕生物科技有限公司;尿激酶型纤溶酶原激活剂受体(urokinase type plasminogen activator receptor,uPAR)抗体购自北京博迈斯科技发展有限公司;四甲基偶氮唑蓝(methyl thiazolyl terazolium,MTT)试剂盒、二甲基亚砜(dimethyl sulfoxide,DMSO)均购自金克隆(北京)生物技术有限公司;Trizol 购自北京柏莱斯特科技发展有限公司。蛋白电泳仪购自莱普特科学仪器(北京)有限公司;逆转录聚合酶链反应(reverse transcriptionpolymerase chain reaction,RT-PCR)试剂盒和仪器均购自上海康朗生物科技有限公司。
1.2 细胞培养
将低温冷藏的CaOV-3 细胞快速移入37 ℃水中溶解,3000 r/min 离心10 min(离心半径15 cm),离弃上清液,加入培养基,5%CO、37.5 ℃培养,细胞贴壁生长,1~2 天更换新的无血清培养液,细胞生长到90%时,加入蛋白液消化,传代保存,以备后用。
1.3 药物配置及分组
AG1478 溶解在DMSO 溶液中,配置成5、10、15、20 μmol 浓度的储蓄液,保存环境为-20 ℃;CaOV-3 细胞分为空白组和干预组,空白组为无药物干预的CaOV-3 细胞,干预组分别为干预A 组(5 μmol 的AG1478 溶液)、干预B 组(10 μmol 的AG1478 溶液)、干预C 组(15 μmol 的AG1478 溶液)和干预D 组(20 μmol 的AG1478 溶液),采用不同浓度的AG1478 干预。
1.4 MTT 法检测CaOV-3 细胞抑制率
采用传代方法将各组CaOV-3 细胞按5×10/ml接种到96 孔板中,于含有1%胎牛血清的培养基中同步消化。吸去原培养液,每个浓度6 个复孔,均加入5 mg/ml 的MTT 溶液20 μl,培养24、48、72 h后,吸弃培养液,再在每个孔中加入50 μl DMSO,摇匀后放入490 nm 波长下检测光密度(optical density,OD)值,取3 次平均值,细胞抑制率(%)=100%-(实验组OD 值-空白组OD 值)/(对照组OD值-空白组OD 值)×100%。
1.5 流式细胞仪检测CaOV-3 细胞凋亡率
将0.25%蛋白酶消化的CaOV-3细胞以5×10/ml接种到胎牛血清培养基中过夜,24 h 后,收集每组细胞,选择3 个样本,磷酸盐缓冲液(phosphate buffered solution,PBS)洗涤1 次,100 μl 接种于5 ml 流式试管中,将5 μl 的膜联蛋白V(Annexin V)-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)与5 μl碘化丙啶(propidium iodide,PI)混合后染色,无光条件下,孵育15 min 后注入400 μl 结合缓冲液混匀,予以洗涤3 次,后采用流式细胞仪分析CaOV-3细胞凋亡率。
1.6 Transwell 小室检测CaOV-3 细胞侵袭能力
各组CaOV-3 细胞数目为5×10/ml,将50 mg/L的基质胶稀释后加入小室上层,上室中加入细胞悬液,下室中加入少量胎牛血清培养基,培养48 h,拭去残留细胞,0.1%结晶紫染色,计算CaOV-3 侵袭细胞数。
1.7 蛋白质印迹(Western blot)法检测PAI-1 和uPAR 蛋白表达
各组CaOV-3 细胞接种、数量同上,加入少量胰蛋白酶消化后,运转离心机后保留上清液,放入样孔中,进行电泳实验。聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜用TBS 缓冲液浸泡10 min,反复PBS 冲洗,每次5 min,加入一抗PAI-1、uPAR和GAPDH 抗体(1∶500),二抗加入羊抗小鼠免疫球蛋白G(immunoglobulin G,IgG)(1∶2000),杂交冲洗。后将膜浸入电化学发光(electrochemiluminescence,ECL)工作液,随后进行检测,获取图像。
1.8 RT-PCR 法检测PAI-1、uPAR mRNA
检测CaOV-3 细胞株中PAI
-1
、uPAR
基因,严格按照PCR 仪器说明书进行操作。各组5×10/ml 的CaOV-3 细胞用0.125%胰蛋白酶消化,1000 r/min离心20 min(离心半径15 cm),采用Trizol 法提取总RNA,无核酸酶溶解。将提取的RNA 反转录为cDNA,获得反转录体系,条件:42 ℃作用60 min,72 ℃作用5 min,4 ℃终点。每个细胞设置6 个复孔,以GAPDH
为内参,反应条件为95 ℃预作用3 min,95 ℃作用5 s,58 ℃退火,共40个循环(表1)。
表1 引物序列
1.9 统计学分析

2 结果
2.1 AG1478 对CaOV-3 细胞抑制率的影响
不同时间点各组CaOV-3 细胞抑制率比较,差异均有统计学意义(P
<0.01)。不同时间点干预B组、干预C组和干预D组CaOV-3细胞抑制率均高于干预A组,干预D组CaOV-3细胞抑制率均高于干预B 组,差异均有统计学意义(P
<0.05);其余干预组间比较,差异均无统计学意义(P
>0.05)。(表2)
表2 不同时间点各组CaOV-3细胞抑制率的比较(%,±s)
2.2 AG1478 对CaOV-3 细胞凋亡率的影响
各组CaOV-3 细胞凋亡率比较,差异有统计学意义(P
<0.01)。干预组CaOV-3 细胞凋亡率均高于空白组,干预B 组、干预C 组、干预D 组CaOV-3细胞凋亡率均高于干预A 组,干预D 组CaOV-3细胞凋亡率高于干预B 组,差异均有统计学意义(P
<0.05)。(表3、图1)
图1 流式细胞仪检测各组CaOV-3细胞的凋亡率

表3 各组CaOV-3 细胞凋亡率的比较(%,±s)
2.3 AG1478 对CaOV-3 细胞侵袭数目的影响
各组CaOV-3 细胞侵袭数目比较,差异有统计学意义(P
<0.01)。干预组CaOV-3 细胞侵袭数目均少于空白组,干预B 组、干预C 组及干预D 组CaOV-3 细胞侵袭数目均少于干预A 组,干预D 组CaOV-3 细胞侵袭数目少于干预B 组,差异均有统计学意义(P
<0.05)。(图2、表4)
表4 各组CaOV-3 细胞侵袭数目的比较(±s)
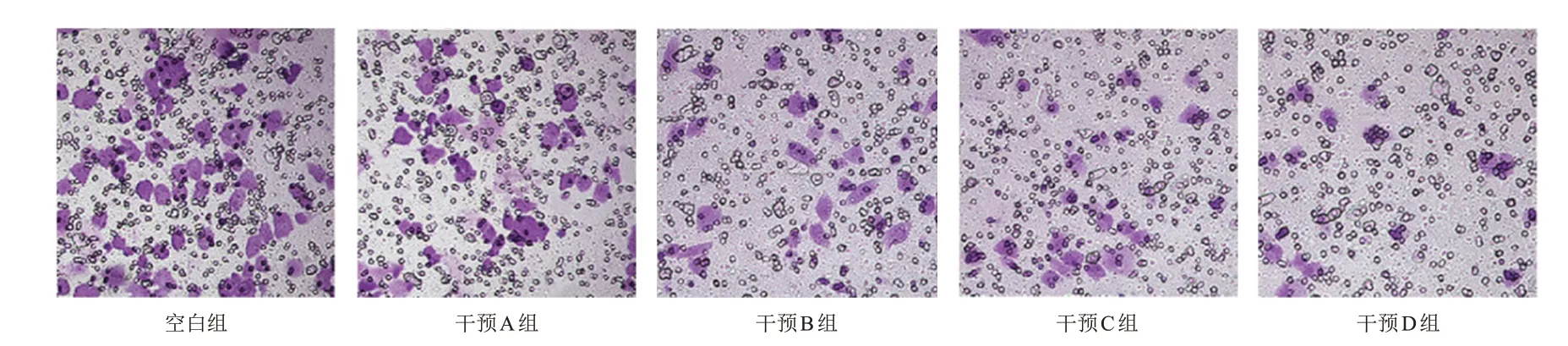
图2 Transwell小室检测各组CaOV-3细胞侵袭能力(结晶紫染色,×200)
2.4 Western blot法检测PAI-1、uPAR蛋白表达情况
各组CaOV-3 细胞中PAI-1 和uPAR 蛋白表达量比较,差异均有统计学意义(P
<0.01)。干预组CaOV-3 细胞中PAI-1 和uPAR 蛋白表达量均低于空白组,干预B 组、干预C 组及干预D 组CaOV-3 细胞中PAI-1 和uPAR 蛋白表达量均低于干预A 组,干预D 组CaOV-3 细胞中PAI-1 和uPAR 蛋白表达量均低于干预B 组,差异均有统计学意义(P
<0.05)。(表5、图3)
图3 Western blot法检测各组CaOV-3细胞中PAI-1和uPAR蛋白表达情况

表5 各组CaOV-3 细胞中PAI-1 和uPAR 蛋白表达量的比较(±s)
2.5 RT-PCR 法检测PAI-1、uPAR mRNA 表达情况
各组CaOV-3 细胞中PAI
-1
、uPAR
mRNA 比较,差异均有统计学意义(P
<0.01)。干预组CaOV-3细胞中PAI
-1
、uPAR
mRNA 均低于空白组,干预B组、干预C 组及干预D 组CaOV-3 细胞中PAI
-1
、uPAR
mRNA 均低于干预A 组,干预D 组CaOV-3 细胞中PAI
-1
、uPAR
mRNA 均低于干预B 组,差异均有统计学意义(P
<0.05)。(表6)
表6 各组CaOV-3 细胞中PAI-1、uPAR mRNA 表达水平的比较(±s)
3 讨论
目前,降低卵巢癌细胞生长、侵袭的干预机制在于减少肿瘤细胞核中DNA 复制及合成,或抑制DNA 有丝分裂,对肿瘤细胞产生毒性损伤,但是缺点在于不能排除对非肿瘤细胞的破坏,损害机体免疫功能。肿瘤分子生物学的研究开创了治疗卵巢癌等多种恶性肿瘤的新纪元,靶向治疗方法在治疗肿瘤疾病中具有重要意义。卵巢癌患者中发现酪氨酸激酶受体家族的异常表达,因此,以酪氨酸激酶受体作为靶点的治疗,通过使肿瘤细胞内酪氨酸激酶结构域发生改变使其活性受到抑制。AG1478 是EGFR 靶向抑制剂,在以往文献中证实能够抑制宫颈癌、乳腺癌、胃癌及子宫内膜癌细胞生长。
卵巢癌细胞生物学行为异常是肿瘤发生、发展的重要因素,因此了解其影响生物学行为的关键因子至关重要。EGFR 可以在细胞表面被检测,是一种跨膜糖蛋白,是细胞生长调节因子,当EGFR异常时细胞增殖不受控制,发生持续性增殖,导致恶性转化。卵巢癌细胞EGFR 过度激活可引起下游一系列信号转导,进一步诱发卵巢癌细胞快速生长、分化导致细胞永生化。张宝月和张俊农研究表示,卵巢癌细胞中存在EGFR 表达,结合相应配体后会启动肿瘤细胞生长周期,酪氨酸蛋白激酶(tyrosine protein kinase,TPK)信号可激活肿瘤细胞信号转导系统,将生长信号传递至细胞核内,刺激卵巢癌细胞生长及侵袭。卵巢癌细胞中针对EGFR 的靶向治疗的主要方法包含阻断EGFR 结合配体,减少自身磷酸化,降低二聚体形成而阻断信号向细胞核内传递,其次是使用EGFR抑制剂,通过减少EGFR 激酶上腺苷三磷酸(adenosine triphosphate,ATP)结合点结合,影响靶基因的转录及蛋白表达,减少卵巢癌细胞侵袭、转移及血管生成。AG1478 作为新型EGFR 抑制剂,能够通过干扰肿瘤细胞信号转导,竞争性与ATP 结合区结合,减少EGFR 表达,减少转导信号传入从而引起一系列细胞生物学行为改变而发挥抑癌作用。以往文献证实,体外胃癌细胞实验采用不同浓度的AG1478干预后胃癌细胞生物学行为侵袭及迁移能力降低,凋亡加剧,与依赖性抑制磷脂酰肌醇-3-羟激酶(phosphatidylinositol 3-hydroxy kinase,PI3K)/蛋白激酶B(protein kinase B,PKB,又称AKT)信号通路上调叉头框蛋白O3a(forkhead box O3a,FOXO3a)信号通路发挥作用相关。刘粉霞等证实,AG1478 通过调节促凋亡基因增加细胞凋亡信号因子表达而增加胃癌细胞凋亡,降低侵袭及转移能力。本研究中,与空白组相比,干预组CaOV-3细胞生长、侵袭能力减弱,凋亡提高,且具有时间剂量依赖性,说明AG1478 对卵巢癌细胞生长及侵袭具有抑制作用,机制可能与EGFR 信号活性抑制后伴随PI3K/AKT 信号及Janus 激酶(Janus kinase,JAK)/信号转导及转录激活因子(signal transduction and activator of transcription,STAT)、磷脂酶Cγ(phospholipase C-γ,PLC-γ)下游因子信号失活,信号转导阻碍,导致细胞增殖减慢,细胞凋亡信号通路表达活跃而加快卵巢癌细胞凋亡有关。
PAI-1 是纤溶过程调节因子,表达增加能够导致血栓性疾病及恶性肿瘤疾病。卵巢癌细胞中PAI-1 阳性表达升高,外源性转染后能够提高卵巢癌细胞活性,增加转移能力,且临床诊断中PAI-1与患者病理分期升高及发生转移存在相关性,说明PAI-1 是检测卵巢癌患者肿瘤转移及预后的重要指标。uPAR 在卵巢癌细胞侵袭及转移中发挥促进作用,能够通过激活金属蛋白酶降解卵巢癌细胞外基质,调节细胞活性。贺珊等证实,与癌旁组织相比,uPAR 在卵巢癌组织中表达水平升高,与肿瘤复发、分期及预后相关。PAI-1 和uPAR 在卵巢癌细胞中能够特异性结合形成复合物,随后发生降解出现细胞表面分布不均,能够增加卵巢癌细胞增殖及浸润能力。张孔雁等证实PAI-1 能够与uPAR 上游因子uPA 结合,减少uPA 过度消化,起到促进作用。PAI-1 能够减少卵巢癌组织降解,且参与血管生成作用。EGFR 信号与PAI-1 之间存在关联,在国外研究中指出EGFR
siRNA 阻断PAI-1以及Raf-1 表达,丝裂原活化蛋白激酶(mitogen-activated protein kinase,MEK)/细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)信号通路通过PAI-1 的表达调节发挥抗疾病作用。Alberti 等证实,在血管破裂疾病中AG1478 抑制EGFR 信号转导或引入激酶缺陷的EGFR 构建体可有效阻断PAI-1 和结缔组织生长因子(connective tissue growth factor,CTGF)的表达,说明AG1478 具有抑制PAI-1 作用。本研究中,干预组细胞中PAI-1 和uPAR 蛋白及基因表达均降低,可能与AG1478抑制ERK 信号通路细胞信号转导,抑制卵巢癌细胞生物学行为,调节凋亡信号通路相关,机制还需进一步研究。本研究具有一定不足,实验方法存在单一性,研究机制需要进一步完善,对实验结果可能产生偏差,后期本课题组会增加样本量,细化实验内容,为卵巢癌临床研究提供实践依据。
综上所述,EGFR 抑制剂AG1478 能够有效降低卵巢癌CaOV-3细胞存活率及侵袭性,加快凋亡,这与阻碍PAI-1 和uPAR 信号通路表达相关。

