培美曲塞联合顺铂与吉西他滨联合顺铂治疗ⅢB、Ⅳ期非小细胞肺癌的疗效比较
金烨,戴莉莉,秦斌斌,沈斌,刘炎,郑琪
上海交通大学医学院附属第九人民医院黄浦分院1重症医学科,2呼吸内科,上海 200011
肺癌中以非小细胞肺癌(non-small cell lung cancer,NSCLC)居多,NSCLC 患者早期表现隐匿,大多数患者就诊时已发展至ⅢB、Ⅳ期,手术治疗意义不大,因此化疗成为ⅢB、Ⅳ期NSCLC 患者的主要治疗方法。铂类药物可通过引起DNA 复制紊乱进而抑制肿瘤细胞增殖,其抗肿瘤活性较高,但价格昂贵且伴有一定的神经毒性,临床常与其他化疗药物联用来降低其用药剂量并提高疗效。吉西他滨属于嘧啶类化疗药物,既往临床上常与铂类药物联合用于NSCLC 患者的治疗,其代谢产物通过作用于肿瘤细胞的DNA 合成期进而破坏DNA 形成,抑制肿瘤细胞生长,促进肿瘤细胞凋亡,但由于血液学毒性明显,耐药性强,长期使用会引起患者免疫力低下,远期疗效不佳。培美曲塞可抑制多个靶点代谢,抑制DNA 复制进而有效抑制肿瘤细胞增殖,既往研究显示培美曲塞具有低毒、广谱、高效的特点,在晚期肺癌一二线治疗和维持治疗中的应用日益普遍。研究表明,与吉西他滨联合其他抗肿瘤药物相比,培美曲塞联合其他抗肿瘤药物治疗肺癌的临床疗效及患者的免疫力均较高,肿瘤标志物、基质金属蛋白酶2(matrix metalloproteinase 2,MMP2)表达水平降低程度较明显,肿瘤细胞浸润程度较轻,安全性较好。因此,在ⅢB、Ⅳ期NSCLC 患者中,培美曲塞与其他抗肿瘤药物联用可能较吉西他滨与其他抗肿瘤药物联用疗效显著,且可降低肿瘤标志物水平,减少肿瘤血管生成,提高机体免疫力。本研究比较了培美曲塞联合顺铂与吉西他滨联合顺铂治疗NSCLC 患者的近期疗效及对肿瘤标志物水平、肿瘤血管生成指标、免疫功能指标的影响,现报道如下。
1 资料与方法
1.1 一般资料
收集2016 年7 月至2020 年7 月于上海交通大学医学院附属第九人民医院黄浦分院就诊的NSCLC 患者的病历资料。纳入标准:①年龄≥18岁;②依据相关诊断标准,经病理检查和影像学检查确诊为NSCLC;③依据国际抗癌联盟制定的肿瘤淋巴结转移(tumor node metastasis,TNM)分期标准,临床分期为ⅢB、Ⅳ期,均为鳞状细胞癌;④既往无抗肿瘤治疗史;⑤均接受2 个周期化疗且中间不间断;⑥临床资料完整。排除标准:①具有化疗禁忌证和(或)对治疗用药过敏史;②合并其他恶性肿瘤;③合并先天性疾病;④合并心、肺等严重器质性疾病;⑤合并肝、肾功能不全;⑥合并血液系统疾病;⑦合并精神行为异常。依据纳入和排除标准,本研究共纳入68 例NSCLC 患者。根据治疗方法的不同将患者分为观察组和对照组,每组34 例。观察组中,男19 例,女15 例;年龄38~70 岁,平均(52.39±9.25)岁;分化程度:低分化25 例,中分化9 例;TNM 分期:ⅢB 期15 例,Ⅳ期19 例;合并高血压5 例;合并糖尿病6 例。对照组中,男17 例,女17 例;年龄36~71 岁,平均(52.43±9.56)岁;分化程度:低分化23 例,中分化11 例;TNM 分期:ⅢB 期17 例,Ⅳ期17 例;合并高血压6例;合并糖尿病4 例。两组患者的性别、年龄、分化程度、TNM 分期、合并高血压和糖尿病情况比较,差异均无统计学意义(P
>0.05),具有可比性。1.2 治疗方法
两组患者均在化疗前一周及化疗期间常规给予营养支持、止吐、胃肠保护等措施;化疗前两天口服地塞米松,每次3.75 mg,每天2 次,持续用药3 天。
对照组患者采用吉西他滨联合顺铂治疗:第1天和第8 天,静脉滴注盐酸吉西他滨1 g/m;化疗次日至第4 天,每天静脉滴注顺铂25 mg/m;后期关注相关不良反应,3 周为1 个化疗周期,每个化疗周期结束后立刻检测肝肾功能和血常规。
观察组患者采用培美曲塞联合顺铂治疗:化疗两周前口服叶酸片,每次400 μg,每日一次,持续用药至化疗结束后4 周;化疗前1 周肌内注射维生素B1 mg,随后每3 周注射1 次,每次1 mg。计算体表面积,化疗首日静脉滴注培美曲塞500 mg/m,顺铂用药方案同对照组;后期关注相关不良反应,3周为1 个化疗周期,每个化疗周期结束后立刻检测肝肾功能和血常规。
两组患者均化疗2 个周期,中间不间断,即6 周。
1.3 观察指标及评价标准
1.3.1 近期疗效 采用实体瘤疗效评价标准(response evaluation criteria in solid tumor,RECIST)
进行疗效评价。完全缓解(complete response,CR):靶病灶均消失,且无新发病灶;部分缓解(partial response,PR):靶病灶的最大径总和减少≥30%,至少持续4 周;疾病稳定(stable disease,SD):靶病灶的最大径总和减少未达PR 或增加未达疾病进展(progressive disease,PD);PD:靶病灶的最大径总和增加≥20%或出现新发病灶。客观缓解率(objective response rate,ORR)=(CR+PR)例数/总例数×100%。
1.3.2 肿瘤标志物水平和肿瘤血管生成指标 分别于治疗前后抽取两组患者的清晨空腹静脉血15 ml,取5 ml 静置1 h 后置于离心机中3000 r/min离心10 min,取上层血清,采用酶联免疫吸附法测定癌胚抗原(carcinoembryonic antigen,CEA)、细胞角质蛋白19 片段抗原21-1(cyto-keratin 19 fragment antigen 21-1,CYFRA21-1)、MMP2 及基质金属蛋白酶9(matrix metalloproteinase 9,MMP9)水平。
1.3.3 免疫功能指标 分别于治疗前后抽取两组患者的清晨空腹静脉血15 ml,取5 ml 采用流式细胞仪检测全血CD3、CD4、CD8水平,并计算CD4/CD8。
1.3.4 不良反应发生情况 记录治疗期间两组患者的不良反应发生情况,包括脱发、恶心呕吐、白细胞减少、血小板减少、肝功能下降、肾功能下降。
1.4 统计学方法

2 结果
2.1 近期疗效的比较
观察组患者的ORR 为82.35%(28/34),高于对照组的55.88%(19/34),差异有统计学意义(χ
=5.581,P
=0.018)。(表1)
表1 两组患者的近期疗效[n(%)]*
2.2 肿瘤标志物水平的比较
治疗前,两组患者的血清CEA、CYFRA21-1 水平比较,差异均无统计学意义(P
>0.05);治疗后,两组患者的血清CEA、CYFRA21-1 水平均低于本组治疗前,且观察组患者的血清CEA、CYFRA21-1水平均低于对照组,差异均有统计学意义(P
<0.05)。(表2)
表2 治疗前后两组患者肿瘤标志物水平的比较(μg/ml,±s)
2.3 肿瘤血管生成指标的比较
治疗前,两组患者的血清MMP2 和MMP9 水平比较,差异均无统计学意义(P
>0.05);治疗后,两组患者的血清MMP2 和MMP9 水平均低于本组治疗前,且观察组患者的血清MMP2 和MMP9 水平均低于对照组,差异均有统计学意义(P
<0.05)。(表3)
表3 治疗前后两组患者肿瘤血管生成指标的比较(pg/L,±s)
2.4 免疫功能指标的比较
治疗前,两组患者的CD3、CD4、CD8水平及CD4/CD8比较,差异均无统计学意义(P
>0.05);治疗后,两组患者的CD3、CD4水平及CD4/CD8均高于本组治疗前,CD8水平均低于本组治疗前,且观察组患者的CD3、CD4水平及CD4/CD8均高于对照组,CD8水平低于对照组,差异均有统计学意义(P
<0.05)。(表4)
表4 治疗前后两组患者免疫功能指标的比较(±s)
2.5 治疗期间不良反应发生情况的比较
治疗期间,观察组患者白细胞减少及血小板减少的发生率均低于对照组,差异均有统计学意义(P
<0.05);两组患者脱发、恶心呕吐、肝功能下降、肾功能下降的发生率比较,差异均无统计学意义(P
>0.05)。(表5)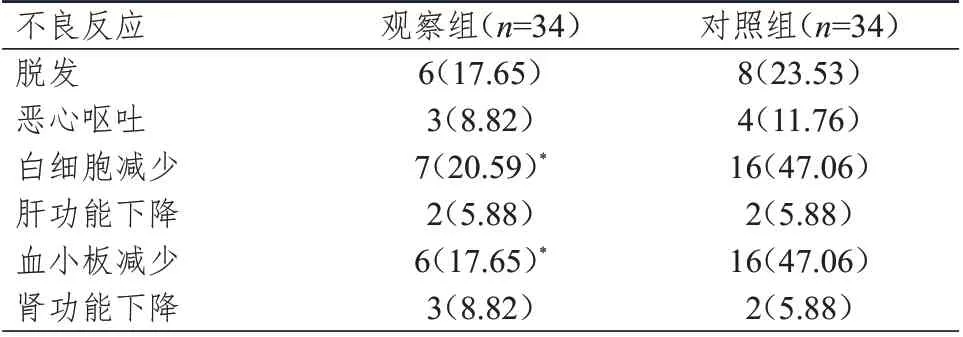
表5 治疗期间两组患者不良反应发生情况的比较[n(%)]
3 讨论
ⅢB、Ⅳ期NSCLC 侵袭力较强,患者多伴有免疫力低下、癌痛甚至转移,手术风险较高,多以化疗为主,临床经典用药方案为吉西他滨联合顺铂。吉西他滨和顺铂可通过扰乱细胞周期发挥细胞毒性,抑制病情进展,但治疗后白细胞减少较明显,这会加剧患者的免疫稳态失衡,造成预后不良。培美曲塞的靶向性可以实现以较少用量控制疾病进展,与顺铂联用的耐药性较低,不良反应较小且抗肿瘤疗效明显。
本研究结果显示,治疗后,观察组患者的ORR高于对照组,与罗志兵等研究结果相似;观察组患者的血清CEA、CYFRA21-1 水平均低于对照组,与李远航和白维君的研究结果相似,血清CEA、CYFRA21-1 水平与NSCLC 病情进展呈正相关,提示培美曲塞与顺铂联用的抗肿瘤活性较高,肿瘤细胞增殖可被有效抑制,疗效更明显。出现上述结果的原因可能是培美曲塞可靶向抑制肿瘤细胞代谢,首先影响叶酸代谢,进一步抑制嘌呤核苷酸和嘧啶核苷酸合成,使肿瘤细胞增殖由于缺乏物质基础而在S 期终止,培美曲塞较吉西他滨的耐药性小,故肿瘤抑制效果更明显。此外,不良反应会通过影响患者的耐受性和依从性进而影响化疗疗效,吉西他滨的血液学毒性和胃肠道反应较大,因此对照组患者的疗效较观察组差。治疗后,观察组患者的MMP2、MMP9 水平均低于对照组,与王晓东的研究结果相似。MMP2、MMP9 水平升高可促进细胞外基质降解,增强肿瘤细胞的浸润性,促进肿瘤血管生成。本研究结果提示治疗后观察组患者的肿瘤血管生成受抑制,侵袭力下降更明显。原因可能是培美曲塞不仅可以有效抑制肿瘤的侵袭力,而且能够抑制微小RNA(microRNA,miRNA)-21 的表达,而miRNA-21 可调节血管生成因子的表达及磷酸化,进而促进肿瘤血管生成。因此,治疗后观察组患者的MMP2、MMP9水平下降程度更明显。
本研究结果显示,治疗后观察组患者的CD3、CD4水平及CD4/CD8均高于对照组,CD8水平低于对照组。提示治疗后观察组患者的免疫力较强,与薛英杰等研究结果相似,原因可能是两种治疗方法均可在促进肿瘤细胞凋亡的过程中激活T 细胞免疫应答,但吉西他滨可引起CD34这类造血前体细胞出现DNA损伤,进而引起部分造血细胞凋亡,导致患者贫血的发生率增加,免疫力下降。治疗后观察组患者白细胞减少及血小板减少的发生率均低于对照组,与Zhang 等研究结果相似。提示观察组患者的血液学毒性较小,原因可能是化疗药物会在杀伤肿瘤细胞的同时损害正常白细胞,但培美曲塞是一种多靶点的抗代谢药物,起效较快,肿瘤缩小快,可导致白细胞损伤后尽快恢复;吉西他滨可通过抑制相关细胞因子及基因表达来抑制巨核细胞生成前血小板和血小板释放,促进造血前体细胞出现DNA 损伤,进而引起部分造血细胞凋亡,导致骨髓抑制更明显。然而本研究也存在不足,本研究为回顾性分析且未比较两组患者的远期疗效,研究对象均来自同一医院,可能具有一定的选择偏倚,未来会尽可能纳入多家医院的患者并进行进一步随访研究。
综上所述,与吉西他滨联合顺铂相比,培美曲塞联合顺铂治疗ⅢB、Ⅳ期NSCLC 患者的近期疗效较佳,可有效降低肿瘤标志物水平,抑制肿瘤血管生成,调节免疫应答且血液学毒性较小。

